2.3: Espectroscopia UV-Visible de Compuestos Orgánicos
- Page ID
- 79113
Muchos de los colores que vemos en la naturaleza no provienen de simples átomos, sino de moléculas. Los compuestos orgánicos —compuestos a base de carbono, generalmente hechos por seres vivos— a veces son de colores muy brillantes. Si miras un día de otoño y ves a una mujer de jeans azules caminando bajo un arce naranja, entonces estás observando un par de compuestos orgánicos.
El color azul de sus jeans es probablemente índigo, un tinte conocido desde la antigüedad, pero que a menudo se produce sintéticamente en la actualidad. Todavía tiene el mismo color, pero es producido por trabajadores de fábrica en lugar de manos de campo.
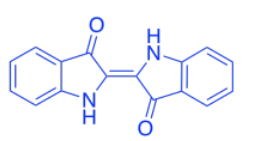
El color de las hojas proviene de una mezcla de diferentes compuestos como el caroteno. El caroteno es miembro de una gran clase de productos naturales llamados terpenoides.
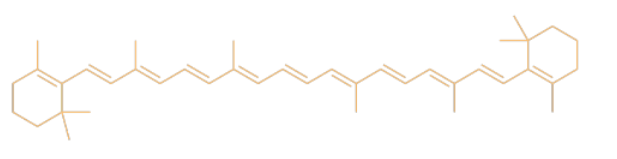
¿Qué color de luz es absorbido por (a) los vaqueros azules? b) ¿las hojas?
- Respuesta a:
-
azul
- Respuesta b:
-
naranja
En la mayoría de los casos, la razón del color está ligada a un fenómeno en estos compuestos: la conjugación. La conjugación es un patrón específico en la disposición electrónica de las moléculas. Una estructura de Lewis de una molécula conjugada muestra enlaces simples y dobles alternantes entre los átomos de carbono. En algunos casos, también puede haber átomos de oxígeno o nitrógeno involucrados en estos enlaces dobles y simples alternantes.
Resulta que la conjugación tiene un efecto muy predecible sobre los niveles de energía de los electrones involucrados en esos enlaces alternos. Se mancha los niveles de energía. Algunos de ellos son empujados un poco más altos en energía. Algunos bajan un poco más abajo. Muchos de ellos se dispersan en el medio. Como resultado, las brechas entre esos niveles de energía se vuelven cada vez más pequeñas a medida que aumenta la cantidad de conjugación en una molécula.
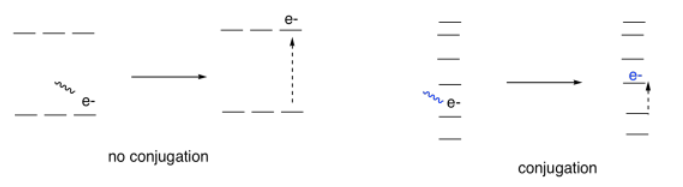
Entonces, si empezamos a medir los espectros UV de un montón de compuestos, comenzamos a ver evidencia de ese fenómeno de conjugación a partir del índigo y el caroteno. Cada vez que añadimos un doble enlace a un sistema conjugado, la longitud de onda de la luz absorbida aumenta. Es un incremento significativo: tal vez cuarenta o cincuenta nanómetros para el primer doble enlace o dos que añadimos en conjugación, aunque las diferencias se harían un poco más pequeñas si seguimos agregando más de ellos.
| λ máx (nm) | |
| C=C | 170 |
| C=C-C=C | 220 |
| C=C-C=C-C=C | 260 |
El ácido benzoico tiene una absorción máxima a 230 nm. ¿Dónde esperas ver el máximo de absorción en el ácido cinámico?
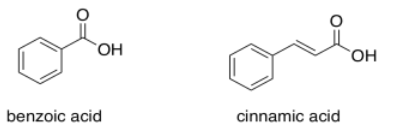
- Contestar
-
Agrega otros 30 o 40 nm y llegas a 270 o 280 nm.
Los sistemas poliaromáticos tienen espectros UV bastante complicados, pero a medida que se agrega cada anillo aromático adicional, se produce un desplazamiento de aproximadamente 30 nm en el máximo de absorción del pico más prominente. Si el naftaleno tiene λ max a 220 nm, ¿dónde verías λ max para antraceno y tetraceno?
- Respuesta a:
-
cerca de 250 nm
- Respuesta b:
-
alrededor de 280 nm
La conjugación es responsable de gran parte de la absorción visible por los compuestos orgánicos porque el espaciamiento energético entre los orbitales π y π* cae dentro del mismo rango de energía que la luz visible. Como resultado, los electrones pueden excitarse de un nivel π a un nivel π* cuando esa luz visible es absorbida.
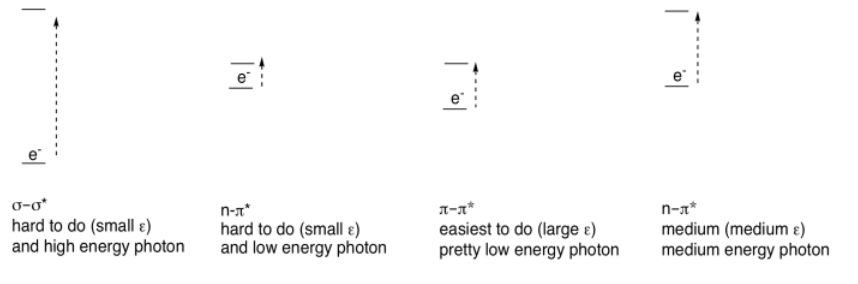
Hay otros electrones (distintos de los que están en los enlaces π) que pueden ser excitados por la absorción de la luz visible. Si la molécula tiene enlaces sigma, siempre existe la posibilidad de una transición σ a σ*, en la que un electrón en un enlace σ se excita al nivel antienlace. Si la molécula tiene pares solitarios, podría haber transiciones n a σ* o transiciones n a π* (n es no enlazante).
Sin embargo, ninguno de estos absorbe la luz tan fuertemente como las transiciones π a π*. Así como hubo diferencias en la fuerza de absorbancias (coeficientes de extinción) en compuestos de metales de transición (donde el MLCT absorbió la luz fuertemente, pero las transiciones d-d absorbieron la luz solo débilmente), vemos grandes coeficientes de extinción para π a π* pero solo coeficientes diminutos para las transiciones σ a σ*, para ejemplo. Estas diferencias están relacionadas con las relaciones espaciales entre los dos orbitales involucrados en cada caso, más que con las diferencias de energía.
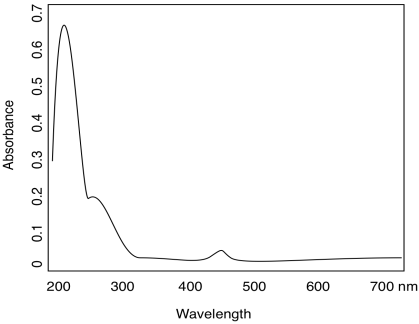
Los compuestos orgánicos, como los metales de transición, pueden tener absorciones de diferentes resistencias. Considere la siguiente tabla para quinona:
| λ (nm) | ε (cm 2 mol -1) |
| 240 | 24 000 |
| 280 | 400 |
| 430 | 20 |
- Utilice la tabla de datos para quinona para bosquejar un espectro UV.
- ¿De qué color es la quinona?
- Respuesta a:
-
- Respuesta b:
-
amarillo
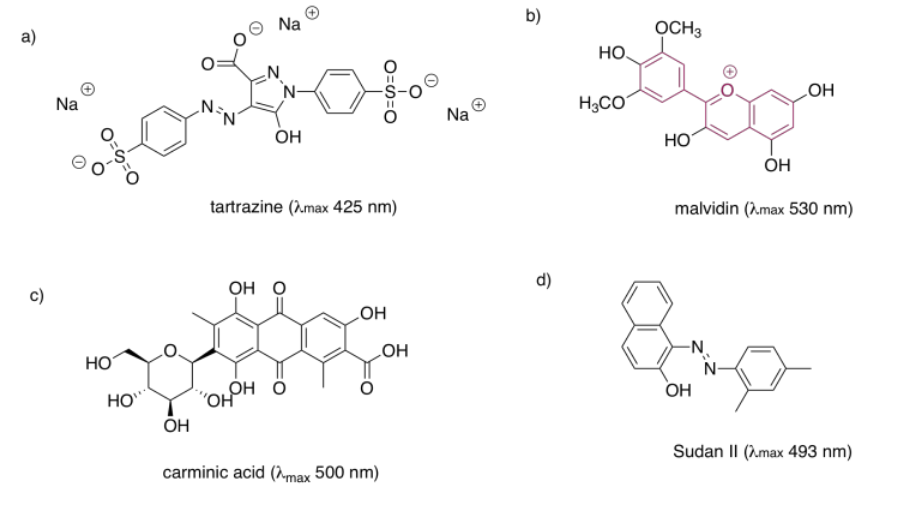
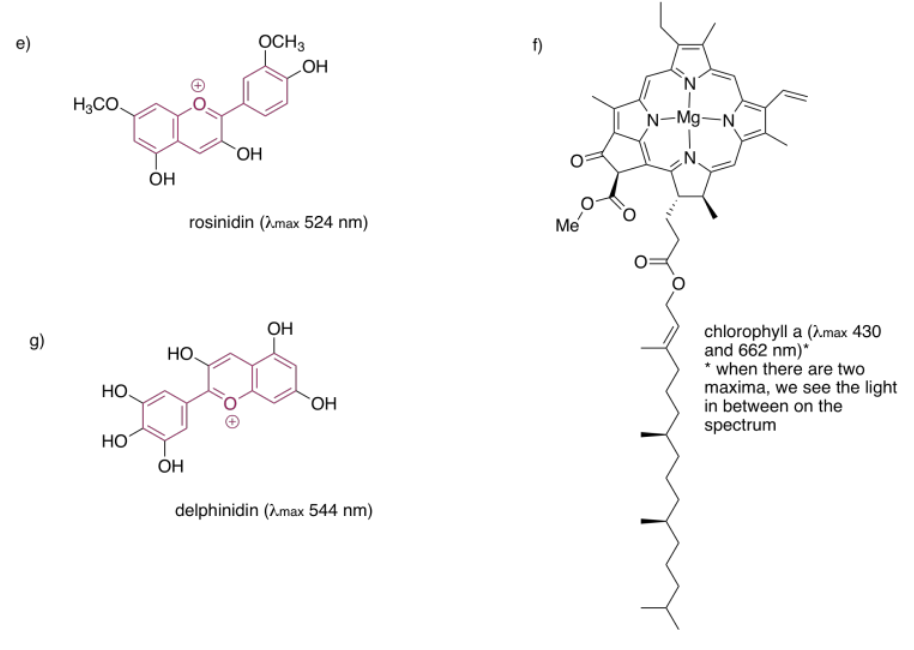
Las estructuras que son muy buenas para absorber la luz visible a veces se llaman cromóforos. Hay muchos cromóforos comunes en la naturaleza, como esa estructura terpenoide extendida que se ve en los carotenos; una estructura similar se encuentra en el licopeno, lo que le da a los tomates su color rojo.
Las quinonas también se ven muy comúnmente en los cromóforos. En los humanos, el cromóforo más común es la melanina; su color marrón se deriva de una estructura basada en quinonas. Una estructura de quinona diferente, la alizarina, es un tinte conocido desde la antigüedad; históricamente se derivó de la raíz más loca.
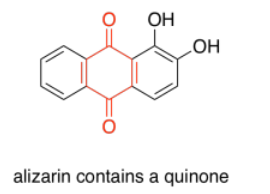
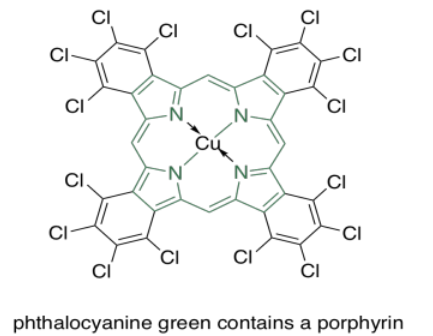
Las porfirinas también son muy comunes en humanos y otros organismos. Se encuentran en compuestos como la hemoglobina, conocidos más por su capacidad de transporte de oxígeno y otras propiedades imperdibles que su color. Sin embargo, son de colores bastante brillantes. Curiosamente, los colores de las porfirinas y otros cromóforos se pueden ajustar con bastante facilidad a través de la variación de grupos laterales alrededor de la estructura principal. El verde de ftalocianina, por ejemplo, tiene la misma estructura de porfirina que el hemo rojo sangre, pero está modificado por anillos aromáticos adicionales y átomos de cloro, y contiene un cobre en lugar de un hierro. Estos grupos modificadores de color se denominan autocromos.
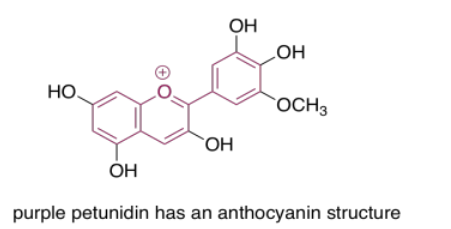
Las antocianinas son otro grupo extendido de compuestos naturales. Al igual que las porfirinas y las quinonas, contienen una variedad de autocromos; los grupos dispuestos alrededor de la estructura central de tres anillos que forma el cromóforo esencial de las antocianinas. Las variaciones entre estos grupos laterales conducen a una variedad de colores que van del rojo al azul. El que se muestra a continuación le da un color púrpura a las flores —petunias— en las que se encuentra frecuentemente.
Un último grupo de cromóforos comunes no se encuentra en la naturaleza en absoluto. Estos son los tintes azoicos, descubiertos en el siglo XIX y todavía en uso generalizado en la actualidad.
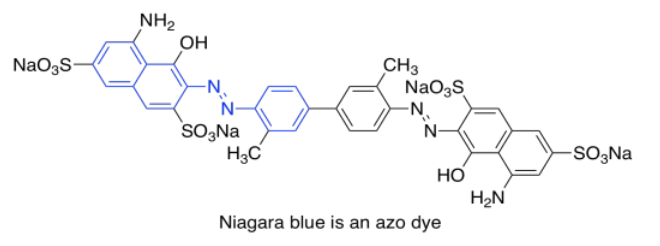
Tenga en cuenta que los efectos de los autocromos pueden ser algo complicados para afinar la absorción del cromóforo principal. La identidad del grupo lateral no solo tiene influencia (como el grupo sulfonato, SO 3 -, o un grupo amina, NH 2, en un colorante azo), sino que la posición exacta del grupo también es importante. En realidad hay una lista de reglas (Woodward Rules) que se pueden usar para predecir máximos de absorción de sistemas conjugados, pero no vamos a entrar en esas aquí.
En cada uno de los siguientes pigmentos,
- círculo el cromóforo principal.
- identificar la clase de cromóforo.
- predecir el color observado.
- Contestar
-


