6.3.5: Termodinámica de la Acidez y Basicidad de Brønsted en Fase de Solución
- Page ID
- 81248
El comportamiento de los ácidos y bases de Brønsted-Lowry en solución está fuertemente influenciado por la solvatación
Esto es particularmente cierto en sistemas acuosos en los que las energías y entropías de hidratación pueden ser bastante significativas. Considerar los cambios de entalpía y entropía para la disociación de una serie de ácidos en solución acuosa diluida a 25°C como se indica en la Tabla\( \PageIndex{1}\).
| Ácido |
\( \Delta S^°\) (J/mol-k) |
\(-T \times \Delta S^°\) (KJ/mol) |
\( \Delta H^°\) (KJ/mol) |
\( \Delta G^°\) (KJ/mol) |
\(K_a\) (calcd. de\( \Delta G^°\)) |
|---|---|---|---|---|---|
| HF | \ (\ Delta S^°\) (J/mol-k) ">-102 | \ (-T\ veces\ Delta S^°\) (kJ/mol) ">30 | \ (\ Delta H^°\) (KJ/mol) ">-16 | \ (\ Delta G^°\) (KJ/mol) ">14 | \ (K_a\) (calculado. de\( \Delta G^°\)) ">\(6.8 \times 10^{-4}\) |
| HCl | \ (\ Delta S^°\) (J/mol-k) ">-35 | \ (-T\ veces\ Delta S^°\) (kJ/mol) ">10 | \ (\ Delta H^°\) (KJ/mol) ">-57 | \ (\ Delta G^°\) (KJ/mol) ">-47 | \ (K_a\) (calculado. de\( \Delta G^°\)) ">\(10^8\) |
| HBr | \ (\ Delta S^°\) (J/mol-k) ">-13 | \ (-T\ veces\ Delta S^°\) (kJ/mol) ">4 | \ (\ Delta H^°\) (KJ/mol) ">-65 | \ (\ Delta G^°\) (KJ/mol) ">-61 | \ (K_a\) (calculado. de\( \Delta G^°\)) ">\(10^{10}\) |
| HOLA | \ (\ Delta S^°\) (J/mol-k) ">11 | \ (-T\ veces\ Delta S^°\) (kJ/mol) ">-3 | \ (\ Delta H^°\) (KJ/mol) ">-62 | \ (\ Delta G^°\) (KJ/mol) ">-65 | \ (K_a\) (calculado. de\( \Delta G^°\)) ">\(10^{11}\) |
| HClO | \ (\ Delta S^°\) (J/mol-k) ">-95.4 | \ (-T\ veces\ Delta S^°\) (kJ/mol) ">28.4 | \ (\ Delta H^°\) (KJ/mol) ">13.9 | \ (\ Delta G^°\) (KJ/mol) ">42.3 | \ (K_a\) (calculado. de\( \Delta G^°\)) ">\(4 \times 10^{-8}\) |
| HClO 2 | \ (\ Delta S^°\) (J/mol-k) ">-86.6 | \ (-T\ veces\ Delta S^°\) (kJ/mol) ">25.8 | \ (\ Delta H^°\) (KJ/mol) ">-14.6 | \ (\ Delta G^°\) (KJ/mol) ">11.2 | \ (K_a\) (calculado. de\( \Delta G^°\)) ">\(1.1 \times 10^{-2}\) |
| H 3 PO 4 → H + H 2 PO 4 - | \ (\ Delta S^°\) (J/mol-k) ">-66.9 | \ (-T\ veces\ Delta S^°\) (kJ/mol) ">20.0 | \ (\ Delta H^°\) (kJ/mol) ">-7.9 | \ (\ Delta G^°\) (KJ/mol) ">12.1 | \ (K_a\) (calculado. de\( \Delta G^°\)) ">\(7.9 \times 10^{-3}\) |
| CH 3 CO 2 H → H + CH 3 CO 2 - | \ (\ Delta S^°\) (J/mol-k) ">-92.4 | \ (-T\ veces\ Delta S^°\) (kJ/mol) ">27.5 | \ (\ Delta H^°\) (kJ/mol) ">-0.4 | \ (\ Delta G^°\) (KJ/mol) ">27.1 | \ (K_a\) (calculado. de\( \Delta G^°\)) ">\(1.8 \times 10^{-5}\) |
Como se puede observar a partir de los datos de la Tabla\( \PageIndex{1}\), la principal fuerza impulsora para la disociación de ácidos inorgánicos es la entalpía de disociación, la cual es exotérmica para todos los ácidos listados excepto HClO muy débilmente ácida. Por el contrario, el término entropía suele desfavorecer la disociación ya que es negativo para todos los ácidos excepto el HI débilmente polar (para lo cual contribuye poco a la energía libre global de disociación). La situación se invierte exactamente en el caso del ácido acético\(CH_3CO_2H\), para lo cual la entralflia de disociación es pequeña y la entropía es el contribuyente dominante a la energía libre.
Se puede obtener más información sobre los factores que gobiernan la fuerza ácida de Brønsted en solución acuosa examinando las contribuciones relativas de la ruptura del enlace H-A heterolítico y la hidratación a la entalpía de disociación. Esto se realiza utilizando el ciclo termodinámico representado en la Figura\(\PageIndex{1}\).
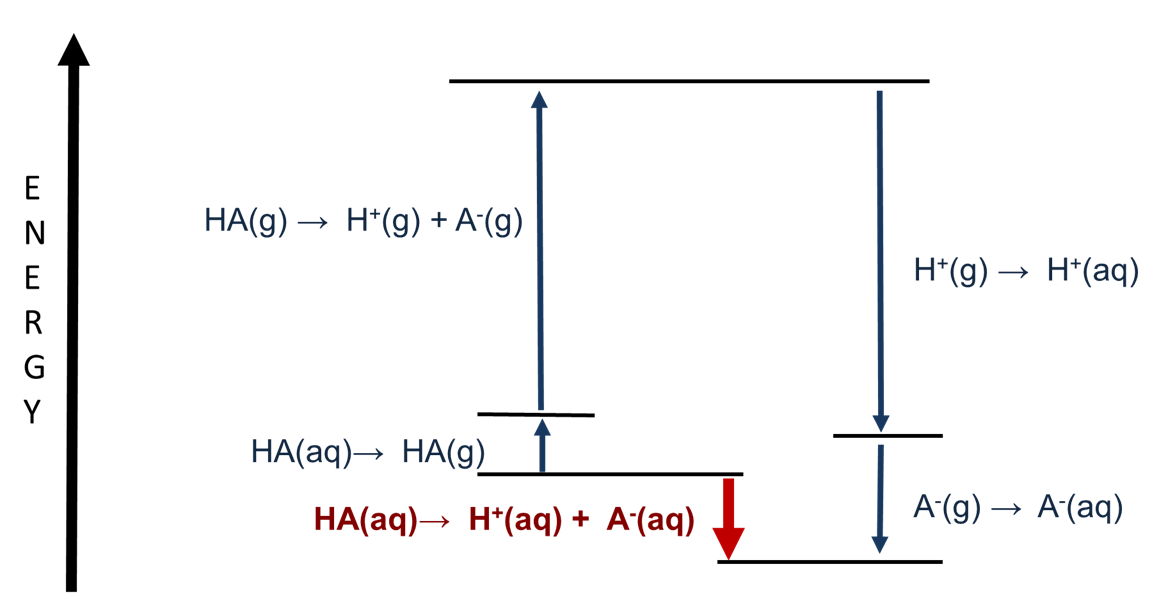
Como puede verse a partir de la Figura\(\PageIndex{1}\), mientras que la mayor parte del proceso implica energías de solvatación, la entalpía de disociación del enlace heterolítico también es un factor importante para determinar la entalpía de disociación ácida. La etapa de energía de disociación de enlaces heterolíticos es una reacción de base ácida de Brønsted en fase gaseosa:
\[\ce{HA(g) → H^{+}(g) + A^{-}(g)} \nonumber \]
En consecuencia, será importante considerar la acidez en fase gaseosa antes de examinar más a fondo la termodinámica de la ionización ácida.
Referencias
- Los datos para ácidos inorgánicos se compilan o calculan a partir de datos compilados en Dasent, W. E. Inorganic Energetics: An Introduction, 2nd ed. Cambridge University Press, 1982, pp. 168-170.
- Los datos para el ácido acético se calculan a partir de los datos dados en Meissler, G.L.; Fischer, P.J.; Tarr, D.A. Inorganic Chemistry, 5a ed. Pearson, 2014, pg. 175.

