6.3.7: La acidez de un oxoácido está determinada por el estado de electronegatividad y oxidación del átomo central del oxoácido*
- Page ID
- 81250
Los oxiácidos (también conocidos como oxoácidos) son compuestos de fórmula general\(\ce{H_{n}EO_{m}}\), donde\(\ce{E}\) es un metal no metálico o de transición temprana y los hidrógenos ácidos están unidos directamente al oxígeno (no\(\ce{E}\)). Esta clase de compuestos incluye ácidos tan conocidos como el ácido nítrico (\(\ce{HNO_2}\)) y el ácido fosfórico, (\(\ce{H_3PO_4}\)).

La acidez de los oxiácidos sigue tres tendencias:
Tendencia 1: En una serie homóloga la acidez aumenta con la electronegatividad del átomo central
Los elementos del mismo grupo frecuentemente forman oxiácidos de la misma fórmula general. Por ejemplo, el cloro, el bromo y el yodo forman oxiácidos de fórmula\(\ce{HOE}\): ácidos hipoclorosos, hipobromosos e hipoyodosos. En el caso de estos oxiácidos homólogos, la acidez está determinada en gran medida por la electronegatividad del elemento central. Los átomos centrales que son más capaces de atraer inductivamente la densidad electrónica hacia sí mismos hacen que el enlace oxígeno-hidrógeno que se va a ionizar sea más polar y estabilizar la base conjugada,\(OE^-\). Así, la fuerza ácida en tales series homólogas aumenta con la electronegatividad del átomo central. Esto puede verse a partir de los datos para los ácidos hipohalosos en la Tabla\(\PageIndex{1}\), en la que la fuerza ácida aumenta con la electronegatividad del halógeno de manera que el orden de acidez es:
\[\ce{HClO>HBrO>HIO} \nonumber \]
| HOX | Electronegatividad de X | K a |
|---|---|---|
| HOCl | 3.0 | 4.0 × 10 −8 |
| HOBr | 2.8 | 2.8 × 10 −9 |
| HOI | 2.5 | 3.2 × 10 −11 |
Obsérvese que la influencia de la electronegatividad del átomo central sobre la fuerza de los oxiácidos es exactamente la opuesta a la observada para los hidruros binarios en la Tabla\(\PageIndex{5}\), para lo cual la acidez se incrementó en un grupo, dando el orden de acidez:
\[\ce{HI>HBr>HCl \gg HF} \nonumber \]
La razón de esto es que en los haluros de hidrógeno, el enlace a romper (enlace H-E) disminuyó en fuerza hacia abajo del grupo, mientras que en los oxiácidos el enlace a romper es siempre un enlace O-H y así varía mucho menos en fuerza con la electronegatividad del átomo central.
Tendencia 2: Para los oxoácidos de un átomo central dado la acidez aumenta con el estado de oxidación del elemento central o, en otras palabras, el número de oxígenos unidos al átomo central.
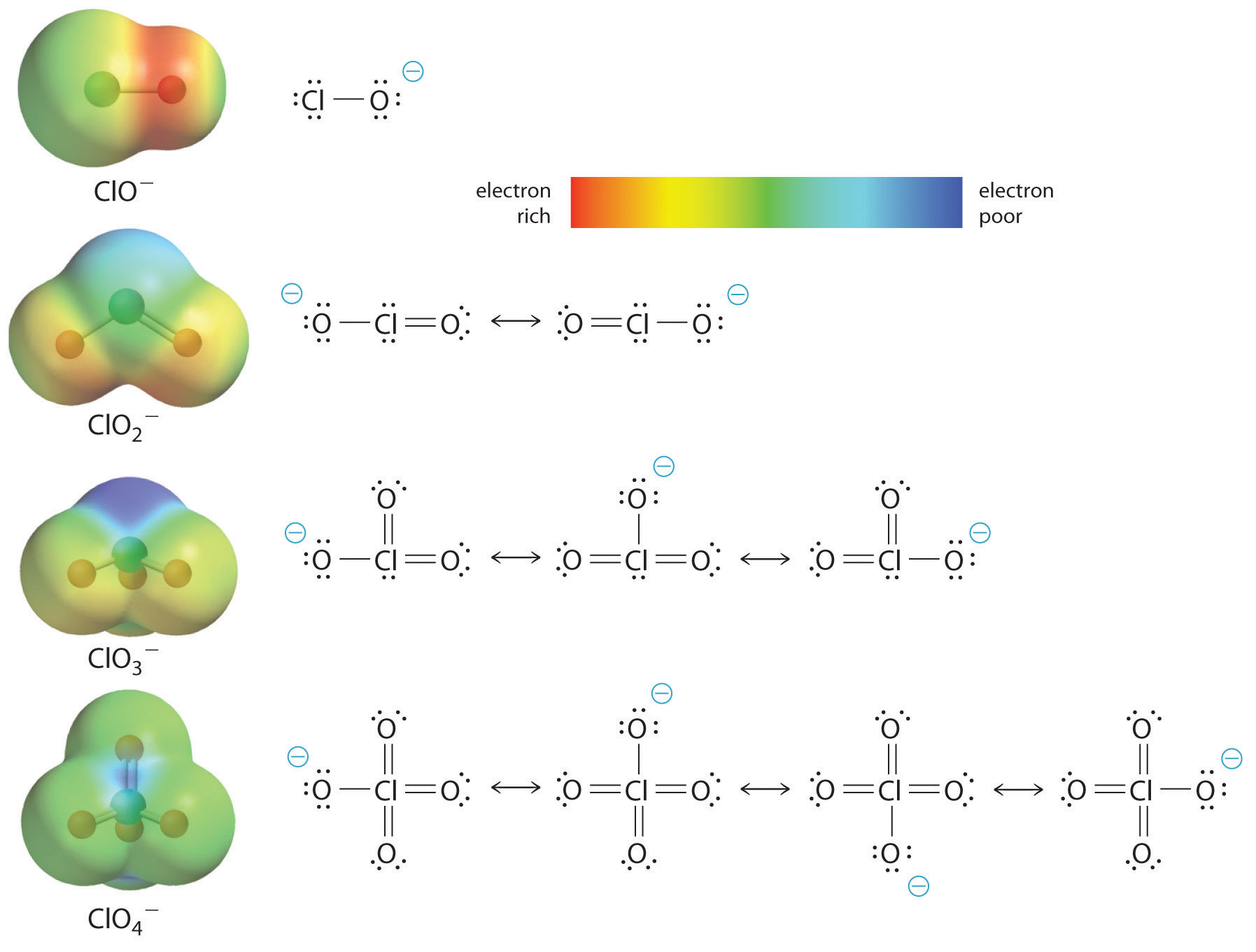
Aquí estamos viendo la tendencia de los ácidos en los que hay números variables de oxígeno unido a un átomo central dado. Un ejemplo es la serie de ácidos perclórico (\(\ce{ClO_3^{-}}\)), clórico (\(\ce{ClO_2^{-}}\)), cloroso () e hipochloso (\(\ce{ClO^{-}}\)).\(\ce{ClO_4^{-}}\) En tal serie, cuanto mayor es el número de oxígenos, más fuerte es el ácido. Esto se puede explicar de varias maneras. Desde el punto de vista del propio ácido, el factor clave es nuevamente el efecto inductivo, en este caso involucrando la capacidad de los oxígenos unidos al átomo central para atraer la densidad electrónica a través del enlace OH. Esto se observa en el diagrama de densidad de carga para los oxoácidos de cloro mostrados en la Figura\(\PageIndex{1}\), en el que la carga positiva parcial sobre el hidrógeno ácido aumenta con el número de oxígenos presentes.

El aumento de la acidez oxoácida con el número de oxígenos unidos al átomo central también se puede observar considerando la estabilidad del oxianión conjugado. Que la estabilidad de la base conjugada aumenta con el número de oxígenos puede verse a partir de los diagramas de distribución de carga y modelos de unión de Lewis para los oxianiones de cloro mostrados en la figura\(\PageIndex{2}\). A medida que la carga negativa se extiende sobre más átomos de oxígeno, se vuelve cada vez más difusa.
Tanto el azufre como el selenio forman oxoácidos de fórmula\(\ce{H_2EO_3}\), donde E es S o Se. Estos se denominan ácido sulfuroso y selenoso, respectivamente. ¿Cuál oxoácido esperarías que fuera más ácido: ácido selenoso o ácido sulfuroso?
- Contestar
-
El ácido sulfuroso debería ser más ácido. Dado que el azufre es más electronegativo que el selenio, el azufre polarizará los enlaces OH en mayor medida, haciéndolos más ácidos. Esta predicción se ve respaldada por una comparación de los\(pK_a\) valores para los ácidos:
Ácido \(pK_{a1}\) \(pK_{a2}\) ácido sulfuroso,\(H_2SO_3\) \ (pk_ {a1}\) ">1.85 \ (pk_ {a2}\) ">7.2 ácido selenoso,\(H_2SeO_3\) \ (pk_ {a1}\) ">2.62 \ (pk_ {a2}\) ">8.32
Tendencia 3: Para los oxoácidos polipróticos la acidez disminuye a medida que se elimina cada protón sucesivo
Los oxoácidos con múltiples enlaces O-H se denominan polipróticos ya que pueden donar más de un ion hidrógeno. En este caso los iones hidrógeno se eliminan en sucesivas reacciones de ionización. Los ejemplos incluyen ácido fosfórico y carbónico:
\[\ce{H_3PO_4 ⇌ H^{+} + H_2PO_4^{-}} \quad \quad pK_{a1} = 2.2 \nonumber \]
\[\ce{H_2PO_4^{-} ⇌ H^{+} + HPO_4^{2-}} \quad \quad pK_{a2} = 7.2 \nonumber \]
\[\ce{HPO_4 ⇌ H^{+} + PO_4^{3-}} \quad \quad pK_{a3} = 12.4 \nonumber \]
\[\ce{H_2CO_3 ⇌ H^{+} + HCO_3^{-}} \quad \quad pK_{a1} = 3.6 \nonumber \]
\[\ce{HCO_3^{-} ⇌ H^{+} + CO_3^{2-}} \quad \quad pK_{a1} = 10.3 \nonumber \]
Las constantes de disociación para las constantes de ionización sucesivas disminuyen en aproximadamente cinco órdenes de magnitud entre los sucesivos iones de hidrógeno. Esto se refleja en las reglas de Linus Pauling para los oxoácidos y sus oxianiones:
- El\(pK_a\) para un oxiácido de fórmula general\(\ce{E(OH)_{q}(O)_{p}}\) viene dado por\[pK_a = 8 - 5 \times p \label{PaulingRules} \]
- A medida que un oxoaxida sufre ionizaciones sucesivas los\(pK_a\) aumentos en cinco cada vez.
El tema central de las Reglas de Pauling es que cuanto más oxígenos haya en el átomo central, más estructuras de resonancia se pueden construir para la base conjugada, lo que aumenta su estabilidad y aumenta la acidez del ácido. Sin embargo, a medida que los ácidos se ionizan sucesivamente, tienen menos estructuras de resonancia. Las Reglas de Pauling son fenomenológicas (es decir, no basadas en un marco teórico). No obstante, como reglas empíricas, suelen funcionar bastante bien, pero hay que tener en cuenta que son aproximadas.
Calcular los\(pK_a\) valores teóricos para ácido fosfórico y carbónico y su disociación produce y compara los resultados con los\(pK_a\) valores experimentales.
- Contestar
-
Para el ácido fosfórico, las reglas de Pauling (Ecuación\ ref {PaulingRules}) predicen los\(pK_a\) valores bastante bien:
- \(H_3PO_4\):\(p = 3\) y\(q =1\) y\[pK_{a1, predicted} = 8 - 5 \times 1 = 3 \nonumber \] Esto es ligeramente mayor que el valor observado de 2.2.
- \(H_2PO_4^-\):\[pK_{a2, predicted} = pK_{a1, experimental} + 5 = 7.2 \nonumber \] Esto es puntual con el experimento.
- \(HPO_4^{2-}\):\[pK_{a3, predicted} = pK_{a2, experimental} + 5 = 12.2 \nonumber \] Esto es ligeramente menor que el valor experimental de 12.4.
Para el ácido carbónico, las reglas de Pauling predicen\(pK_{a1}\) razonablemente bien, pero\(pK_{a2}\) menos:
- \(H_2CO_3\):\(p = 2\),\(q =1\) y\[pK_{a1, predicted} = 8 - 5 \times 1 = 3 \nonumber \] Esto es ligeramente inferior al valor observado de 3.6.
- \(HCO_3^-\):\[pK_{a2, predicted} = pK_{a1, experimental} + 5 = 8.6 \nonumber \] Esto es 1.7 unidades menos que el valor experimental de 10.3.
En algunos casos, las discrepancias entre\(pK_a\) los valores experimentales y los predichos por las reglas de Pauling sugieren que los reordenamientos estructurales pueden estar ocurriendo tras la ionización o bien que\(pK_a\) los valores reportados no representan realmente la ionización en cuestión porque no dan cuenta completamente para todos los equilibrios que tienen lugar en solución. En el caso del ácido carbónico, sin embargo, la razón de la discrepancia entre los\(pK_{a2}\) valores pronosticados y experimentales no es del todo clara.


