6.3.8: Los iones metálicos de alta relación carga-tamaño actúan como ácidos Brønsted en el agua
- Page ID
- 81272
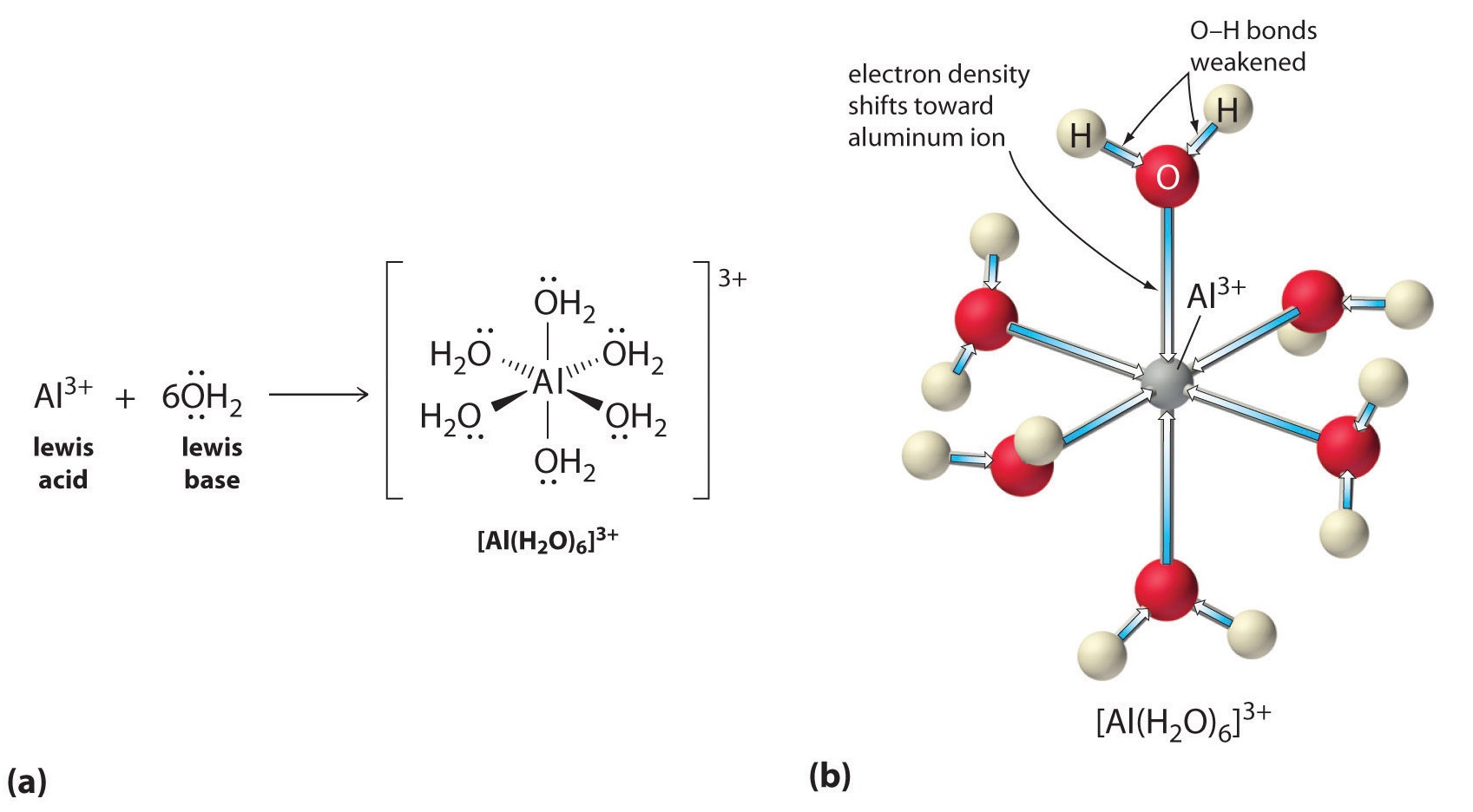
Los iones metálicos actúan como ácidos al polarizar moléculas de agua unidas llamadas ligandos de aguamarina
Las soluciones acuosas de sales simples de iones metálicos también pueden ser ácidas, aunque un ion metálico no puede donar un protón directamente al agua para producir\(H_3O^+\). En cambio, un ion metálico puede actuar como un ácido de Lewis e interactuar con el agua, una base de Lewis, coordinándose con un par solitario de electrones en el átomo de oxígeno para formar un ion metálico hidratado.

Una molécula de agua coordinada a un ion metálico es más ácida que una molécula de agua libre por dos razones. Primero, las interacciones electrostáticas repulsivas entre el ion metálico cargado positivamente y los átomos de hidrógeno parcialmente cargados positivamente de la molécula de agua coordinada facilitan que el agua coordinada pierda un protón.
Segundo, la carga positiva sobre el\(Al^{3+}\) ion atrae la densidad electrónica de los átomos de oxígeno de las moléculas de agua, lo que disminuye la densidad electrónica en los\(\ce{O–H}\) enlaces, como se muestra en la Figura\(\PageIndex{5b}\). Con menor densidad de electrones entre los\(O\) átomos y los átomos de H, los\(\ce{O–H}\) enlaces son más débiles que en una\(H_2O\) molécula libre, lo que facilita la pérdida de un\(H^+\) ion. Esto se muestra esquemáticamente en la Figura\(\PageIndex{1}\).
La acidez de un ion metálico dado depende en gran medida de su relación carga/tamaño y electronegatividad, aunque en algunos casos la dureza y los efectos de campo del ligando también juegan un papel importante.
La magnitud de este efecto depende de los siguientes factores, de los cuales los dos primeros se consideran generalmente los más importantes (Figura\(\PageIndex{2}\)):
La carga en el ion metálico
Un ion divalente (\(\ce{M^{2+}}\)) tiene aproximadamente el doble de fuerte efecto sobre la densidad electrónica en una molécula de agua coordinada que un ion monovalente (\(\ce{M^{+}}\)) del mismo radio.
El radio del ion metálico
Para los iones metálicos con la misma carga, cuanto menor es el ion, más corta es la distancia internuclear al átomo de oxígeno de la molécula de agua y mayor es el efecto del metal sobre la distribución de la densidad de electrones en la molécula de agua.
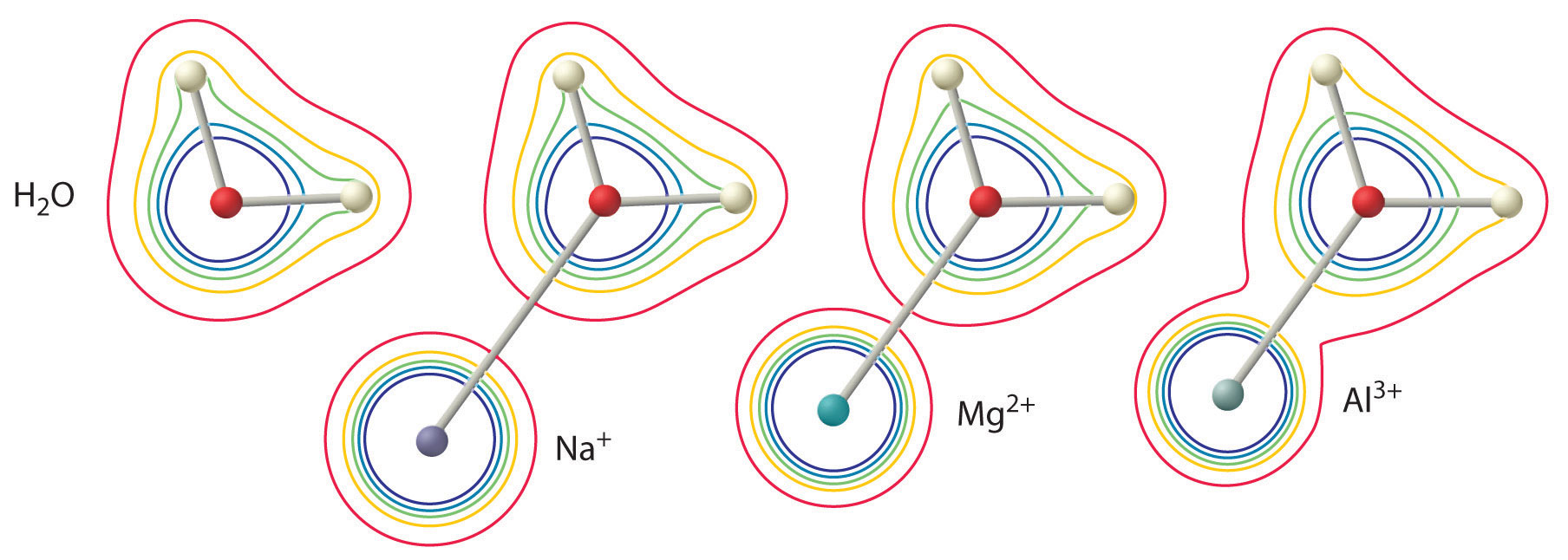
Los dos primeros de estos factores explican por qué la mayoría de los cationes de metales alcalinos exhiben poca acidez mientras que las soluciones acuosas de iones metálicos pequeños y altamente cargados, como\(Al^{3+}\) y\(Fe^{3+}\), son ácidas:
\[\ce{[Al(H2O)6]^{3+}(aq) <=> [Al(H2O)5(OH)]^{2+}(aq) + H^{+}(aq)} \label{16.36} \]
El\(\ce{[Al(H2O)6]^{3+}}\) ion tiene un\(pK_a\) de 5.0, lo que lo convierte en un ácido casi tan fuerte como el ácido acético. Debido a los dos factores descritos anteriormente, los parámetros más importantes para predecir el efecto de un ion metálico sobre la acidez de las moléculas de agua coordinadas son la carga y el radio iónico del ión metálico.
Una ecuación empírica simple para predecir el pK a de iones metálicos en agua ha sido propuesta por Wulfsberg: 1
\[pK_a = 15.14 - 88.16~pm \left( \frac{Z^2}{r} \right) \nonumber \]
donde\(Z\) esta la carga sobre el ion metálico y\(r\) su radio. Como se puede observar a partir de la figura\(\PageIndex{3}\), en general la acidez de los iones metálicos aumenta con\( \frac{Z^2}{r}) \). Sin embargo, varios iones tienen\(pK_a\) valores considerablemente más bajos que los predichos a partir de esta correlación, lo que sugiere que la acidez de los cationes metálicos no puede predecirse usando un modelo electrostático simple solo.
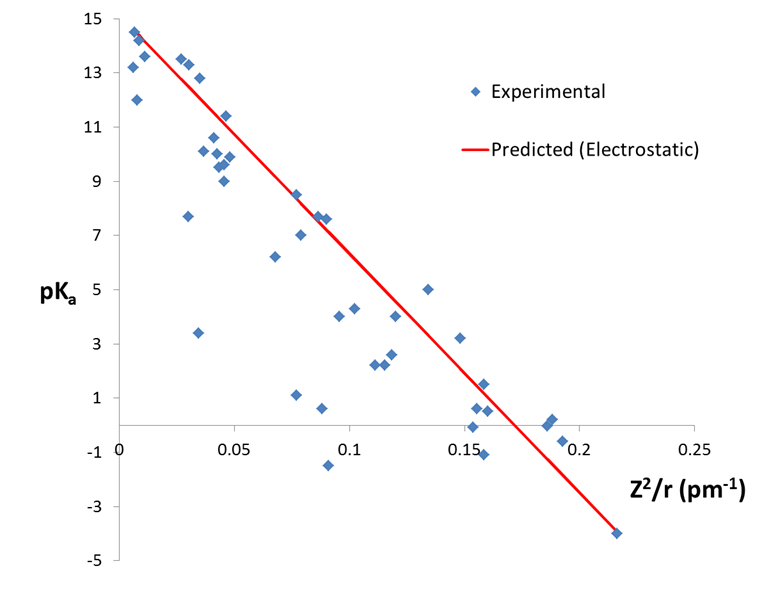
Aunque la relación carga/tamaño es el predictor más simple y potente de la acidez de iones metálicos en el agua, también pueden desempeñar un papel tres factores adicionales:
Electronegatividad
Al igual que todas las demás cosas, los elementos más electronegativos son más capaces de retirar la densidad electrónica de un ligando de agua unido y, en consecuencia, mejorar la capacidad de esa molécula de agua para perder un ion de hidrógeno. El modelo electrostático de acidez iónica se puede extender para dar cuenta de los efectos de electronegatividad pero solo se necesita hacerlo para metales con electronegatividades Pauling mayores a 1.5. La relación empírica que se ha propuesto para dar cuenta del efecto de la electronegatividad es:
\[pK_a = 15.14 - 88.16 \left( \frac{Z^2}{r} + 0.096( \chi - 1.50) \right) \nonumber \]
donde\(r\) está el radio iónico en pm y\( \chi \) es su electronegatividad Pauling. Como se puede ver en la figura\(\PageIndex{4}\), el término de electronegatividad explica algunas de las desviaciones en la acidez de iones metálicos predichas a partir de los efectos de carga y tamaño solamente.
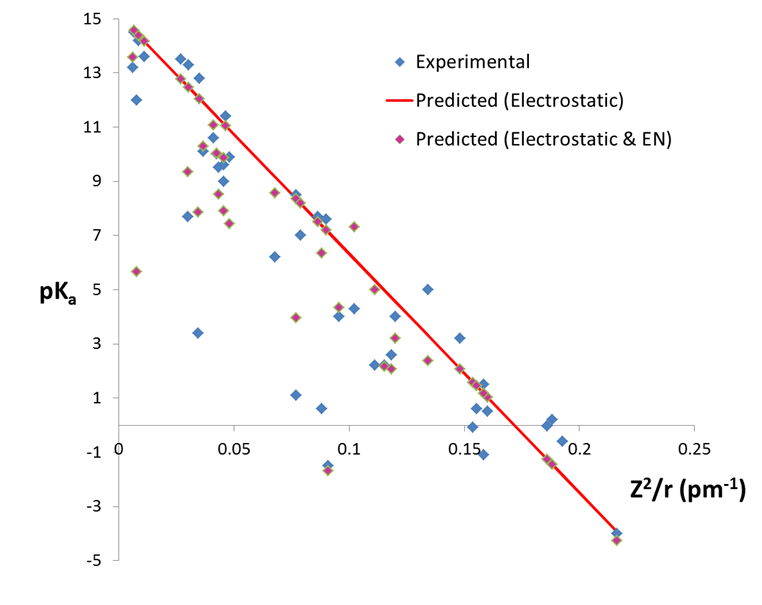
Sin embargo, todavía hay grandes desviaciones entre el pK a pronosticado y observado para varios iones. En particular, el modelo electrostático modificado sobreestima el pK a de Al 3 + y Sn 4 + y subestima el pK a de Hg 2 +, Sn 2 + y Tl 3 +. Si bien las razones exactas de estas discrepancias no están del todo claras, al menos se piensa que algunas surgen del impacto del cuarto factor que determina la acidez del ion metálico.
Dureza y Suavidad
La dureza o suavidad de los cationes se evalúa de acuerdo con el principio de base ácida dura y blanda de Pearson (HSABP). En general, los cationes blandos son más ácidos que los cationes duros de la misma carga y radio, como puede verse a partir de los ejemplos en la Tabla\(\PageIndex{1}\). Se cree que la acidez mayor de lo esperado de los cationes más blandos refleja la importancia de las contribuciones covalentes al enlace metal-agua.
| Catión | Clasificación | Radio (pm) | \(pK_a1\) |
|---|---|---|---|
| \(K^+\) | duro | 1.33 | \ (PK_a1\) ">14 |
| \(Ag^+\) | suave | 1.26 | \ (PK_a1\) ">10 |
| \(Mg^{2+}\) | duro | 0.65 | \ (PK_a1\) ">12.2 |
| \(Cu^{2+}\) | suave | 0.69 | \ (PK_a1\) ">7.3 |
| \(Ca^{2+}\) | duro | 0.99 | \ (PK_a1\) ">12.6 |
| \(Cd^{2+}\) | suave | 0.97 | \ (PK_a1\) ">9.0 |
| \(Sr^{2+}\) | duro | 1.13 | \ (PK_a1\) ">13.1 |
| \(Hg^{2+}\) | suave | 1.10 | \ (PK_a1\) ">3.6 |
Efectos de campo de ligando
Los efectos del campo del ligando implican interacciones de unión y antiunión entre los orbitales d en un metal de transición y orbitales de ligando. La importancia de las interacciones de campo de ligando en la acidez catiónica no está bien establecida, pero las interacciones de campo de ligando pueden influir en la acidez de un metal hidratado en dos casos: (a) cuando la estabilización del campo de ligando del complejo aqua (metal con\(\ce{H_2O}\) o\(\ce{OH^{-}}\) unido) es mayor o menor que esa en su base conjugada y (b) en complejos que sufren distorsiones Jahn-Teller que alteran la capacidad del metal para polarizar el enlace OH.
Referencias
- Wulfsberg, G. Principios de Química Inorgánica Descriptiva Libros de Ciencias Universitarias, 1991, pp. 28-30.
- a) Gutmann, V. Allg. Prakt. Chem. 1970, 21, 116. b) Gutmann, V. Fortschr. Chem. Forsch. 1972, 27, 59.
- Burgess, J. Iones metálicos en solución Ellis Horwood, 1978, pág. 268.

