6.3.11: Superbases no nucleofílicas de Brønsted-Lowry
- Page ID
- 81265
Las superbases orgánicas no nucleofílicas actúan como bases fuertes en solventes orgánicos pero no son reactivas hacia otros electrófilos
Una variedad de bases orgánicas e inorgánicas fuertes están disponibles para su uso en la síntesis orgánica (reactivos de alquillitio, derivados de diisopropil amida, hidruros e hidróxidos). Algunos de estos presentan poca tolerancia a los grupos funcionales debido a su capacidad para reaccionar con grupos funcionales electrófilos. De ahí que exista un interés considerable en el desarrollo de bases que puedan eliminar iones de hidrógeno de sustratos orgánicos muy débilmente ácidos (es decir, como enlaces C-H) sin reaccionar con grupos funcionales electrófilos. Las bases clásicas no nucleofílicas utilizadas ampliamente en la química orgánica incluyen diisopropiletilamina (DIEA), diisopropilamida de litio (LDA), y los hidruros iónicos simples y complejos como\(\ce{CaH2^{+2}}\) y\(\ce{LiAlH4}\). Estos últimos, sin embargo, son no nucleofílicos en virtud de su insolubilidad en disolventes orgánicos, por lo que actúan en gran medida como bases cuando un sustrato orgánico interactúa con el hidruro en una superficie cristalina.
Muchas bases fuertes se llaman superbases en el uso diario. Sin embargo, se han desarrollado definiciones más rigurosas para distinguir claramente las superbases de las simples bases fuertes. La mayoría de estos utilizan algún aspecto de la termodinámica de los enlaces de iones de hidrógeno por 1,8-Bis (dimetilamino) naftaleno como delimitador entre bases fuertes ordinarias y superbases. Es decir, por estos criterios cualquier base más fuerte que 1,8-bis (dimetilamino) naftaleno se considera una superbase. Por esta medida, las superbases orgánicas pueden definirse como aquellas que tienen afinidades protónicas mayores que 1048 kJ/mol, 1 aunque la mayoría de los trabajadores utilizan superbases definidas como aquellas que tienen un valor\(pK_a\) mayor de 1,8-bis (dimetilamino) naftaleno de 12. 2
Las superbases orgánicas no nucleofílicas utilizan deslocalización de carga, quelación de protones o ambas para unir firmemente iones de hidrógeno
Una variedad de compuestos con una alta afinidad por los iones de hidrógeno en solventes orgánicos se han desarrollado específicamente como superbases orgánicas fuertes no nucleofílicas. 3 Las clases comunes incluyen:
Esponjas de protones tipo naftaleno
Las esponjas de protones tipo naftaleno son dos grupos básicos que se mantienen muy cerca entre sí en las posiciones 1 y 8 de un anillo de naftaleno. El compuesto 1,8-Bis (dimetilamino) naftaleno es quizás la superbase más conocida de este tipo e incluso se vende con el nombre comercial de Proton Sponge™. Su estructura se muestra a continuación.
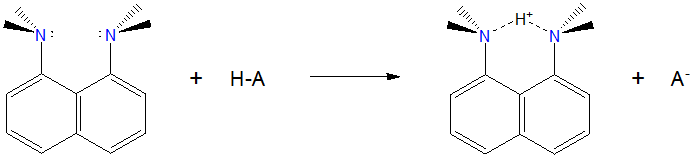
La esponja de protones tiene las propiedades típicas de una superbase orgánica. A diferencia de las diisopropilaminas de litio y los reactivos de hidruro metálico, el 1,8-bis (dimetilamino) naftaleno es solo débilmente básico en el agua. Sin embargo, posee una afinidad muy fuerte por los iones hidrógeno en disolventes orgánicos.
En este caso la alta basicidad de 1,8-Bis (dimetilamino) naftaleno se debe a una combinación de factores estéricos y electrónicos. Primero, es un quelante de hidrógeno en el sentido de que el hidrógeno se mantiene en un fuerte enlace de hidrógeno N-H—N simétrico en su base conjugada. En segundo lugar, la formación de ese enlace de hidrógeno alivia parte de la cepa estérica asociada con grupos dimetil amino mantenidos cerca uno del otro en las posiciones 1 y 8 en el anillo de naftaleno.
Aminidinas y Guanidenes
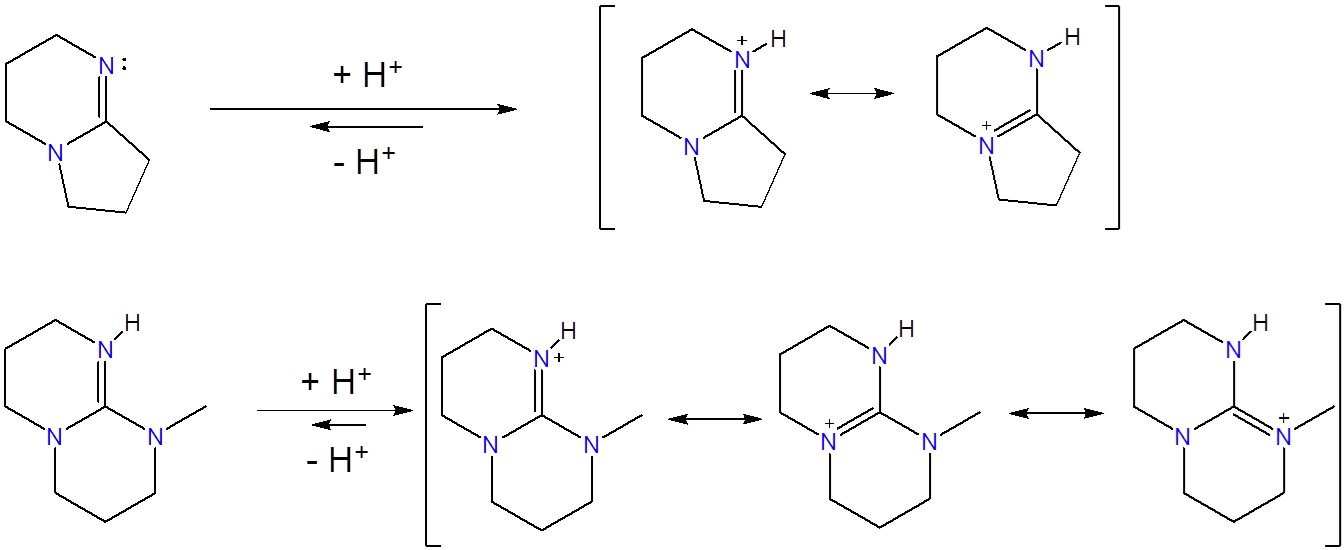
Las aminidinas son derivados nitrogenados de derivados de ácidos carboxílicos. Las aminidinas acíclicas tienen\(pK_a\) valores ~12, similares a los de 1,8-Bis (dimetilamino) naftaleno, aunque las aminidinas cíclicas son varios órdenes de magnitud mayores. Por ejemplo, se estima que DBU exhibe un\(pK_a\) valor de 24.3 en MeCN. 4 Ejemplos de superbases de aminidina incluyen los catalizadores orgánicos 1,8-Diazabiciclo (5.4.0) undec-7-eno (DBU) y 1,5-diazabiciclo (4.3.0) non-5-eno (DBN), y superbases de vinamidinio, que unen iones hidrógeno en el nitrógeno de la imina.
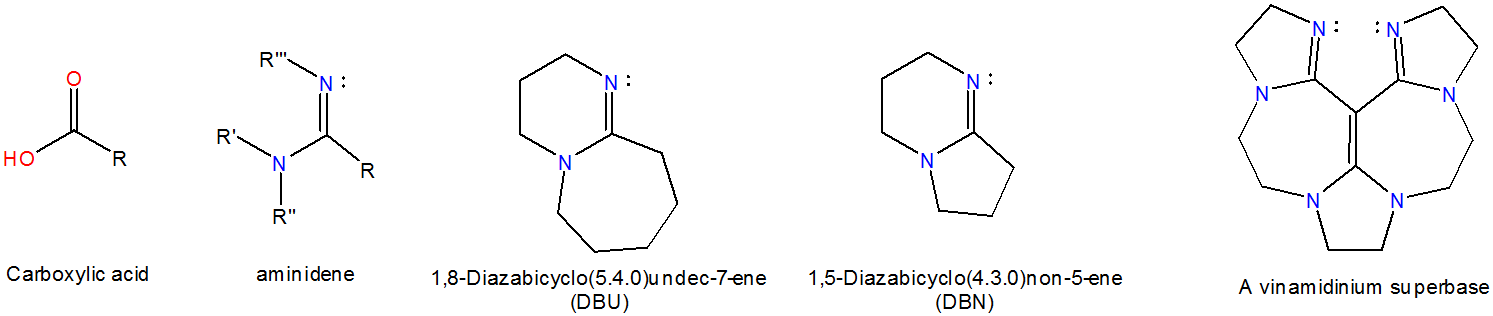
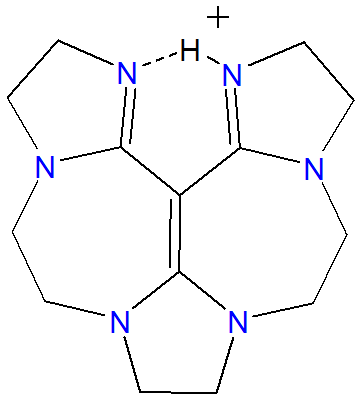
De estas, las superbases de vinamidinio son quelantes de iones hidrógeno.
Las guanidenas son análogos de nitrógeno del carbonato y se unen al ion hidrógeno en un par solitario de nitrógeno tal como lo hacen las aminidinas, aunque las guanidinas monoméricas son ligeramente más básicas (\(pK_a ~13\)) que las aminidinas análogas (\(pK_a ~12\)). Las clases comunes de superbases de guanideno incluyen pentalquilo y guanidinas bicíclicos, que se muestran a continuación.
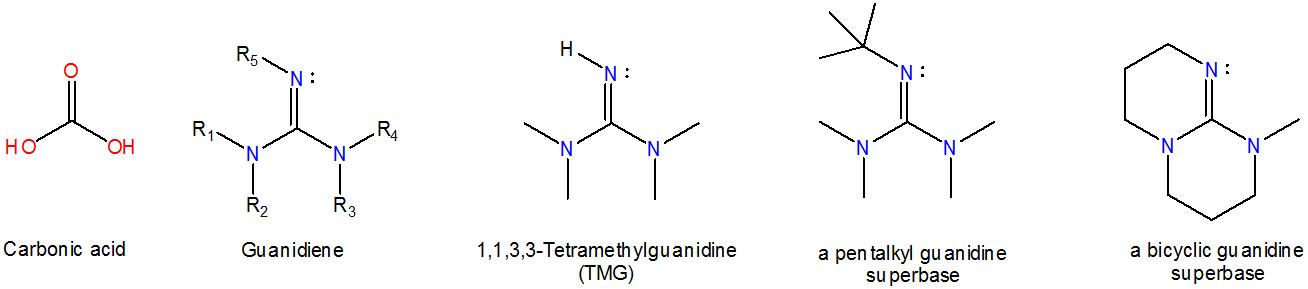
La alta basicidad de aminidinas y guanidinas se deriva de la capacidad de estos sistemas para deslocalizar la carga en la forma protonada.
Utilizar la estructura de las aminidinas y guanidinas protonadas para explicar por qué las guanidinas son bases más fuertes que sus análogos de aminidina.
- Contestar
-
Hay mayor deslocalización de carga en iones guanidinio. De acuerdo con el cuadro de resonancia de unión, en los iones guanidinio la carga positiva se deslocaliza sobre tres átomos de nitrógeno mientras que en los iones amidinio solo se deslocaliza sobre dos.
Superbases de tipo fosfatano
Estos exhiben basicidad mejorada en el átomo de fósforo de un tipo especial de azafosfina llamado proazafosfatrano:
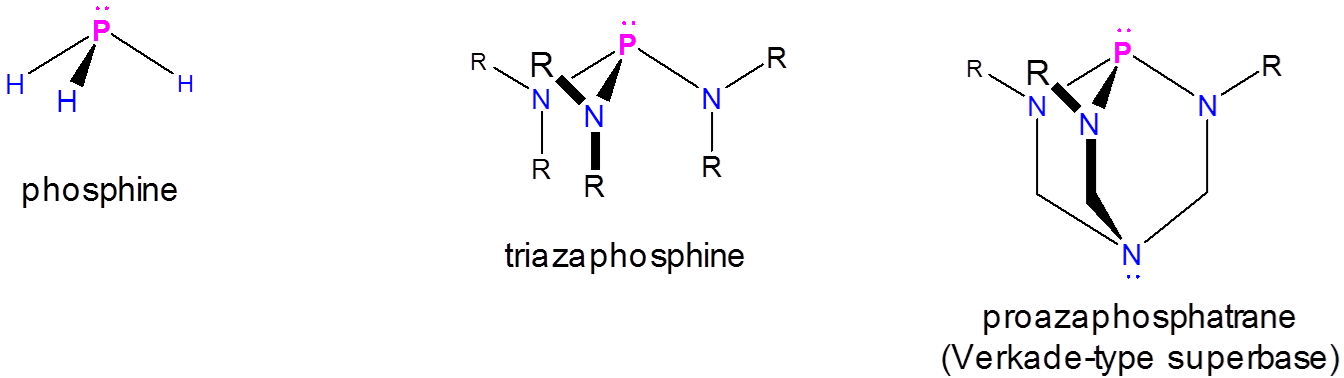
De estas, la más conocida es la superbase de Verkade, la cual se estima que tiene una\(pK_a\) de 29 en acetonitrilo, 5 lo que significa que es considerablemente más básica que las superbases tipo aminidina y guanidina. La clave de la notable basicidad de la superbase de Verkade es la capacidad de la amina del proazafosfoatrano para estabilizar la azafosfina protonada a través de la formación de un enlace P-N, dando un fósforo bipiramidal pseudo trigonal.
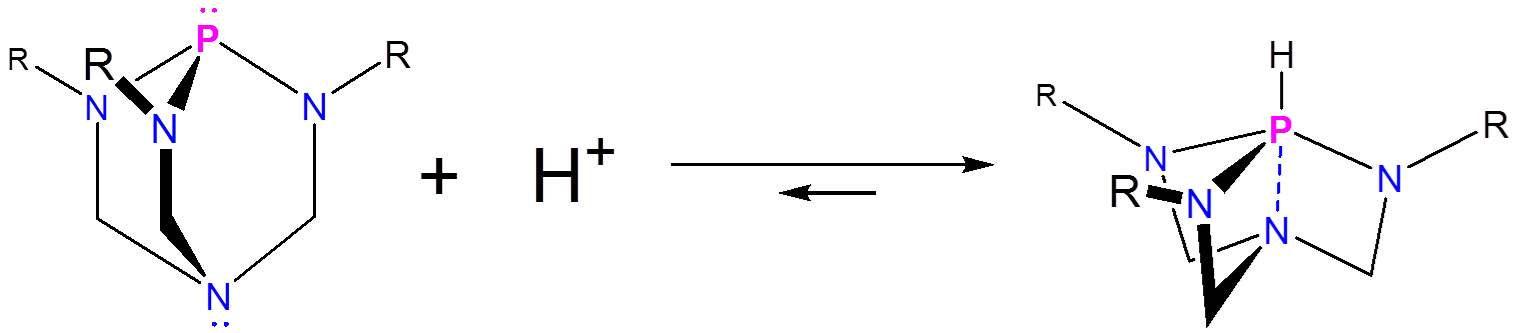
Estas interacciones son tan estabilizantes que el nitrógeno de la amina transanular no presenta basicidad, incluso cuando se agregan superácidos como Magic Acid. 6
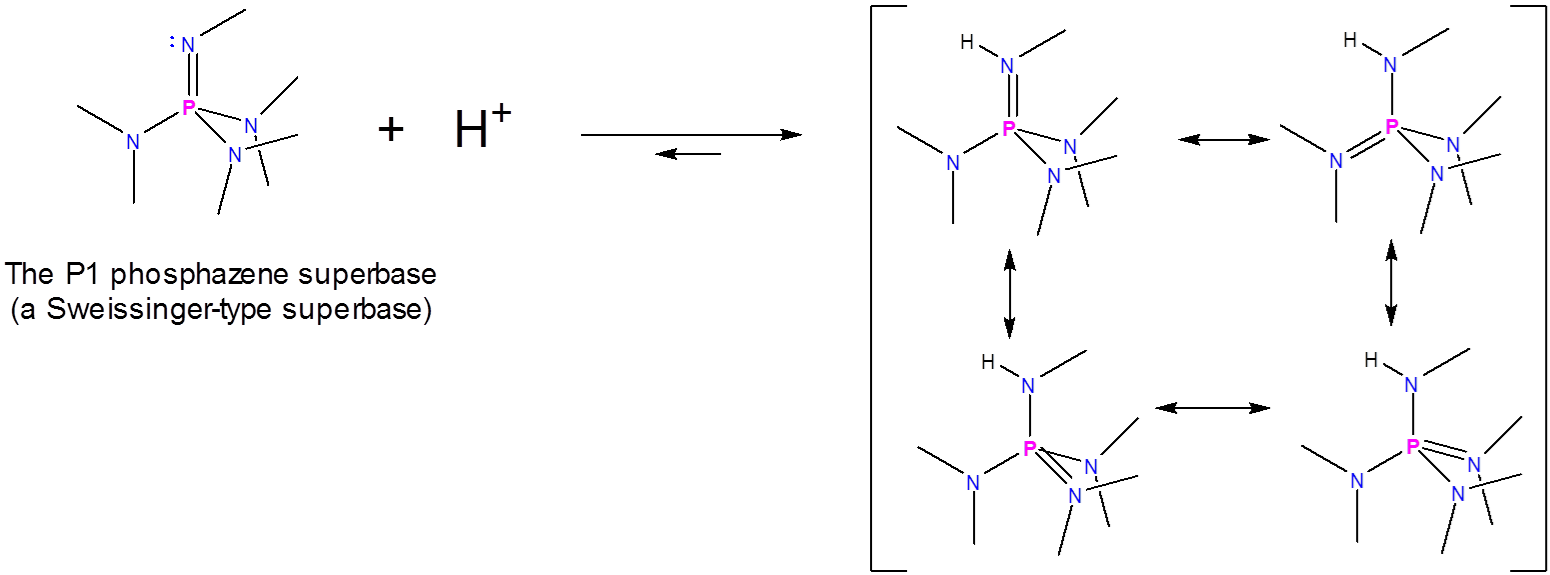
Superbases de fosfaceno
Las superbases de fosfaceno, también conocidas como superbases de Schwesinger, funcionan de manera similar a las aminidinas y guanidinas, ya que se unen a un ion hidrógeno en un nitrógeno de imina para dar un catión estabilizado por resonancia. Es justo que en este caso la imina es la de un fosfaceno y la mayor estabilización de resonancia del catión resultante significa que presentan mayor basicidad. Se ha reportado que una superbase de fosfaceno tiene un\(pK_a\) de 42 en acetonitrilo.
Referencias
- Gal, J.‐F.; Maria; P.‐C.; Raczynska, E. D. Aspectos termoquímicos de la transferencia de protones en fase gaseosa. Revista de Espectrometría de Masas, 2001; 36:699—716
- El\(pK_a\) de 1,8-Bis (dimetilamino) naftaleno se toma de Benoit, R. L.; Lefebvre, D.; Fréchette, M., Basicidad de 1,8-bis (dimetilamino) naftaleno y 1,4-diazabiciclo [2.2.2] octano en agua y dimetilsulfóxido. Revista Canadiense de Química 1987, 65 (5), 996-1001.
- Ishikawa, T. Superbases para Síntesis Orgánica: Guanidinas, Amidinas, Fosfacenos y Organocatalizadores Relacionados; Wiley: Nueva York, 2009.
- A menos que se indique otra cosa\(pK_a\) valores distintos a los reportados para 1,8-Bis (dimetilamino) naftaleno se toman de Kaupmees, K.; Trummal, A.; Leito, I. (2014). “Basicidades de bases fuertes en el agua: un estudio computacional”. Croata. Chem. Acta. 87: 385—395. doi: 10.5562/cca2472
- Kovačević, B.; Barić, D.; Maksić, Z. B., Basicidad de bases orgánicas no iónicas extremadamente fuertes en acetonitrilo —superbase de Verkade y algunos fosfacenos relacionados. Nueva Revista de Química 2004, 28 (2), 284-288.
- Akiba, K-Y. Química orgánica del grupo principal; Wiley: Nueva York, 2011.

