6.4.6: La resistencia de la base de Lewis también puede estimarse midiendo los cambios estructurales o energéticos tras la formación de un complejo ácido-base de Lewis, como se ilustra por los esfuerzos para evaluar espectroscópicamente las resistencias de los enlaces halógenos
- Page ID
- 81281
Cuando un ácido y una base de Lewis forman un aducto, desplaza las longitudes de los enlaces, y las fuerzas en el ácido y la base también cambian.
Según la descripción orbital fronteriza de las interacciones ácido-base de Lewis, la formación de aductos da como resultado una transferencia neta de densidad electrónica desde la base HOMO al LUMO ácido. Esta transferencia
- aumenta la densidad electrónica entre el ácido (A) y la base (D)
- altera la fuerza de la unión dentro de la base a medida que la base LUMO se vuelve parcialmente poblada.
Estos cambios dan como resultado cambios estructurales y espectroscópicos en la formación de aductos que pueden tomarse como una medida de la fuerza de la interacción ácido-base de Lewis. Dado que estos cambios dependen de la naturaleza del enlace en el ácido y la base, en la práctica, las mediciones estructurales y espectroscópicas de la basicidad de Lewis se aplican a algunas clases de interacciones ácido-base de Lewis, más notablemente enlaces de hidrógeno y enlaces de halógeno. Dado que los enlaces de hidrógeno serán discutidos en la sección 6.5.1. el resto de esta subsección se centrará en los enlaces halógenos.
Los enlaces halógenos son enlaces covalentes coordinados formados entre una base de Lewis y un organohalógeno.
Los halógenos en los compuestos que contienen un halógeno de enlace único pueden participar en un tipo especial de interacción intermolecular llamado enlace halógeno, ya que los halógenos unidos son electrófilos en el lado opuesto del enlace. Esta electrofilicidad es evidente a partir de la distribución de carga que\(CF_5I\) se muestra en la Figura 4.5.1, en la que la carga se distribuye sobre el I de tal manera que el I es Lewis básico perpendicular al enlace C-I y Lewis ácido opuesto a éste. Esta región de densidad electrónica disminuida en el halógeno opuesto al enlace sigma existente se llama un\(\sigma\) agujero. *

Esquemáticamente,

Dado que el halógeno puede actuar como un ácido de Lewis en la dirección opuesta al enlace R-X, puede formar aductos con bases de Lewis en esa dirección.
 \[ \nonumber \]
\[ \nonumber \]
Los enlaces que mantienen juntos estos aductos se denominan enlaces halógenos, a menudo abreviados XB.
Se dice que el halógeno actúa como donador de enlaces halógenos cuando forma un enlace halógeno con una base a lo largo de esa dirección, actuando la base como aceptor de enlaces halógenos. En consecuencia, los dos esquemas anteriores también se pueden dar como:

La capacidad de los átomos de halógeno unidos por un solo enlace para formar enlaces de halógeno forma la base de muchos esfuerzos para diseñar estructuras en las que los compuestos que contienen halógeno se mantienen unidos en cadenas, láminas o estructuras 3D usando enlaces halógenos. Un ejemplo fácil de ver involucra cadenas 1D formadas entre p-diyodotetrafluorobenceno y p-bis (dimetilamino) benceno. 3
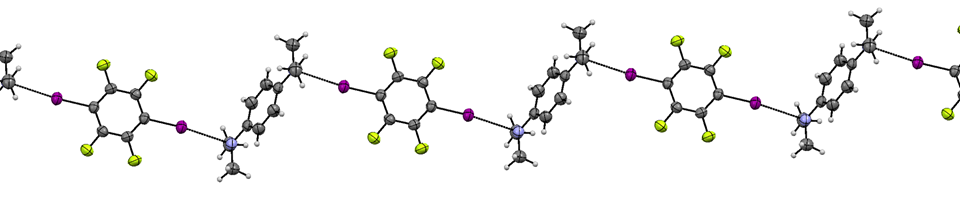
Las tendencias en la fuerza de unión halógena en una serie estrechamente relacionada de compuestos pueden evaluarse examinando cómo la frecuencia de estiramiento vibracional de I 2 e I 2 \(\pi^*\)a la energía de\( \sigma^*\) transición cambia al formar el aducto.
A partir de la descripción de los enlaces halógenos anterior debe ser evidente que los complejos de transferencia de carga de yodo descritos en la sección 6.4.2 se mantienen unidos por enlaces halógenos. Esto significa que la descripción de la unión en los complejos de transferencia de\(I_2\) carga dada en esa sección ilustra cómo cambian las transiciones vibracionales y electrónicas cuando se forma un aducto unido a halógeno entre un donante de enlace halógeno y un aceptor.
Las interacciones orbitales involucradas en la formación de enlaces halógenos se muestran en la Figura 6.4.5.3. Como se puede ver a partir de esa figura, se espera que la formación de un aducto entre\(I_2\) y una base de Lewis resulte en el debilitamiento del enlace I-I y un cambio en la energía de\( I_2~ \pi^*~\rightarrow~\sigma^*\) transición a mayor energía/longitudes de onda más cortas (es decir, un desplazamiento azul). Además, se espera que tanto el debilitamiento del enlace I-I como el\(I_2~ \pi^*~\rightarrow~\sigma^*\) desplazamiento azul aumenten con la energía HOMO de la base Lewis.
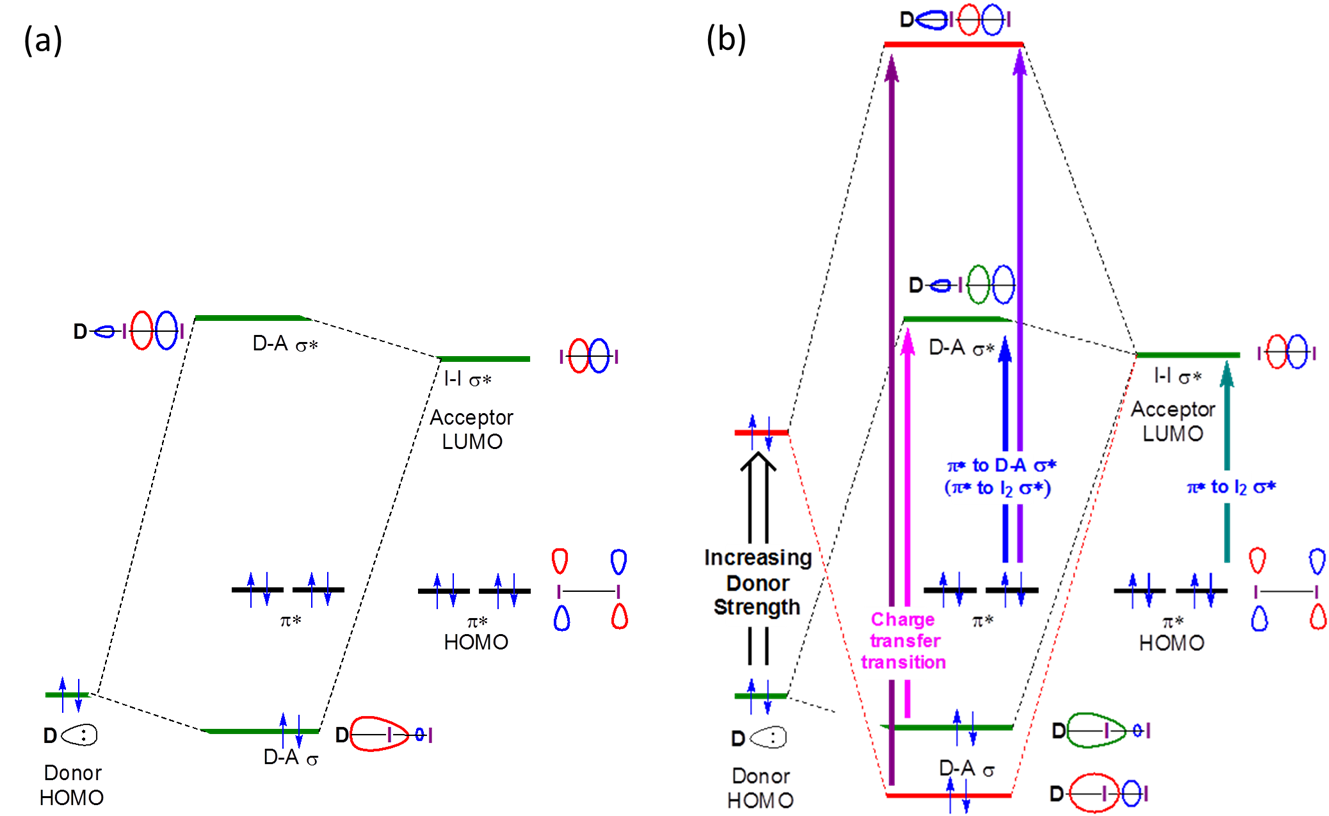
Debido a que la fuerza de enlace I-I y el\(I_2~ \pi^*~\rightarrow~\sigma^*\) desplazamiento azul aumentan con la basicidad de Lewis del donante, el desplazamiento azul y la frecuencia de estiramiento vibracional I-I a veces se utilizan como medidas de la afinidad del enlace halógeno del donante. Sin embargo, los datos obtenidos de tales mediciones espectroscópicas deben interpretarse con cierto grado de precaución. Como se ve en el Cuadro 6.4.5.1, la medida en que se debilita el enlace I-I (indicado por\(\Delta \nu_{I-I}\)) y la\(I_2's~ \pi^*~\rightarrow~\sigma^*\) banda está desplazada en azul están imperfectamente correlacionadas en general. Sin embargo, una cuidadosa comparación de los datos en 6.4.5.1. revela que el debilitamiento del enlace I-I y el desplazamiento\(I_2's~ \pi^*~\rightarrow~\sigma^*\) azul se correlacionan bien para bases de Lewis de un tipo dado. En consecuencia, los cambios en la frecuencia de estiramiento I-I y la banda de\(I_2~ \pi^*~\rightarrow~\sigma^*\) absorción no son útiles como una medida absoluta de la basicidad de Lewis, sino que pueden usarse para clasificar la afinidad del enlace halógeno de un conjunto estrechamente relacionado de donantes. **
| Base (tipo) | \(\Delta \nu_{I-I}~cm^{-1}\) | Cambio azul de\(I_2's~ \pi *~\rightarrow ~\sigma*\) |
|---|---|---|
| 4-metilpiridina (piridinas) | \ (\ Delta\ nu_ {I-I} ~cm^ {-1}\) ">29.1 | \ (i_2's~\ pi *~\ fila derecha ~\ sigma*\) ">4730 |
| piridina (piridinas) | \ (\ Delta\ nu_ {I-I} ~cm^ {-1}\) ">27.4 | \ (i_2's~\ pi *~\ fila derecha ~\ sigma*\) ">4560 |
| tetrahidrotiofeno (tioéteres) | \ (\ Delta\ nu_ {I-I} ~cm^ {-1}\) ">44.5 | \ (i_2's~\ pi *~\ fila derecha ~\ sigma*\) ">3640 |
| tetrahidrofurano, THF (éteres) | \ (\ Delta\ nu_ {I-I} ~cm^ {-1}\) ">6.4 | \ (i_2's~\ pi *~\ fila derecha ~\ sigma*\) ">2280 |
| éter dietílico (éteres) | \ (\ Delta\ nu_ {I-I} ~cm^ {-1}\) ">5.5 | \ (i_2's~\ pi *~\ fila derecha ~\ sigma*\) ">1950 |
| acetona (cetona) | \ (\ Delta\ nu_ {I-I} ~cm^ {-1}\) ">5.0 | \ (i_2's~\ pi *~\ fila derecha ~\ sigma*\) ">1850 |
| acetofenona (cetona) | \ (\ Delta\ nu_ {I-I} ~cm^ {-1}\) ">4.6 | \ (i_2's~\ pi *~\ fila derecha ~\ sigma*\) ">1650 |
| acetonitrilo (nitrilo) | \ (\ Delta\ nu_ {I-I} ~cm^ {-1}\) ">4.1 | \ (i_2's~\ pi *~\ fila derecha ~\ sigma*\) ">1610 |
| hexametilbenceno (aromático) | \ (\ Delta\ nu_ {I-I} ~cm^ {-1}\) ">10.4 | \ (i_2's~\ pi *~\ fila derecha ~\ sigma*\) ">1070 |
| benceno (aromático) | \ (\ Delta\ nu_ {I-I} ~cm^ {-1}\) ">4.3 | \ (i_2's~\ pi *~\ fila derecha ~\ sigma*\) ">450 |
Referencias y lecturas adicionales
- Cavallo, G.; Metrangolo, P.; Milani, R.; Pilati, T.; Priimagi, A.; Resnati, G.; Terraneo, G., El Enlace Halógeno. Reseñas Químicas 2016, 116 (4), 2478-2601.
- Politzer, P.; Murray, J.S. σ-hole Interacciones: Perspectivas y conceptos erróneos. Cristales 2017, 7, 212.
- R.Liantonio, S.Luzzati, P.Metrangolo, T.Pilati, G.Resnati, Tetraedro, 2002, 58, 4023, DOI: 10.1016/S0040-4020 (02) 00264-8
- Laurence, C.; Gal, J.-F. o., Lewis Escalas de basicidad y afinidad: Datos y Medición. John Wiley: Chichester, West Sussex, Reino Unido, 2010.
Notas
* Otros compuestos también exhiben\(\sigma\) -agujeros (y\(\pi\) -agujeros) que pueden ser utilizados en ingeniería cristalina. Para más detalles véase la referencia 2.
** para más detalles consultar la referencia 4, pp. 286-309.
Colaboradores y Atribuciones
De acuerdo con la política para obras de arte originales realizadas como parte de este proyecto, todos los dibujos sin etiquetar de estructuras químicas son de Stephen Conakes y están bajo una Licencia Creative Commons Atribución 4.0 Internacional.

