13.4.3: Hidruros y Complejos de Dihidrógeno
- Page ID
- 81103
Los ligandos pueden, sorprendentemente, unirse a través de los electrones en sus propios\(\sigma\) enlaces de una manera de tipo L. Este modo de unión depende tanto del centro metálico como del propio ligando; para ver por qué, solo necesitamos reconocer que los\(\sigma\) complejos parecen intermedios en adiciones oxidativas concertadas. Con una ligera reorganización de electrones y geometría, un\(\sigma\) ligando de tipo L puede convertirse en dos ligandos de tipo X. ¿Por qué, entonces, son estables\(\sigma\) los complejos? ¿Cómo podemos controlar la relación de\(\sigma\) complejo a complejo X 2 en una situación dada? ¿Cómo cambia la complejación de un\(\sigma\) enlace las propiedades del ligando? Abordaremos estas preguntas y más en este post.
Propiedades Generales
Lo primero que hay que darse cuenta de\(\sigma\) los complejos es que son altamente sensibles al volumen estérico. Cualquier\(\sigma\) enlace antiguo no funcionará; el hidrógeno en un extremo del enlace de unión o en el otro (o ambos) es necesario. Los\(\sigma\) complejos mejor estudiados involucran dihidrógeno (\(\ce{H2}\)), así que comencemos ahí.
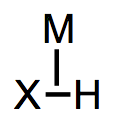
Los metales de unión posterior leve pueden unirse al dihidrógeno “de lado”. Al igual que la unión lateral en\(\pi\) complejos, hay dos interacciones orbitales importantes en juego aquí: La primera es una interacción de unión sigma (\(\ce{ \sigma H-H \bond{->} d\sigma}\)), como se muestra a la izquierda en la Figura\(\PageIndex{2}\); la segunda es una interacción de\(\pi\) unión (\( \ce{d \pi \bond{->}} \sigma^* \ce{H–H}\)), como se muestra a la derecha en la Figura \(\PageIndex{2}\). Los complejos de dihidrógeno pueden “tautomerizarse” a\(\ce{(H)2}\) isómeros de hidruro a través de la escisión del\(\ce{H–H}\) enlace con el metal (esta es una reacción de adición oxidativa, como se discute en el capítulo sobre reacciones organometálicas).
\(\ce{H2}\)la unión de una manera de tipo L acidifica masivamente el ligando. ¡Se han observado cambios en más de treinta unidades pKa tras la unión de metales! Las acidificaciones análogas de los enlaces X-H, rara vez presentan δPKa > 5. ¿Qué está causando el diferente comportamiento de los ligandos X—H y H-H? La clave es considerar la base conjugada del ligando, en particular, cuánto se estabiliza por un centro metálico en relación con el anión libre correspondiente. El principio aquí es análogo al famoso dictum de la química orgánica: considerar las especies cargadas al hacer comparaciones ácido/base. La estabilización del anión sin obstáculos\(\ce{H^-}\) por un metal es mucho mayor que la estabilización de aniones más grandes y más electronegativos como\(\ce{HO^-}\) y\(\ce{NH2^-}\) por un metal. Como resultado, es más favorable eliminar un protón de ligandos X—H complejados con metales\(\ce{H2}\) que de ligandos X—H más grandes y más electronegativos.
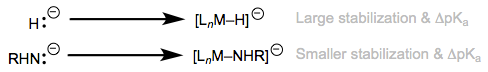
Una estabilización notablemente grande por un fragmento de metal ácido, sin ningún contrapeso de los factores estéricos, explica la acidificación extrema del dihidrógeno al unirse al metal.
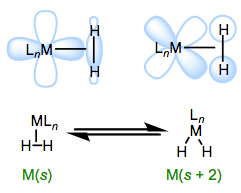
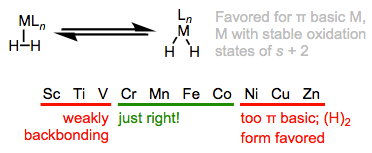
La naturaleza electrónica del centro metálico tiene dos efectos importantes en los\(\sigma\) complejos. El primero se refiere a la acidez de\(\ce{H2}\) la unión al metal. El principio aquí es consistente con lo que hemos clavado en el suelo hasta ahora. De la misma manera, los ácidos orgánicos catiónicos son más fuertes que sus homólogos neutros, los\(\sigma\) complejos de metales pobres en electrones, incluidos (y especialmente) cationes, son ácidos más fuertes que los complejos relacionados de metales ricos en electrones. El segundo se refiere a la relación de unión de tipo L a tipo X2. Deberíamos esperar que más centros metálicos ricos en electrones favorezcan al isómero X2, ya que estos deberían donar más fuertemente al orbital\(\sigma\) *H—H. Esta idea se demostró magistralmente en un estudio de Morris, en el que demostró que\(\ce{H2}\) los complejos de centros metálicos π-básicos muestran todos los signos de complejos X2, en lugar de complejos L. De manera más general, los centros metálicos en\(\sigma\) complejos necesitan un buen equilibrio de basicidad π y\(\sigma\) acidez (me gusta llamar a esto el “efecto Ricitos de Oro”). Debido a la necesidad de equilibrio,\(\sigma\) los complejos son más comunes para los metales ubicados en el centro (grupos 6-9).
El enlace M—H en los complejos de hidruro es una buena base, ¡cualquiera que haya apagado el hidruro de litio y aluminio puede dar fe de esto! Curiosamente, debido a que es una buena base, el enlace M—H puede participar en enlaces de hidrógeno con un enlace ácido X—H, donde X es un heteroátomo. Este tipo de enlace, llamado enlace dihidrógeno (ya que dos átomos de hidrógeno están involucrados), se describe mejor como una especie de interacción orbital\(\sigma\) M—H→\(\sigma\) *X—H. Piense en ello como análogo a un enlace de hidrógeno tradicional, pero usando un\(\sigma\) enlace en lugar de un par solitario. Loco, ¿verdad?
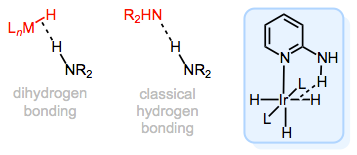
Enlace dihidrógeno en hidruros metálicos: una especie de “protonación interrumpida” de M—H.
Se conocen otros tipos de\(\sigma\) complejos, pero estos son más raros que los complejos H-H. Una clase que hemos visto antes implica interacciones agósticas de enlaces C-H en ligandos de alquilo. \(\sigma\)Los complejos de ligandos inorgánicos como silanos y estannanos pueden involucrar patrones de unión complejos, pero no nos preocuparemos por los de aquí.
Complejos de hidruro
Los enlaces metal-hidrógeno, también conocidos (engañosamente) como hidruros metálicos, son ligandos ubicuos de tipo X en la química organometálica. Hay mucho más de lo que parece la mayoría de los enlaces M-H: aunque son simples de dibujar, varían enormemente en polarización y pKa. Pueden ser ácidos o hidrídicos o ambos, dependiendo de la naturaleza del centro metálico y de las condiciones de reacción. En este post, desarrollaremos algunas heurísticas para predecir el comportamiento de los enlaces M-H para que posteriormente podamos discutir sus principales modos de reactividad (acidez, reacciones radicales, inserción migratoria, etc.).
Propiedades Generales
Los hidruros metálicos van desde nucleófilos/básicos hasta electrófilos/ácidos. Por otra parte, lo mismo puede decirse de los enlaces X—H en la química orgánica, que pueden variar desde levemente nucleófilos (considerar ésteres de Hantzsch y NADH) hasta extremadamente electrófilos (considerar ácido tríflico). Como el hidrógeno es lo que es en ambos casos, está claro que la naturaleza del fragmento X —más específicamente, la estabilidad de los fragmentos cargados X+ y X— dicta el carácter del enlace X—H. Compare los cuatro equilibrios que se describen a continuación: las estabilidades de los iones dictan la posición de cada equilibrio. Por ahora no debería sorprendernos que el fragmento W (CO) 5 altamente ácido π-ácido sea bueno para estabilizar la carga negativa; por una razón similar, el fragmento ZrCP2Cl puede estabilizar la carga positiva. *
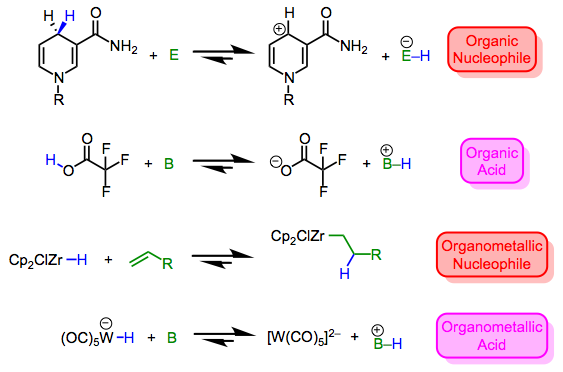
Los enlaces metal-hidrógeno pueden ser hidrídicos (nucleofílicos) o ácidos (electrófilos). La naturaleza de otros ligandos y las condiciones de reacción son claves para hacer predicciones.
Volvamos nuestra atención ahora a la fuerza de unión homolítica M-H. Un ciclo termodinámico conveniente nos permite utilizar la acidez de M—H y el potencial de oxidación de su base conjugada para determinar la fuerza de unión. Este método inteligente, empleado por Tilset e inspirado en el inimitable Bordwell, utiliza el ciclo de la siguiente figura. También se proporcionan valores de BDE para algunos complejos. A partir de los ejemplos proporcionados, podemos ver que la fuerza de unión aumenta hacia abajo un grupo en la tabla periódica. Esta tendencia, y la idea de que los hidruros puente tienen BDE más grandes que los enlaces M—H terminales, son casi las únicas tendencias observables en M—H BDE.
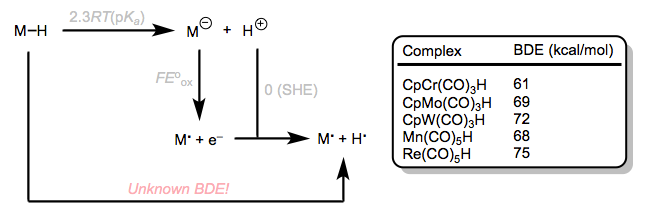
Un ciclo inteligente para determinar BDE a partir de otras cantidades conocidas, con valores de BDE seleccionados. He dejado fuera términos de solvatación del ciclo termodinámico. Para obtener más detalles, consulte el enlace de Tilset anterior.
¿Por qué es útil conocer los BDE M-H? Por un lado, los BDE relativos de los enlaces M-C y M-H determinan la termodinámica de la eliminación de β-hidruro, lo que resulta en la sustitución de un enlace covalente M-C por un enlace M-H. En segundo lugar, los complejos que contienen enlaces M-H débiles suelen ser buenos agentes de transferencia de hidrógeno y pueden reaccionar con radicales orgánicos y dobles enlaces, canalizando reductores de estannano y silano de la química orgánica.
La hidricidad se refiere a la tendencia de un ligando hidruro a partir como H-. Un ciclo termodinámico similar relaciona la energía de perder H— con los potenciales de oxidación de la base conjugada y la base conjugada oxidada; sin embargo, este método se complica por el hecho de que la pérdida de hidruro establece un sitio de coordinación abierto. He proporcionado una versión abreviada del ciclo a continuación. Las hidricidades son algo predecibles a partir de las propiedades electrónicas y estéricas del centro metálico: la inclusión de ligandos donadores de electrones tiende a aumentar la hidricidad, mientras que los ligandos atractores de electrones o ácidos tienden a disminuirla. Para hidruros de cinco coordenadas que forman complejos planos cuadrados de 16 electrones tras la pérdida de hidruro, el ángulo de mordida de las fosfinas quelantes juega un papel interesante. A medida que aumenta el ángulo de mordida, la hidricidad también lo hace
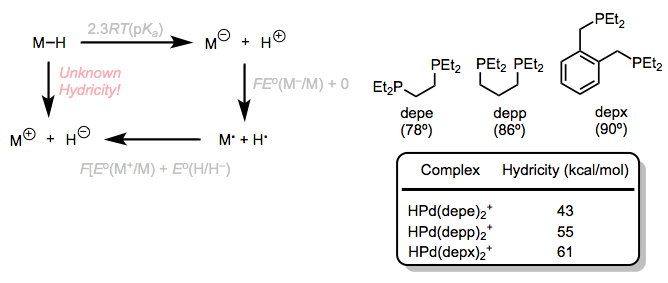
Un ciclo termodinámico para la hidricidad, con algunos ejemplos. La hidricidad y el ángulo de mordida están bien correlacionados en hidruros de paladio de cinco coordenadas
Los hidruros de puente son una clase intrigante de ligandos. Una pregunta para reflexionar: ¿cómo puede un ligando asociado con solo dos electrones posiblemente puentear dos centros metálicos? ¿Cómo pueden dos electrones mantener tres átomos juntos? Entra en la magia de la unión de tres centros y dos electrones. ¡Podemos imaginar el enlace M—H sigma como un donante de electrones en sí mismo! Con esto en mente, podemos imaginar que los hidruros son capaces de unirse de extremo a un metal (como un ligando estándar de tipo X) y de lado a otro (como un ligando de sistema π de tipo L, pero usando electrones sigma en su lugar). Slick, ¿no? Veremos más enlaces laterales de electrones sigma en un futuro post sobre complejos sigma.
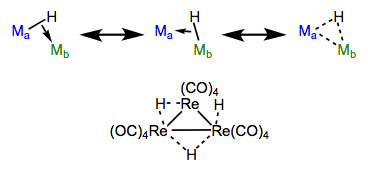
Formas de resonancia de hidruros puenteantes, con un ejemplo. ¡Complejos sigma como estos también aparecen en otros contextos!
De acuerdo con la idea de que el puenteo es el resultado de la unión “de extremo a lado”, los ángulos de unión de los hidruros de puente nunca son de 180°.

