Sustitución asociativa de ligandos
- Page ID
- 80275
A pesar de la santidad de la regla de 18 electrones para muchos estudiantes de química organometálica, una amplia variedad de complejos estables poseen menos de 18 electrones totales en el centro metálico. Quizás los ejemplos más famosos de estos complejos son los complejos de 14 y 16 electrones de metales del grupo 10 involucrados en reacciones de acoplamiento cruzado.
La sustitución de ligando en complejos de esta clase generalmente ocurre a través de un mecanismo asociativo, que implica el acercamiento del ligando entrante al complejo antes de la salida del grupo saliente. Si tenemos en mente este principio, parece bastante fácil predecir cuándo es probable que la sustitución del ligando sea asociativa. Pero, ¿cómo podemos detectar un mecanismo asociativo en los datos experimentales y cuáles son algunas de las consecuencias de este mecanismo?
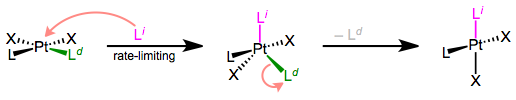
El mecanismo prototípico de sustitución asociativa de ligandos. El primer paso es determinar la tasa. Un mecanismo típico para la sustitución asociativa de ligandos se muestra anteriormente. Cabe señalar que la geometría piramidal cuadrada también es posible para el intermedio, pero es menos común. Empecemos por la cinética de la reacción.
Cinética de reacción
La cinética de reacción se usa comúnmente para dilucidar los mecanismos de reacción organometálicos, y la sustitución de ligandos no es la excepción. Diferentes mecanismos de sustitución pueden seguir diferentes leyes de velocidad, por lo que trazar la dependencia de la velocidad de reacción de la concentración a menudo nos permite distinguir mecanismos. La ley de tasa de sustitución asociativa es análoga a la de la reacción S N 2, la tasa depende de las concentraciones de ambos materiales de partida.
\[ L_nM–L^d + L_i → L_nM–L_i + L^d \]
\[ \dfrac{d[L_nM–L^i]}{dt} = rate = k_1[L_nM–L^d][L^i] \]
The easiest way to determine this rate law is to use pseudo-first-order conditions. Although the rate law is second order overall, if we could somehow render the concentration of the incoming ligand unchanging, the reaction would appear first order. The observed rate constant under these conditions reflects the constancy of the incoming ligand’s concentration (\(k_{obs} = k_1[L^i]\), where both \(k_1\) and \([Li]\) are constants). How can we make the concentration of the incoming ligand invariant, you ask? We can drown the reaction in ligand to achieve this. The teensy weensy bit actually used up in the reaction has a negligible effect on the concentration of the “sea” of starting ligand we began with. The observed rate is equal to \(k_{obs}[L_nM–L^d]\), as shown by the purple trace below. By determining \(k_{obs}\) at a variety of \([L^i]\) values, we can finally isolate \(k_1\), the rate constant for the slow step. The red trace below at right shows the idea.
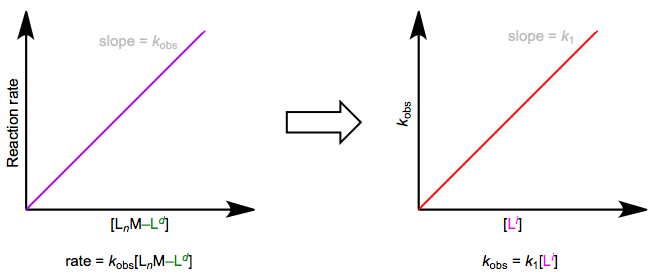
Sustitución asociativa bajo condiciones de pseudo-primer orden. La reacción es “inundada” con el ligando entrante.
En muchos casos, el rastro rojo termina con una intercepción y distinta de cero... curioso, si nos limitamos al mecanismo simple que se muestra en la primera figura de este post. Una intercepción distinta de cero sugiere un mecanismo más complejo. Necesitamos agregar un nuevo término (llamado por razones\(k_s\) para aclararse en breve) a nuestro primer conjunto de ecuaciones:
\[rate = (k_1[L_i] + k_s)[L_nM–L^d]\]
\[k_{obs} = k_1[L_i] + k_s\]
La ley de tasa completa sugiere que algún otro paso (con tasa ks [LNM—ld]) independiente del ligando entrante está involucrado en el mecanismo. Para explicar esta observación, podemos invocar al disolvente como reactivo. El solvente puede asociarse con el complejo primero en una etapa lenta, luego el ligando entrante puede desplazar el solvente en una etapa rápida. La concentración de solvente no entra en la ley de tarifas porque, bueno, ¡está ahogando a los reactivos y su concentración sufre un cambio insignificante! A continuación se muestra un ejemplo de este mecanismo en el contexto de la química de Pt (II).
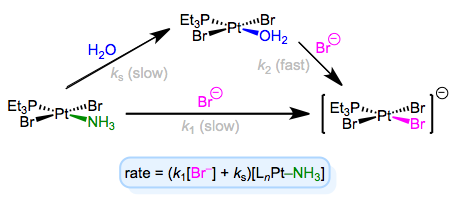
Sustitución asociativa con participación solvente: ¡un mecanismo de rascarse la cabeza para muchos estudiantes de posgrado organometálicos!
Como un aparte, cabe mencionar que la entropía de activación de la sustitución asociativa suele ser negativa. La entropía disminuye a medida que el ligando entrante y el complejo se unen en la etapa de determinación de la velocidad. La sustitución disociativa muestra el comportamiento opuesto: la pérdida del ligando saliente en el RDS aumenta la entropía, dando como resultado una entropía positiva de activación.
Estereoquímica de la sustitución
Como vimos en las discusiones sobre el efecto trans, los ligandos de entrada y salida ocupan posiciones ecuatoriales en el intermedio bipiramidal trigonal. La reversibilidad microscópica es la culpable: el mecanismo de la sustitución directa (desplazamiento de la salida por el ligando entrante) debe ser el mismo que el mecanismo de la reacción inversa (desplazamiento del entrante por el ligando saliente). Esto puede ser un punto confuso, así que examinemos un mecanismo alternativo que viola la reversibilidad microscópica.
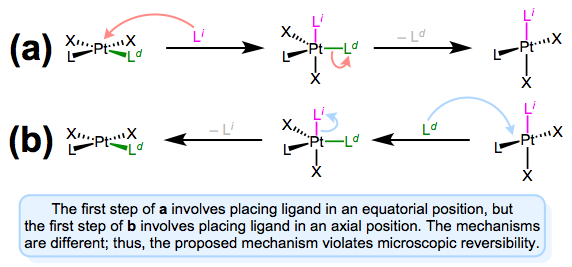
Un mecanismo que implica aproximación a una posición axial y salida de una posición ecuatorial viola la reversibilidad microscópica. ¡Las reacciones hacia adelante y hacia atrás a y b difieren!
La figura anterior muestra por qué no es posible un mecanismo que implique aproximación axial y salida ecuatorial (o viceversa). Las reacciones hacia adelante y hacia atrás difieren, de hecho, en ambos pasos. En el mecanismo directo a, el ligando entrante entra en un sitio axial. Pero en la reacción inversa, el ligando entrante (es decir, el ligando de salida en el mecanismo a) se asienta en un sitio ecuatorial. Los segundos pasos de cada mecanismo también difieren: implica la pérdida de un ligando ecuatorial, mientras que b implica la pérdida de un ligando axial. En pocas palabras, este mecanismo viola la reversibilidad microscópica. ¿Y qué pasa con un mecanismo que implica aproximación axial y salida axial? Tal mecanismo es poco probable por motivos electrónicos. Los sitios ecuatoriales son más ricos en electrones que los sitios axiales, y σ se unen al axial\(d_{z^2}\) orbital is expected to be strong. Intuitively, then, loss of ligand from an axial site is less favorable than loss from an equatorial site.
I know what you’re thinking: what the heck does all of this have to do with stereochemistry? Notice that, in the equatorial-equatorial mechanism (first figure of this post), the axial ligands don’t move at all. The configuration of the starting complex is thus retained in the product. Although retention is “normal,” complications often arise because five-coordinate TBP complexes—like other odd-coordinate organometallic complexes—are often fluxional. Axial and equatorial ligands can rapidly exchange through a process called Berry pseudorotation, which resembles the axial ligands “cutting through” a pair of equatorial ligands like scissors (animation!). Fluxionality means that all stereochemical bets are off, since any ligand can feasibly occupy an equatorial site. In the example below, the departing ligand starts out cis to L, but the incoming ligand ends up trans to L.
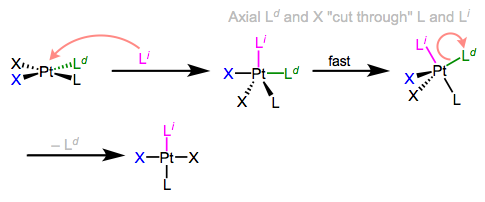
Pseudorotación de bayas en medio de la sustitución asociativa de ligandos.
¿Sustitución asociativa en complejos de 18 electrones?
La sustitución asociativa puede ocurrir en complejos de 18 electrones si está precedida por la disociación de un ligando. Por ejemplo, los cambios en la hapticidad de los ligandos de ciclopentadienilo o indenilo pueden abrir un sitio de coordinación, que puede ser ocupado por un nuevo ligando para dar inicio a la sustitución asociativa. Un ligando alilo puede convertirse de su forma π a σ, dejando un sitio de coordinación abierto donde quedó el enlace π. Un caso particularmente interesante es el ligando nitrosil: la conversión de su forma lineal a doblada abre un sitio para la coordinación de un ligando externo.
Resumen
La sustitución asociativa de ligandos es común para complejos con 16 electrones totales o menos. La reacción se caracteriza por una ley de velocidad de segundo orden, la posibilidad de participación solvente y un intermedio bipiramidal trigonal que a menudo es fluxional. Un sitio de coordinación abierto es esencial para la sustitución asociativa, pero estos sitios suelen estar ocultos en el dinamismo de los complejos de 18 electrones con ligandos lábiles.

