4.6: Energética de las reacciones químicas
( \newcommand{\kernel}{\mathrm{null}\,}\)
La energética se ocupa de las energías involucradas en las reacciones químicas. Hay dos tipos de energías: la primera está relacionada con la termodinámica que es la energía liberada o absorbida cuando los reactivos se convierten en los productos, y la segunda está relacionada con la cinética de la reacción, es decir, la energía que deben poseer las moléculas reaccionantes para superar la barrera energética para conversión a los productos.
Diagrama de coordenadas de reacción
El progreso de la gráfica de reacción versus energía se muestra en la Fig. 4.7.1.
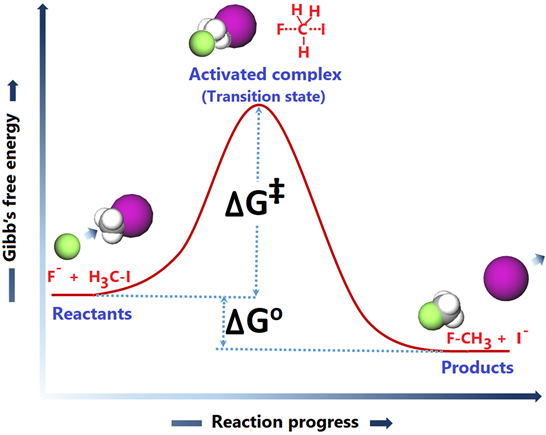
El punto de partida muestra el nivel de energía de los reactivos. Recuerda que cada sustancia tiene energía interna la cual se manifiesta como temperatura. Las moléculas se mueven debido a la energía interna y chocan con otras moléculas. La colisión entre los reactivos suele ser el primer requisito para que la reacción continúe.
El ion F en este ejemplo colisiona con el objetivo H 3 C-I desde el lado opuesto al enlace C-I. La colisión en un ángulo distinto de 180 o con respecto a la unión C-I es menos efectiva o ineficaz para iniciar la ruptura del enlace C-I. Entonces, la orientación adecuada de las moléculas reaccionantes en el momento de la colisión es el segundo requisito.
Después de una colisión orientada correctamente, el enlace C-I comienza a romperse, el enlace F-C comienza a fabricarse y la energía del sistema se eleva a un nivel máximo donde la ruptura y fabricación de la unión están aproximadamente a la mitad. La especie en los máximos de la curva de energía se denomina complejo activado o estado de transición. La diferencia de energía entre los reactivos y el estado de transición se denomina energía de activación (∆G ‡). Los reactivos deben tener suficiente energía cinética para superar la barrera de energía de activación, que es el tercer requisito para que ocurra la reacción. Un resumen de los requisitos básicos de una reacción química para que ocurra es el siguiente.
- Las moléculas reaccionantes chocan entre sí, cuanto más frecuente es la colisión, más rápida es la reacción.
- Las moléculas deben tener una orientación adecuada en el momento de la colisión, este factor varía de una reacción a otra.
- Las moléculas colisionantes deben tener energía, además de la energía química potencial, igual o mayor que la energía de activación, menor es la energía de activación, más rápida es la reacción.
Las formas complejas activadas si se cumplen los requisitos básicos. El complejo activado rueda cuesta abajo en la escala de energía y se asienta en el nivel de energía de los productos donde los viejos enlaces están completamente rotos, y los nuevos enlaces están completamente formados. El gráfico del progreso de la reacción frente a la energía, como en la Fig. 4.7.1 se denomina diagrama de coordenadas de reacción.
Reacciones exotérmicas y endotérmicas
La energía absorbida o liberada en forma de calor en condiciones de presión constante se denomina cambio de entalpía (∆H), que es casi lo mismo que la energía interna absorbida o liberada (∆G) en la mayoría de las reacciones.
Una reacción química que libera calor es exotérmica. Una reacción química que absorbe calor es una reacción endotérmica.
La formación de uniones es siempre exotérmica, y la rotura de la unión es lo opuesto, es decir, endotérmico, como se ilustra en la Fig. 4.7.2.


En una reacción química, algunos enlaces se rompen y se forman algunos enlaces. Si la rotura de la unión absorbe menos calor que el calor liberado en la nueva formación de unión, la reacción es exotérmica. Los productos son menores en energía que los reactivos, y el ∆H es negativo para reacciones exotérmicas. Lo contrario es cierto para una reacción endotérmica, es decir, la ruptura del enlace absorbe más calor que la formación del enlace; los productos son más altos en energía que los reactivos, y ∆H es positivo, como se ilustra en la Fig. 4.8.3.

Un ejemplo de una reacción exotérmica es la combustión de metano que libera el calor utilizado para cocinar.
CH4+2O2⟶CO2+2H2OΔHo=−891kJ
Un ejemplo de una reacción endotérmica es la fotosíntesis.
6CO2+6H2O⟶C6H12O6+6O2ΔHo=+2800kJ
Tenga en cuenta que el signo de ∆H es —ve para la reacción exotérmica y +ve para una reacción endotérmica. A veces, la energía se muestra como un producto para la reacción exotérmica, y como reactivo para la reacción edotérmica. Por ejemplo, las dos creaciones anteriores pueden escribirse como:
CH4+2O2⟶CO2+2H2O+891kJ
6CO2+6H2O+2800kJ⟶C6H12O6+6O2

Los paquetes instantáneos calientes o fríos utilizados en los hospitales se basan en el calor de disolución de sales en agua, como se muestra en la Fig. 4.7.4. La sal y el agua están en bolsas separadas en el paquete. Cuando se rompe el sello, la sal se disuelve en agua y libera o absorbe calor. La disolución de la sal de CaCl 2 en agua es un proceso exotérmico que es la fuente de calor en un paquete caliente:
CaCl2(s)⟶CaCl2(aq)ΔHo=−82kJ
La disolución de la sal NH 4 NO 3 en agua es un proceso endotérmico que se utiliza para absorber calor en un paquete frío.
NH4NO3(s)⟶NH4NO3(aq)ΔHo=−26kJ
Factores que afectan la velocidad de una reacción química
La velocidad de una reacción química, es decir, la cantidad de un reactivo consumido o la cantidad de un producto formado por unidad de tiempo, depende de la energía de activación de la reacción, cuanto mayor sea la energía de activación, más lenta es la velocidad de una reacción y viceversa. Una reacción requiere colisión entre las moléculas reaccionantes, con orientación adecuada, y energía suficiente para superar la barrera de energía de activación.
Cualquier factor que aumente la velocidad de colisiones, mejore la orientación adecuada o aumente la energía cinética de las moléculas provoca un aumento en la velocidad de reacción. Los factores incluyen concentración, temperatura y catalizadores.
Efecto de la concentración de reactivos
Cuanto mayor sea la concentración, más frecuentes son las colisiones y más rápida es la reacción, como se ilustra en la Fig. 4.7.5.
En el proceso respiratorio, el oxígeno (O 2) se une con la hemoglobina (Hb) en los pulmones.
Hb (aq) + O 2 (g) → HbO 2 (aq)
A los pacientes que tienen problemas respiratorios se les dan máscaras respiratorias con una mayor concentración de oxígeno que en la atmósfera para aumentar la tasa de unión de oxígeno con la hemoglobina.

Efecto de la temperatura
La energía cinética de las moléculas a una temperatura dada sigue la distribución de Boltzman, como se ilustra en la Fig. 4.8.6. El aumento de la temperatura aumenta la energía cinética promedio de las moléculas lo que aumenta la fracción de moléculas con más que la energía de activación.
Un aumento en la temperatura aumenta la velocidad de las reacciones químicas, generalmente, un aumento de 10 o C en la temperatura duplica la velocidad de una reacción química.

Algunos ejemplos prácticos del uso de este principio son los siguientes. Almacenar alimentos en refrigeradores a temperaturas más bajas disminuye la tasa de reacciones dando como resultado una vida más larga de los alimentos. Cocinar los alimentos en una olla a presión aumenta la temperatura, lo que resulta en una cocción más rápida que en una sartén abierta. En algunas cirugías cardíacas, la temperatura corporal se baja a 28 o C para disminuir la tasa de metabolismo lo que disminuye la demanda de oxígeno para que el corazón pueda ser detenido temporalmente para la cirugía.
Efecto de catalizadores y enzimas
Los catalizadores y enzimas incrementan la velocidad de reacción al disminuir la energía de activación de la reacción a través de una ruta alternativa, como se ilustra en la Fig. 4.7.7.
Los catalizadores y las enzimas no consumen en la reacción, se regeneran y repiten la acción. Las enzimas son los catalizadores en las reacciones bioquímicas. Las enzimas también aumentan la velocidad de reacción al unirse con los reactivos y orientarlos adecuadamente para la reacción.



