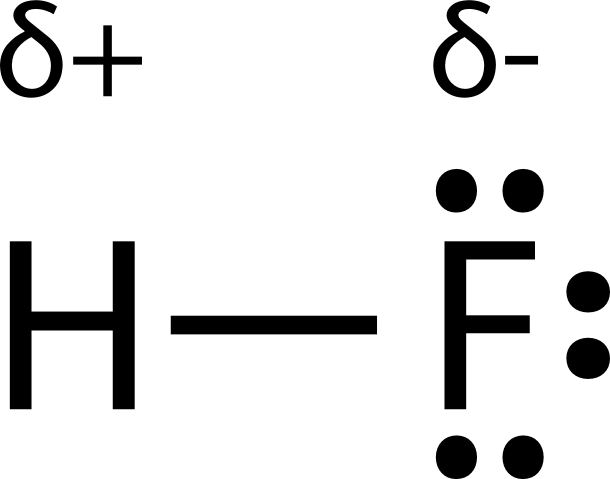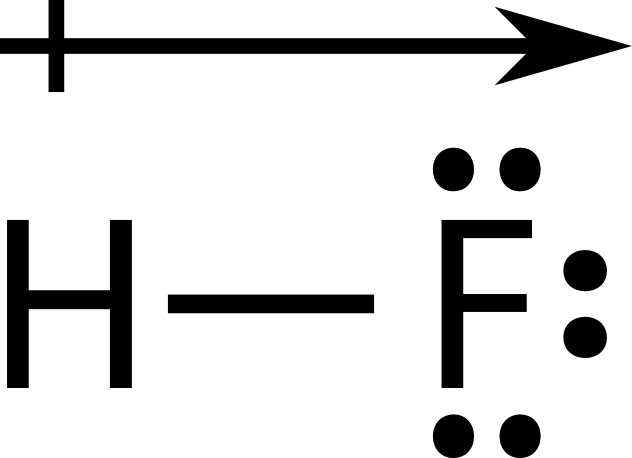5.3: Polaridad y Fuerzas Intermoleculares
- Page ID
- 77317
Resultados de aprendizaje
- Definir la electronegatividad.
- Describir cómo la diferencia de electronegatividad entre dos átomos en un enlace covalente da como resultado la formación de un enlace covalente no polar, covalente polar o iónico.
- Predecir la polaridad de una molécula.
- Describir cómo la geometría molecular juega un papel en la determinación de si una molécula es polar o no polar.
- Distinguir entre los siguientes tres tipos de fuerzas intermoleculares: fuerzas dipolo-dipolo, fuerzas de dispersión de Londres y enlaces de hidrógeno.
- Identificar tipos de fuerzas intermoleculares en una molécula.
- Describir cómo la unión química y las fuerzas intermoleculares influyen en las propiedades de varios compuestos.
En un enlace iónico, uno o más electrones se transfieren de un átomo a otro. En un enlace covalente, uno o más pares de electrones se comparten entre los átomos. Sin embargo, la unión entre átomos de diferentes elementos rara vez es puramente iónica o puramente covalente.
Polaridad de enlace
La polaridad del enlace está determinada por la diferencia en la electronegatividad y se define como la capacidad relativa de un átomo para atraer electrones cuando está presente en un compuesto. A continuación se muestran las electronegatividades de diversos elementos. Obsérvese que los valores de elecronegatividad aumentan de izquierda a derecha y de abajo hacia arriba en la tabla periódica. El grado en que un enlace dado es iónico o covalente se determina calculando la diferencia de electronegatividad entre los dos átomos involucrados en el enlace.

Como ejemplo, considere el enlace que se produce entre un átomo de potasio y un átomo de flúor. Usando la tabla, la diferencia en electronegatividad es\(4.0 - 0.8 = 3.2\). Debido a que la diferencia en la electronegatividad es relativamente grande, el enlace entre los dos átomos es principalmente iónico. Dado que el átomo de flúor tiene una atracción mucho mayor para los electrones que el átomo de potasio, se considera que el electrón de valencia del átomo de potasio se ha transferido completamente al átomo de flúor. La siguiente figura muestra cómo la diferencia en electronegatividad se relaciona con el carácter iónico o covalente de un enlace químico.

De acuerdo con la figura anterior, una diferencia en la electronegatividad (\(\Delta\)EN) mayor a 1.7 da como resultado un enlace que es mayormente de carácter iónico.
Enlaces covalentes no polares
Un enlace en el que la diferencia de electronegatividad es menor de 1.7 se considera que es mayormente de carácter covalente. Sin embargo, a menudo se hace una distinción entre dos tipos generales de enlaces covalentes. Un enlace covalente no polar es un ond covalente en el que los electrones de unión se comparten por igual entre los dos átomos. En un enlace covalente no polar, la distribución de la carga eléctrica se equilibra entre los dos átomos (ver figura a continuación).

Los dos átomos de cloro comparten el par de electrones en el enlace covalente simple por igual, y la densidad de electrones que rodea a la\(\ce{Cl_2}\) molécula es simétrica. Cualquier molécula diatómica en la que los dos átomos sean el mismo elemento debe estar unida por un enlace covalente no polar.
Hay siete elementos diatómicos, que son elementos cuya forma natural es de una molécula diatómica. Son hidrógeno\(\left( \ce{H_2} \right)\), nitrógeno\(\left( \ce{N_2} \right)\), oxígeno\(\left( \ce{O_2} \right)\)\(\left( \ce{F_2} \right)\), flúor, cloro\(\left( \ce{Cl_2} \right)\)\(\left( \ce{Br_2} \right)\), bromo y yodo\(\left( \ce{I_2} \right)\). Al formar una molécula diatómica, ambos átomos en cada una de estas moléculas satisfacen la regla del octeto, dando como resultado una estructura mucho más estable que los átomos aislados
Observe de la figura anterior que las moléculas en las que la diferencia de electronegatividad es muy pequeña (<0.4) también se consideran covalentes no polares. Un ejemplo sería un enlace entre cloro y bromo (\(\Delta\)EN\(= 3.16 - 2.96 = 0.20\)).
Enlaces Covalentes Polares
Un enlace en el que la diferencia de electronegatividad entre los átomos está entre 0.4 y 1.7 se denomina enlace covalente polar. Un enlace covalente polar es un enlace covalente en el que los átomos tienen una atracción desigual por los electrones, por lo que la compartición es desigual. En un enlace covalente polar, a veces simplemente llamado enlace polar, la distribución de electrones compartidos dentro de la molécula ya no es simétrica (ver figura abajo).

La molécula de fluoruro de hidrógeno tiene una diferencia de electronegatividad de 1.9, lo que la ubica en la categoría de ser ligeramente iónica. Sin embargo, el ion hidrógeno\(\left( \ce{H^+} \right)\) es tan pequeño que no es capaz de adoptar la estructura reticular cristalina de un compuesto iónico. El fluoruro de hidrógeno es una molécula altamente polar. Debido a su mayor electronegatividad, la densidad electrónica alrededor del átomo de flúor es mucho mayor que la densidad electrónica alrededor del átomo de hidrógeno.
Una manera fácil de ilustrar la distribución desigual de electrones en un enlace covalente polar es usar la letra griega delta\(\left( \delta \right)\) junto con un signo positivo o negativo para indicar que un átomo tiene una carga parcial positiva o negativa.
El átomo con mayor electronegatividad adquiere una carga negativa parcial, mientras que el átomo con la electronegatividad menor adquiere una carga positiva parcial. El símbolo delta se utiliza para indicar que la cantidad de carga es menor a uno. También se puede utilizar una flecha cruzada para indicar la dirección de mayor densidad de electrones.
Ejemplo\(\PageIndex{1}\)
¿Qué tipo de enlace se formará entre cada uno de los siguientes pares de átomos?
- \(\ce{C}\)y\(\ce{O}\)
- \(\ce{Na}\)y\(\ce{N}\)
- \(\ce{B}\)y\(\ce{H}\)
Solución
Paso 1: Enumere las cantidades conocidas y planifique el problema.
Conocido
Usando la tabla de electronegatividad:
- \(\ce{C} = 2.5, \: \ce{O} = 3.5\)
- \(\ce{Na} = 0.9, \: \ce{N} = 3.0\)
- \(\ce{B} = 2.0, \: \ce{H} = 2.1\)
Paso 2: Resolver.
Calcula la diferencia y usa el diagrama anterior para identificar el tipo de enlace.
\[3.5 - 2.5 = 1.0 \rightarrow \ce{C-O} \: \text{bond is polar covalent}\]
\[3.0 - 0.9 = 2.1 \rightarrow \ce{Na-N} \: \text{bond is ionic}\]
\[2.1 - 2.0 = 0.1 \rightarrow \ce{B-H} \: \text{bond is nonpolar covalent}\]
Paso 3: Piensa en tu resultado.
Los enlaces entre átomos no metálicos son generalmente de naturaleza covalente (A y C), mientras que los enlaces entre un átomo metálico y un átomo no metálico son generalmente iónicos.
Polaridad Molecular
Una molécula polar es una molécula en la que un extremo de la molécula es ligeramente positivo, mientras que el otro extremo es ligeramente negativo. Una molécula diatómica que consiste en un enlace covalente polar, tal como\(\ce{HF}\), es una molécula polar. Las dos regiones cargadas eléctricamente en cada extremo de la molécula se denominan polos, similares a un imán que tiene un polo norte y otro sur. Una molécula con dos polos se llama dipolo. El fluoruro de hidrógeno es un dipolo. A continuación se muestra una forma simplificada de representar moléculas (véase la figura a continuación).

Cuando se colocan entre placas cargadas opuestamente, las moléculas polares se orientan de manera que sus extremos positivos estén más cerca de la placa negativa y sus extremos negativos estén más cerca de la placa positiva (ver figura a continuación).
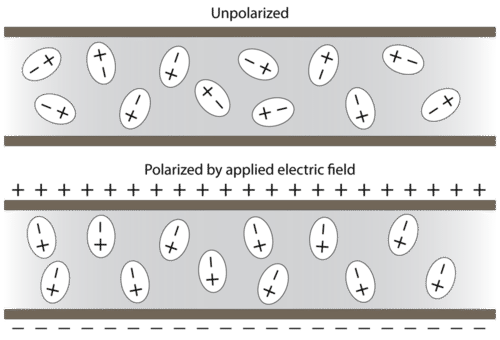
Se pueden utilizar técnicas experimentales que involucran campos eléctricos para determinar si una determinada sustancia está compuesta por moléculas polares y para medir el grado de polaridad.
Para las moléculas con más de dos átomos, también se debe tomar en cuenta la geometría molecular a la hora de determinar si la molécula es polar o no polar. A continuación se muestra una comparación entre el dióxido de carbono y el agua (véase la figura a continuación). \(\left( \ce{CO_2} \right)\)El dióxido de carbono es una molécula lineal. Los átomos de oxígeno son más electronegativos que el átomo de carbono, por lo que hay dos dipolos individuales que apuntan hacia afuera desde el\(\ce{C}\) átomo hacia cada\(\ce{O}\) átomo. Sin embargo, dado que los dipolos son de igual fuerza y están orientados de esta manera, se cancelan entre sí, y la polaridad molecular general de\(\ce{CO_2}\) es cero.
El agua es una molécula doblada debido a los dos pares solitarios en el átomo de oxígeno central. Los dipolos individuales apuntan desde los\(\ce{H}\) átomos hacia el\(\ce{O}\) átomo. Debido a la forma los dipolos no se cancelan entre sí, y la molécula de agua es polar. En la siguiente figura, el dipolo neto se muestra en azul y apunta hacia arriba.

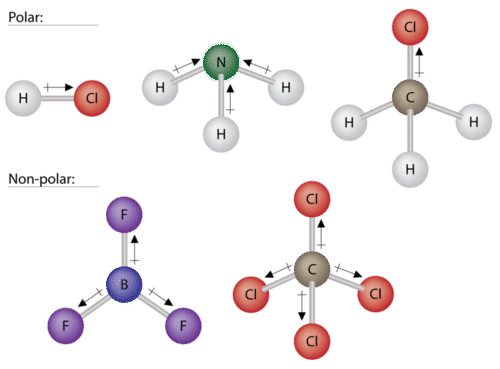
Algunas otras moléculas se muestran a continuación (ver figura a continuación). Observe que una molécula tetraédrica como\(\ce{CH_4}\) es no polar. Sin embargo, si uno de los\(\ce{H}\) átomos periféricos es reemplazado por otro átomo que tiene una electronegatividad diferente, la molécula se vuelve polar. Una molécula plana trigonal\(\left( \ce{BF_3} \right)\) puede ser no polar si los tres átomos periféricos son iguales, pero una molécula piramidal trigonal\(\left( \ce{NH_3} \right)\) es polar debido al par de electrones en los átomos de nitrógeno.
Fuerzas intermoleculares
Los enlaces covalentes e iónicos pueden denominarse fuerzas intramoleculares: fuerzas que actúan dentro de una molécula o cristal. Las moléculas también atraen a otras moléculas. Las fuerzas intermoleculares son atractivos que ocurren entre las moléculas. Las fuerzas intermoleculares son más débiles que los enlaces iónicos o covalentes. Sin embargo, las diferentes fuerzas de diferentes tipos de fuerzas intermoleculares son responsables de las propiedades físicas de los compuestos moleculares como los puntos de fusión y ebullición y la cantidad de energía necesaria para los cambios de estado.
Fuerzas de dispersión de Londres
Las fuerzas de dispersión son las más débiles de todas las fuerzas intermoleculares. A menudo se les llama fuerzas londinenses después de Fritz London (1900 - 1954), quien propuso por primera vez su existencia en 1930. Las fuerzas de dispersión de Londres son fuerzas intermoleculares que ocurren entre todos los átomos y moléculas debido al movimiento aleatorio de los electrones.
Por ejemplo, la nube de electrones de un átomo de helio contiene dos electrones, y, cuando se promedian a lo largo del tiempo, estos electrones se distribuirán uniformemente alrededor del núcleo. Sin embargo, en cualquier momento dado, la distribución de electrones puede ser desigual, dando como resultado un dipolo instantáneo. Este dipolo débil y temporal puede influir posteriormente en los átomos de helio vecinos a través de la atracción electrostática y la repulsión. A continuación se ilustra la formación de un dipolo inducido.

Los dipolos instantáneos e inducidos son débilmente atraídos entre sí. La fuerza de las fuerzas de dispersión aumenta a medida que aumenta el número total de electrones en los átomos o moléculas no polares. El grupo halógeno consta de cuatro elementos que toman la forma de moléculas diatómicas no polares. A continuación se enumera una comparación de los puntos de fusión y ebullición para cada uno.
| Molécula | Número Total de Electrones | Punto de fusión\(\left( ^\text{o} \text{C} \right)\) | Punto de ebullición\(\left( ^\text{o} \text{C} \right)\) | Estado físico a temperatura ambiente |
|---|---|---|---|---|
| \(\ce{F_2}\) | 18 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-220 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-188 | gas |
| \(\ce{Cl_2}\) | 34 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-102 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-34 | gas |
| \(\ce{Br_2}\) | 70 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-7 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">59 | líquido |
| \(\ce{I_2}\) | 106 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">114 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">184 | sólido |
Las fuerzas de dispersión son más fuertes para las moléculas de yodo porque tienen el mayor número de electrones. Las fuerzas relativamente más fuertes dan como resultado puntos de fusión y ebullición que son los más altos del grupo halógeno. Estas fuerzas son lo suficientemente fuertes como para mantener las moléculas de yodo juntas en estado sólido a temperatura ambiente. Las fuerzas de dispersión son progresivamente más débiles para el bromo, el cloro y el flúor, como se ilustra por sus puntos de fusión y ebullición constantemente más bajos. El bromo es un líquido a temperatura ambiente, mientras que el cloro y el flúor son gases. Debido a que las moléculas gaseosas están tan separadas entre sí, las fuerzas intermoleculares son casi inexistentes en el estado gaseoso, por lo que las fuerzas de dispersión en cloro y flúor solo se vuelven medibles a medida que disminuye la temperatura y se condensan en estado líquido.
Fuerzas dipolo-dipolo
Las fuerzas dipolo-dipolo son las fuerzas atractivas que ocurren entre las moléculas polares (véase la figura a continuación). Una molécula de cloruro de hidrógeno tiene un átomo de hidrógeno parcialmente positivo y un átomo de cloro parcialmente negativo. Una colección de muchas moléculas de cloruro de hidrógeno se alinearán para que las regiones cargadas opuestamente de las moléculas vecinas estén cerca unas de otras.
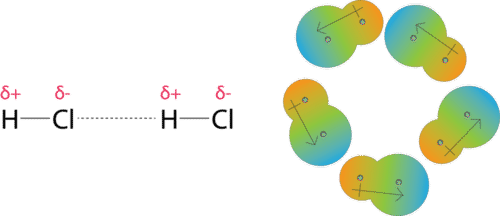
Enlace de hidrógeno
La fuerza de atracción entre las moléculas de agua es un tipo inusualmente fuerte de interacción dipolo-dipolo. El agua contiene átomos de hidrógeno que están unidos a un átomo de oxígeno altamente electronegativo, lo que genera enlaces muy polares. El átomo de hidrógeno parcialmente positivo de una molécula es entonces atraído por el átomo de oxígeno de una molécula de agua cercana (ver figura abajo).
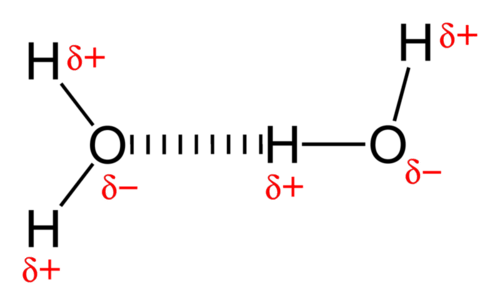
Un enlace de hidrógeno es una fuerza de atracción intermolecular en la que un átomo de hidrógeno, que está unido covalentemente a un átomo pequeño y altamente electronegativo, es atraído por un par solitario de electrones en un átomo en una molécula vecina. Los enlaces de hidrógeno son muy fuertes en comparación con otras interacciones dipolo-dipolo, pero aún mucho más débiles que un enlace covalente. Un enlace de hidrógeno típico es aproximadamente\(5\%\) tan fuerte como un enlace covalente.
Los enlaces de hidrógeno se producen solo en moléculas donde el hidrógeno está unido covalentemente a uno de tres elementos: flúor, oxígeno o nitrógeno. Estos tres elementos son tan electronegativos que retiran la mayor parte de la densidad electrónica del enlace covalente con hidrógeno, dejando al\(\ce{H}\) átomo muy deficiente en electrones. Debido a que el átomo de hidrógeno no tiene electrones que no sean los del enlace covalente, su núcleo cargado positivamente está casi completamente expuesto, permitiendo fuertes atractivos a otros pares de electrones solitarios cercanos.
El enlace de hidrógeno que se produce en el agua conduce a algunas propiedades inusuales, pero muy importantes. La mayoría de los compuestos moleculares que tienen una masa similar al agua son gases a temperatura ambiente. Sin embargo, debido a los fuertes enlaces de hidrógeno, las moléculas de agua pueden permanecer condensadas en estado líquido. La siguiente figura muestra cómo su forma doblada y la presencia de dos átomos de hidrógeno por molécula permiten que cada molécula de agua se enlace de hidrógeno con varias otras moléculas.
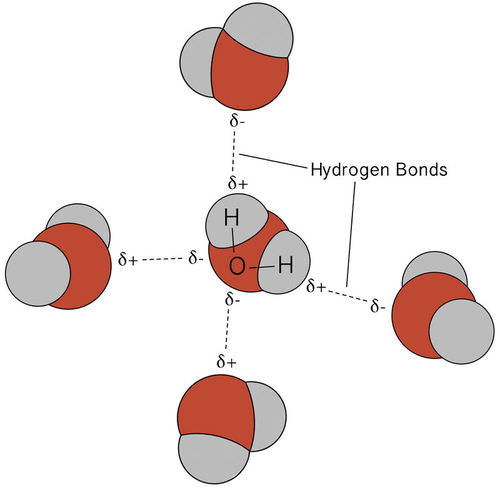
En estado líquido, los enlaces de hidrógeno del agua pueden romperse y reformarse a medida que las moléculas fluyen de un lugar a otro. Cuando se enfría el agua, las moléculas comienzan a disminuir la velocidad. Eventualmente, cuando el agua se congela en hielo, los enlaces de hidrógeno se vuelven más rígidos y forman una red bien definida (ver figura a continuación).
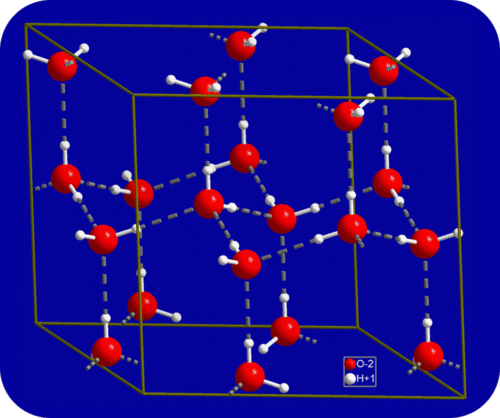
La forma doblada de las moléculas conduce a huecos en la red de enlaces de hidrógeno del hielo. El hielo tiene la propiedad muy inusual de que su estado sólido es menos denso que su estado líquido. Como resultado, el hielo flota en agua líquida. Prácticamente todas las demás sustancias son más densas en estado sólido que en estado líquido. Los enlaces de hidrógeno también juegan un papel biológico muy importante en las estructuras físicas de proteínas y ácidos nucleicos.
Puntos de ebullición y tipos de unión
Para que una sustancia entre en fase gaseosa, sus partículas deben superar completamente las fuerzas intermoleculares que las mantienen unidas. Por lo tanto, una comparación de puntos de ebullición es esencialmente equivalente a comparar las fuerzas de las atractivas fuerzas intermoleculares exhibidas por las moléculas individuales. Para los compuestos moleculares pequeños, las fuerzas de dispersión de Londres son las fuerzas intermoleculares más débiles. Las fuerzas dipolo-dipolo son algo más fuertes, y los enlaces de hidrógeno son una forma particularmente fuerte de interacción dipolo-dipolo. Sin embargo, cuando la masa de una molécula no polar es suficientemente grande, sus fuerzas de dispersión pueden ser más fuertes que las fuerzas dipolo-dipolo en una molécula polar más ligera. Así, no polar\(\ce{Cl_2}\) tiene un punto de ebullición mayor que polar\(\ce{HCl}\).
| Sustancia | Fuerza intermolecular más fuerte | Punto de ebullición\(\left( ^\text{o} \text{C} \right)\) |
|---|---|---|
| \(\ce{H_2}\) | dispersión | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-253 |
| \(\ce{Ne}\) | dispersión | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-246 |
| \(\ce{O_2}\) | dispersión | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-183 |
| \(\ce{Cl_2}\) | dispersión | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-34 |
| \(\ce{HCl}\) | dipolo-dipolo | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-85 |
| \(\ce{HBr}\) | dipolo-dipolo | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-66 |
| \(\ce{H_2S}\) | dipolo-dipolo | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-61 |
| \(\ce{NH_3}\) | enlaces de hidrógeno | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-33 |
| \(\ce{HF}\) | enlaces de hidrógeno | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">20 |
| \(\ce{H_2O}\) | enlaces de hidrógeno | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">100 |
Recursos Suplementarios
- Electronegatividad: www.chemguideco.uk/atoms/bond... elecroneg.html
- Unión Intermolecular - van der Waals Forces: www.chemguidecouk/atoms/bonding/vdw.html
- Enlace intermolecular - Enlaces de hidrógeno: www.chemguide.co.uk/bonding/hbond.html
- Formación de enlaces iónicos: www.dlt.ncssm/edu/core/chapte... icBonding.html
- Formación de enlaces covalentes polares: http://www.dlt.ncssm.edu/core/Chapte...arBonding.html
- Formación de enlaces covalentes no polares: www.dlt.ncssm/edu/core/chapte... ntBonding.html
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)