7.3: Teoría Cinético-Molecular
- Page ID
- 77359
Resultados de aprendizaje
- Definir la presión y describir cómo los gases ejercen presión.
- Convertir entre unidades de presión de gas (\(\text{atm}\)\(\text{mm} \ce{Hg}\),\(\text{torr}\), y\(\text{Pa}\)).
- Relacionar la temperatura con la energía cinética promedio.
- Relacionar la masa con la velocidad molecular.
- Describir el comportamiento de un gas ideal.
La teoría cinético-molecular es una teoría que explica los estados de la materia y se basa en la idea de que la materia está compuesta por partículas diminutas que siempre están en movimiento. La teoría ayuda a explicar las propiedades observables y comportamientos de sólidos, líquidos y gases. Sin embargo, la teoría es más fácil de entender ya que se aplica a los gases. La teoría se aplica específicamente a un modelo de un gas llamado gas ideal. Un gas ideal es un gas imaginario cuyo comportamiento se ajusta perfectamente a todos los supuestos de la teoría cinético-molecular. En realidad, los gases no son ideales, pero están muy cerca de serlo en la mayoría de las condiciones cotidianas.
La teoría cinético-molecular, tal como se aplica a los gases, tiene cinco supuestos básicos.
- Los gases consisten en un gran número de partículas esféricas diminutas que están muy separadas entre sí en comparación con su tamaño. Las partículas de un gas pueden ser átomos o moléculas. La distancia entre las partículas de un gas es mucho, mucho mayor que las distancias entre las partículas de un líquido o un sólido. La mayor parte del volumen de un gas, por lo tanto, está compuesto por el espacio vacío entre las partículas. De hecho, el volumen de las propias partículas se considera insignificante en comparación con el volumen del espacio vacío.
- Las partículas de gas están en constante movimiento rápido en direcciones aleatorias. El rápido movimiento de las partículas de gas les da una cantidad relativamente grande de energía cinética. Recordemos que la energía cinética es la energía que un objeto posee por su movimiento. Las partículas de un gas se mueven en línea recta hasta que chocan con otra partícula o con una de las paredes de su contenedor (ver figura abajo).
- Las colisiones entre partículas de gas y entre partículas y las paredes del contenedor son colisiones elásticas. Una colisión elástica es aquella en la que no hay pérdida general de energía cinética. La energía cinética puede transferirse de una partícula a otra durante una colisión elástica, pero no hay cambio en la energía total de las partículas colisionantes.
- No hay fuerzas de atracción o repulsión entre las partículas de gas. Las fuerzas atractivas son responsables de que las partículas de un gas real se condensen juntas para formar un líquido. Se supone que las partículas de un gas ideal no tienen fuerzas tan atractivas. El movimiento de cada partícula es completamente independiente del movimiento de todas las demás partículas.
- La energía cinética promedio de las partículas de gas depende de la temperatura del gas. A medida que aumenta la temperatura de un gas, sus partículas componentes comienzan a moverse más rápido, resultando en un aumento en sus energías cinéticas. No todas las partículas en una muestra dada tienen la misma velocidad, por lo que la muestra contendrá partículas con un rango de diferentes energías cinéticas. Sin embargo, la energía cinética promedio de las partículas en una muestra es proporcional a su temperatura.

Presión de gas
La presión se define como la fuerza por unidad de área sobre una superficie.
\[\text{Pressure} = \frac{\text{force}}{\text{area}}\]
Cuando una persona se para en el suelo, sus pies ejercen presión sobre la superficie. Esa presión está relacionada tanto con la masa de la persona como con la superficie de sus pies. Si la persona estuviera sosteniendo un objeto pesado, la presión aumentaría debido a una mayor fuerza. Alternativamente, si la persona se pone de puntillas, la presión también aumenta debido a una disminución en la superficie.
Las moléculas de gas también ejercen presión. La atmósfera terrestre ejerce presión porque la gravedad actúa sobre la enorme cantidad de partículas de gas contenidas en la atmósfera, sosteniéndola en su lugar. La presión también es ejercida por pequeñas muestras de gas, como la presión hacia afuera ejercida por el gas dentro de un globo. La presión del gas es la presión que resulta de colisiones de partículas de gas con un objeto. Dentro del globo, las partículas de gas chocan con las paredes internas del globo. Son esas colisiones las que mantienen el globo inflado. Si las partículas de gas dejaran de moverse repentinamente, el globo se desinflaría instantáneamente. La siguiente figura es una ilustración de partículas de gas que ejercen presión dentro de un contenedor.
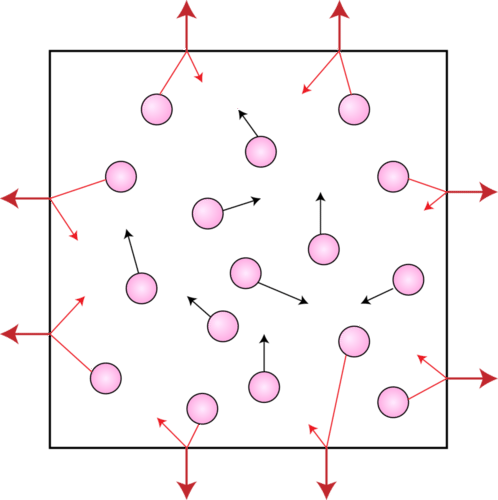
Medición de Presión
La presión atmosférica es la presión ejercida por las partículas de gas en la atmósfera terrestre cuando esas partículas chocan con objetos. Un barómetro es un instrumento utilizado para medir la presión atmosférica. Un barómetro tradicional de mercurio consiste en un tubo evacuado sumergido en un contenedor de mercurio. Las moléculas de aire de la atmósfera empujan hacia abajo sobre la superficie exterior del mercurio, pero, debido a que el interior del tubo es un vacío, no hay un empuje descendente correspondiente sobre el mercurio en el tubo. Como resultado, el mercurio se eleva dentro del tubo. La altura a la que se eleva el mercurio depende de la presión del aire externo.
A nivel del mar, una columna de mercurio se elevará a una distancia de\(760 \: \text{mm}\). Esta presión atmosférica se reporta como\(760 \: \text{mm} \: \ce{Hg}\) (milímetros de mercurio). A mayores altitudes, la presión atmosférica es menor, por lo que la columna de mercurio no subirá tan alta. Por ejemplo, en la cumbre del monte. Everest (a una elevación de\(8848 \: \text{m}\)), la presión del aire es\(253 \: \text{mm} \: \ce{Hg}\). La presión atmosférica también depende ligeramente de las condiciones climáticas.
Un barómetro más conveniente, llamado barómetro aneroide, mide la presión por la expansión y contracción de un pequeño resorte dentro de una cápsula metálica evacuada.
Unidades de Presión de Gas
Un barómetro mide la presión del gas por la altura de la columna de mercurio. Una unidad de presión de gas es el milímetro de mercurio\(\left( \text{mm} \: \ce{Hg} \right)\). Una unidad equivalente a la\(\text{mm} \: \ce{Hg}\) se llama el torr, en honor al inventor del barómetro, Evangelista Torricelli. El pascal\(\left( \text{Pa} \right)\) es la unidad estándar de presión. Un pascal es una cantidad muy pequeña de presión, por lo que una unidad más útil para las presiones diarias de gas es el kilopascal\(\left( \text{kPa} \right)\). Un kilopascal equivale a 1000 pascales. Otra unidad de presión comúnmente utilizada es la atmósfera\(\left( \text{atm} \right)\). La presión atmosférica estándar se llama\(1 \: \text{atm}\) de presión y es igual a\(760 \: \text{mm} \: \ce{Hg}\) y\(101.3 \: \text{kPa}\). A continuación se muestran las relaciones entre las unidades de presión más comunes.
\[1 \: \text{atm} = 760 \: \text{mm} \: \ce{Hg} = 760 \: \text{torr} = 101.3 \: \text{kPa}\]
Ejemplo\(\PageIndex{1}\)
La presión atmosférica en un lugar montañoso se mide para ser\(613 \: \text{mm} \: \ce{Hg}\). ¿Qué es esta presión dentro\(\text{atm}\) y dentro\(\text{kPa}\)?
Solución
Paso 1: Enumere las cantidades conocidas y planifique el problema.
Conocido
- Dado:\(613 \: \text{mm} \: \ce{Hg}\)
- \(1 \: \text{atm} = 760 \: \text{mm} \: \ce{Hg}\)
- \(101.3 \: \text{kPa} = 760 \: \text{mm} \: \ce{Hg}\)
Desconocido
- Presión\(= ? \: \text{atm}\)
- Presión\( = ? \: \text{kPa}\)
Utilice factores de conversión de las unidades de presión equivalentes para convertir de\(\text{mm} \: \ce{Hg}\) a\(\text{atm}\) y de\(\text{mm} \: \ce{Hg}\) a\(\text{kPa}\).
Paso 2: Resolver.
\[613 \: \text{mm} \: \ce{Hg} \times \frac{1 \: \text{atm}}{760 \: \text{mm} \: \ce{Hg}} = 0.807 \: \text{atm} \nonumber\]
\[613 \: \text{mm} \: \ce{Hg} \times \frac{101.3 \: \text{kPa}}{760 \: \text{mm} \: \ce{Hg}} = 81.7 \: \text{kPa} \nonumber\]
Paso 3: Piensa en tu resultado.
La presión del aire es aproximadamente\(80\%\) de la presión atmosférica estándar al nivel del mar. La presión estándar de\(760 \: \text{mm} \: \ce{Hg}\) puede considerarse que tiene tres cifras significativas.
Energía cinética y temperatura
Como se afirma en la teoría cinético-molecular, la temperatura de una sustancia está relacionada con la energía cinética promedio de las partículas de esa sustancia. Cuando se calienta una sustancia, parte de la energía absorbida se almacena dentro de las partículas, mientras que parte de la energía aumenta las velocidades a las que se mueven las partículas. Esto se observa como un aumento en la temperatura de la sustancia.
Energía Cinética Media
A cualquier temperatura dada, no todas las partículas en una muestra de materia tienen la misma energía cinética. En cambio, las partículas muestran una amplia gama de energías cinéticas. La mayoría de las partículas tienen una energía cinética cerca de la mitad del rango. Sin embargo, algunas de las partículas tienen energías cinéticas mucho más bajas o muy superiores a la media (ver figura a continuación).

La curva azul mostrada (ver figura anterior) es para una muestra de materia a una temperatura relativamente baja, mientras que la curva roja es para una muestra a una temperatura relativamente alta. En ambos casos, la mayoría de las partículas tienen energías cinéticas intermedias, cercanas al promedio. Observe que a medida que aumenta la temperatura, aumenta el rango de energías cinéticas y la curva de distribución “se aplana”.
A una temperatura dada, las partículas de cualquier sustancia tienen la misma energía cinética promedio. A temperatura ambiente, las moléculas en una muestra de agua líquida tienen la misma energía cinética promedio que las moléculas en una muestra de gas oxígeno o los iones en una muestra de cloruro de sodio.
Cero Absoluto
A medida que una muestra de materia se enfría continuamente, la energía cinética promedio de sus partículas disminuye. Eventualmente, uno esperaría que las partículas dejaran de moverse por completo. El cero absoluto es la temperatura a la que teóricamente cesa el movimiento de las partículas. Nunca se ha alcanzado el cero absoluto en el laboratorio, pero se\(1 \times 10^{-10} \: \text{K}\) han logrado temperaturas del orden de. La escala de temperatura Kelvin se basa en este límite teórico, por lo que el cero absoluto es igual a\(0 \: \text{K}\). La temperatura Kelvin de una sustancia es directamente proporcional a la energía cinética promedio de las partículas de la sustancia. Por ejemplo, las partículas en una muestra de gas hidrógeno\(200 \: \text{K}\) tienen el doble de la energía cinética promedio que las partículas en una muestra de hidrógeno en\(100 \: \text{K}\).
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

