8.6: El concepto de pH
- Page ID
- 77616
Resultados de aprendizaje
- Calcular entre pH/\(\left[ \ce{H^+} \right]\) y PoH/\(\left[ \ce{OH^-} \right]\)
- Convertir entre pH, PoH, concentración de iones de hidrógeno y concentración de iones de hidróxido para una solución dada.
Auto-ionización del agua
El agua es un compuesto molecular, por lo que no necesariamente puede esperar que se descomponga en iones. Sin embargo, experimentos sensibles muestran que el agua es en realidad un electrolito muy débil. Cuando dos moléculas de agua chocan, puede haber una transferencia de un ion hidrógeno de una molécula a otra. Los productos son un ion hidronio cargado positivamente y un ion hidróxido cargado negativamente.
\[\ce{H_2O} \left( l \right) + \ce{H_2O} \left( l \right) \rightleftharpoons \ce{H_3O^+} \left( aq \right) + \ce{OH^-} \left( aq \right)\]
La autoionización del agua es el proceso en el que el agua se ioniza a iones hidronio e iones hidróxido. Al igual que con otras reacciones ácido-base acuosas, el proceso a menudo se simplifica para mostrar la ionización de una sola molécula de agua en un ión hidrógeno y un ion hidróxido.
\[\ce{H_2O} \left( l \right) \rightleftharpoons \ce{H^+} \left( aq \right) + \ce{OH^-} \left( aq \right)\]
Cualquiera de las dos ecuaciones es adecuada, aunque la primera es más precisa, ya que los iones hidrógeno en solución acuosa siempre estarán unidos a las moléculas de agua. La discusión adicional sobre los ácidos y las ionizaciones ácidas en este libro mostrará principalmente los iones de hidrógeno en solución acuosa como\(\ce{H^+}\), pero tenga en cuenta que esta es solo una abreviatura de uso común para la\(\left( \ce{H_3O^+} \right)\) estructura de hidronio más precisa.
En agua pura, las concentraciones de iones hidrógeno e hidróxido son iguales entre sí. Cualquier solución acuosa en la que\(\left[ \ce{H^+} \right] = \left[ \ce{OH^-} \right]\) se dice que es neutra.
Para cualquier solución neutra en\(25^\text{o} \text{C}\), cada uno de estos iones tiene una concentración de\(1.0 \times 10^{-7} \: \text{M}\).
Una solución ácida es una solución en la que la concentración de iones hidrógeno es mayor que la concentración de iones hidróxido. Por ejemplo, el cloruro de hidrógeno se ioniza para producir\(\ce{H^+}\) e\(\ce{Cl^-}\) iones al disolverse en agua.
\[\ce{HCl} \left( g \right) \rightarrow \ce{H^+} \left( aq \right) + \ce{Cl^-} \left( aq \right)\]
Esto aumenta la concentración de\(\ce{H^+}\) iones en la solución.
Una solución básica es una solución en la que la concentración de iones hidróxido es mayor que la concentración de iones hidrógeno. El hidróxido de potasio sólido se disocia en agua para producir iones de potasio e iones hidróxido.
\[\ce{KOH} \left( s \right) \rightarrow \ce{K^+} \left( aq \right) + \ce{OH^-} \left( aq \right)\]
La Escala de pH
Expresar la acidez de una solución usando la molaridad del ión hidrógeno es engorroso porque las cantidades son generalmente muy pequeñas. El científico danés Søren Sørensen (1868 - 1939) propuso un sistema más fácil para indicar la concentración de la\(\ce{H^+}\) llamada escala de pH. Las letras pH representan el poder del ión hidrógeno. El pH de una solución es el logaritmo negativo de la concentración de iones hidrógeno.
\[\text{pH} = -\text{log} \: \left[ \ce{H^+} \right]\]
En agua pura o una solución neutra\(\left[ \ce{H^+} \right] = 1.0 \times 10^{-7} \: \text{M}\). Sustituyendo este valor en la expresión de pH:
\[\text{pH} = -\text{log} \: \left[ 1.0 \times 10^{-7} \right] = -\left( -7.00 \right) = 7.00\]
El pH del agua pura o cualquier solución neutra es así de 7.00. Debido a las reglas algo menos intuitivas para tratar cifras significativas en el contexto de logaritmos, solo los números a la derecha del punto decimal en el valor de pH son las cifras significativas. Ya que\(1.0 \times 10^{-7}\) tiene dos cifras significativas, el pH puede reportarse como 7.00.
Una escala logarítmica condensa el rango de acidez a números que son fáciles de usar. Por ejemplo, una solución en la que\(\left[ \ce{H^+} \right] = 1.0 \times 10^{-4} \: \text{M}\) tiene una concentración de iones hidrógeno que es 1000 veces mayor que en agua pura. El pH de dicha solución es 4.00, una diferencia de 3 unidades de pH. Observe que cuando\(\left[ \ce{H^+} \right]\) se escribe en notación científica y el coeficiente es 1, el pH es simplemente el exponente con el signo cambiado. El pH de una solución en la que\(\left[ \ce{H^+} \right] = 1.0 \times 10^{-2} \: \text{M}\) es 2.0 y el pH de una solución en la que\(\left[ \ce{H^+} \right] = 1.0 \times 10^{-10} \: \text{M}\) es 10.0. Si el coeficiente no es igual a 1, se debe utilizar una calculadora para encontrar el pH. Por ejemplo, el pH de una solución en la que se\(\left[ \ce{H^+} \right] = 2.3 \times 10^{-5} \: \text{M}\) puede encontrar como se muestra a continuación.
\[\text{pH} = -\text{log} \: \left[ 2.3 \times 10^{-5} \right] = 4.64\]
Como vimos antes, una solución en la que\(\left[ \ce{H^+} \right]\) es superior a la\(1 \times 10^{-7} \: \text{M}\) ácida, mientras que una solución en la que\(\left[ \ce{H^+} \right]\)\(1.0 \times 10^{-7} \: \text{M}\) es inferior a la básica. En consecuencia, las soluciones con valores de pH menores a 7 son ácidas, mientras que las soluciones con valores de pH superiores a 7 son básicas. La siguiente figura ilustra esta relación, junto con algunos ejemplos del pH para diversas soluciones.

La escala de pH se presenta generalmente como que va de 0 a 14, aunque es posible tener un pH menor que 0 o mayor que 14. Por ejemplo, un altamente concentrado\(3.0 \: \text{M}\) de\(\ce{HCl}\) tiene un pH negativo.
\[\text{pH} = -\text{log} \left( 3.0 \right) = -0.48\]
Cuando se conoce el pH de una solución, se puede calcular la concentración del ión hidrógeno. La inversa del logaritmo (o antilog) es la\(10^x\) clave en una calculadora.
\[\left[ \ce{H^+} \right] = 10^{-\text{pH}}\]
Por ejemplo, supongamos que tiene una solución con un pH de 9.14. \(\left[ \ce{H^+} \right]\)c a encontrarse de la siguiente manera:
\[\left[ \ce{H^+} \right] = 10^{-\text{pH}} = 10^{-9.14} = 7.24 \times 10^{-10} \: \text{M}\]
El Concepto PoH
Al igual que con la concentración de iones hidrógeno, la concentración del ión hidróxido puede ser expresada logarítmicamente por el PoH. El pOH de una solución es el logaritmo negativo de la concentración de iones hidróxidos.
\[\text{pOH} = -\text{log} \: \left[ \ce{OH^-} \right]\]
El pH de una solución puede estar relacionado con el PoH. Considera una solución con pH\(=\) 4.0. El PoH de la solución sería 10. Este ejemplo ilustra la siguiente relación. Esto es resultado de la concentración de los\(\ce{OH^-}\) iones\(\ce{H^+}\) y presentes en el agua pura que no vamos a discutir más a fondo.
\[\text{pH} + \text{pOH} = 14\]
La escala de PoH es similar a la escala de pH, en que un PoH de 7 es indicativo de una solución neutra. Una solución básica tiene un PoH de menos de 7, mientras que una solución ácida tiene un PoH superior a 7. El PoH es conveniente de usar cuando se encuentra la concentración de iones hidróxido a partir de una solución con un pH conocido.
Ejemplo\(\PageIndex{1}\)
Encuentra la concentración de hidróxido de una solución con un pH de 4.42.
Solución
Paso 1: Enumere los valores conocidos y planifique el problema.
Conocido
- pH\(=\) 4.42
- pH\(+\) PoH\(=\) 14
Desconocido
- \(\left[ \ce{OH^-} \right]\)
En primer lugar, se calcula el PoH, seguido del\(\left[ \ce{OH^-} \right]\)
Paso 2: Resolver.
\[\text{pOH} = 14 - \text{pH} = 14 - 4.42 = 9.58\]
\[\left[ \ce{OH^-} \right] = 10^{-\text{pOH}} = 10^{-9.58} = 2.6 \times 10^{-10} \: \text{M}\]
Paso 3: Piensa en tu resultado.
El pH es el de una solución ácida, y la concentración resultante de iones hidróxidos es menor que\(1 \times 10^{-7} \: \text{M}\). La respuesta tiene dos cifras significativas porque el pH dado tiene dos decimales.
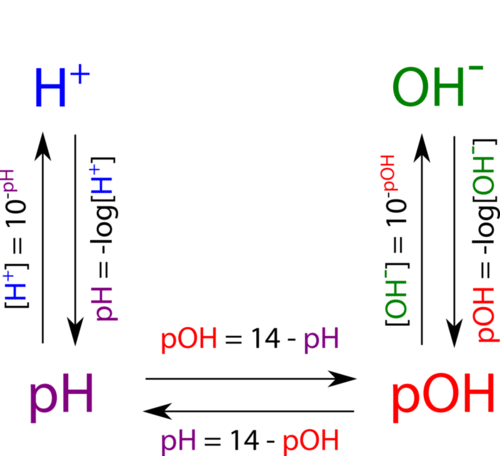
El siguiente diagrama muestra todas las interrelaciones entre\(\left[ \ce{H^+} \right]\),\(\left[ \ce{OH^-} \right]\), pH, y PoH.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

