12.1: Reacciones Orgánicas
- Page ID
- 77421
Resultados de aprendizaje
- Identificar y describir reacciones de sustitución, eliminación, adición, hidrólisis y condensación.
- Predecir productos de cada tipo de reacción.
- Predecir productos de reacciones de hidratación basados en la regla de Markovnikov.
- Explicar por qué las reacciones de condensación también se llaman reacciones de deshidratación.
- Definir “polímero”.
Las reacciones orgánicas requieren la ruptura de fuertes enlaces covalentes, lo que requiere un aporte considerable de energía. Para que las moléculas orgánicas relativamente estables reaccionen a una velocidad razonable, a menudo deben modificarse con el uso de materiales altamente reactivos o en presencia de un catalizador. En esta lección, aprenderá sobre varias categorías generales de reacciones orgánicas.
Reacciones de sustitución
Una reacción de sustitución, que es lo mismo que una sola reacción de reemplazo en reacciones inorgánicas, es una reacción en la que uno o más átomos en una molécula son reemplazados por otro átomo o grupo de átomos. Los haluros de alquilo se forman mediante la sustitución de un átomo de halógeno por un átomo de hidrógeno. Cuando el metano reacciona con el gas cloro, la luz ultravioleta puede actuar como catalizador para la reacción.
\[\ce{CH_4} \left( g \right) + \ce{Cl_2} \left( g \right) \overset{\text{UV light}}{\rightarrow} \ce{CH_3Cl} \left( g \right) + \ce{HCl} \left( g \right)\]
La reacción produce clorometano y cloruro de hidrógeno. Cuando se permite que la mezcla reaccione por periodos de tiempo más largos, pueden ocurrir reacciones de sustitución adicionales.
\[\ce{CH_3Cl} \left( g \right) + \ce{Cl_2} \left( g \right) \overset{\text{UV light}}{\rightarrow} \ce{CH_2Cl_2} \left( g \right) + \ce{HCl} \left( g \right)\]
El producto anterior es diclorometano. Otros productos de sustitución triclorometano y tetraclorometano, comúnmente llamados tetracloruro de carbono. Se produce una mezcla de productos en la reacción, con las cantidades relativas dependientes del tiempo en que se deja que transcurra la reacción. Los clorofluorocarbonos se producen haciendo reaccionar cloroalcanos con\(\ce{HF}\), porque el átomo de flúor hace un enlace más fuerte con el átomo de carbono que el cloro.
\[\ce{CCl_4} \left( g \right) + \ce{HF} \left( g \right) \overset{\ce{SbF_5}}{\rightarrow} \ce{CCl_3F} \left( g \right) + \ce{HCl} \left( g \right)\]
El átomo de flúor sustituye a un átomo de cloro en la reacción.
Reacciones de eliminación
Una reacción de eliminación implica la eliminación de átomos adyacentes de una molécula. Esto da como resultado la formación de un enlace múltiple y la liberación de una molécula pequeña, por lo que se denominan reacciones de eliminación. Tienen la forma general

Un ejemplo típico es la conversión de cloruro de etilo en etileno:
\[CH_3CH_2Cl \rightarrow CH_2=CH_2 + HCl \]
Gran parte de los aproximadamente 26 millones de toneladas de etileno que se producen al año en Estados Unidos se utilizan para sintetizar plásticos, como el polietileno. En la reacción anterior, la molécula A—B eliminada es HCl, cuyos componentes se eliminan como H + del átomo de carbono de la izquierda y Cl − del carbono de la derecha. Cuando se produce un ácido, como ocurre aquí, la reacción generalmente se lleva a cabo en presencia de una base (como NaOH) para neutralizar el ácido. Otras reacciones de eliminación producirán H 2, X 2 (donde X = halógeno), o H 2 O. Estas reacciones suelen ser referidas por términos más descriptivos como deshidrogenación (eliminación de hidrógeno) o descloración (eliminación de cloro).
Reacciones de adición
Una reacción de adición es una reacción en la que se agrega un átomo o molécula a una molécula insaturada, haciendo un solo producto. Una reacción de adición a menudo se puede considerar como la adición de una molécula a través del doble enlace de un alqueno o a través del triple enlace de un alquino. Sabiendo que “ación” significa agregar, los nombres específicos de estas reacciones, como hidrogenación, hidratación o cloración, deberían tener sentido. Obsérvese que la hidrogenación (añadiendo H 2) y la hidratación (añadiendo H 2 O) son procesos muy diferentes.
Un tipo de reacción de adición se llama hidrogenación. La hidrogenación es una reacción que ocurre cuando se agrega hidrógeno molecular a un alqueno para producir un alcano o se agrega hidrógeno a un alquino para producir un alqueno o alcano. La reacción se realiza típicamente con el uso de un catalizador de metal de transición. Por ejemplo, el eteno reacciona con hidrógeno para formar etano.
\[\ce{CH_2=CH_2} \left( g \right) + \ce{H_2} \left( g \right) \overset{\ce{Pt}}{\rightarrow} \ce{CH_3CH_3} \left( g \right)\]
Obsérvese que la reacción de hidrogenación también es una reacción redox. El eteno se reduce, debido a que los números de oxidación de los átomos de carbono cambian de\(-2\) a\(-3\) como resultado de la reacción.
Los aceites vegetales consisten en cadenas largas de carbono con grupos carboxilo en el extremo; estas moléculas se denominan ácidos grasos. Las cadenas de carbono de los ácidos grasos en los aceites vegetales son insaturadas, generalmente contienen múltiples dobles enlaces. Cuando se sopla gas hidrógeno a través de una muestra del petróleo, los átomos de hidrógeno se suman a través de los dobles enlaces. Esta conversión cambia la sustancia de un aceite líquido a una grasa sólida. El “hidrogenado” en un producto alimenticio es una indicación de que el aceite (líquido) se ha convertido en grasa (sólida) por este proceso. La margarina se elabora a partir de aceite vegetal insaturado de esta manera hidrogenando algunos de los dobles enlaces convirtiéndola en un “aceite vegetal parcialmente hidrogenado”.
Las reacciones de adición también son formas útiles para introducir un nuevo grupo funcional en una molécula orgánica. Los haluros de alquilo se pueden producir a partir de un alqueno mediante la adición del halógeno elemental o el haluro de hidrógeno. Un haluro de alquilo monosustituido se puede producir mediante la adición de un haluro de hidrógeno a un alqueno. A continuación se muestra la formación de cloroetano.
\[\ce{CH_2=CH_2} \left( g \right) + \ce{HCl} \left( g \right) \rightarrow \ce{CH_3CH_2Cl} \left( g \right)\]
Cuando el reactivo es el halógeno diatómico, el producto es un haluro de alquilo disustituido como en la adición de bromo al eteno.
\[\ce{CH_2=CH_2} \left( g \right) + \ce{Br_2} \left( l \right) \rightarrow \ce{CH_2BrCH_2Br} \left( g \right)\]
La adición de bromo a un compuesto orgánico desconocido se puede utilizar como prueba de insaturación en el compuesto. El bromo tiene un distintivo color anaranjado pardusco, mientras que la mayoría de los bromoalcanos son incoloros. Cuando el bromo se agrega lentamente a una solución del compuesto, el color naranja se desvanecerá si experimenta una reacción de adición para producir un haluro de alquilo. Si el color naranja permanece, entonces el compuesto original ya estaba saturado, y no se produjo ninguna reacción.
Una reacción de hidratación es una reacción en la que se agrega agua a un alqueno. Las reacciones de hidratación pueden tener lugar cuando el alqueno y el agua se calientan hasta cerca\(100^\text{o} \text{C}\) en presencia de un ácido fuerte, que actúa como catalizador. A continuación se muestra la hidratación del eteno para producir etanol.
\[\ce{CH_2=CH_2} \left( g \right) + \ce{H_2O} \left( l \right) \rightarrow \ce{CH_3CH_2OH} \left( g \right)\]
A diferencia de las reacciones de adición que implican\(\ce{H_2}\) o\(\ce{Br_2}\), la adición de agua puede tener dos productos posibles porque a\(\ce{-H}\) y\(\ce{-OH}\) se están agregando a los carbonos en el doble enlace. La regla de Markovnikov ayuda a predecir el producto principal en una reacción de hidratación. La regla establece que el átomo de hidrógeno del agua se sumará al carbono que originalmente tenía más átomos de hidrógeno. Por ejemplo, mira la hidratación del 1-buteno.
Nótese que el primer carbono en 1-buteno comenzó con dos átomos de hidrógeno y el segundo carbono comenzó con un hidrógeno. Por lo tanto, el hidrógeno del agua se suma al primer carbono y el\(\ce{-OH}\) grupo se suma al segundo carbono. Cuando hay números iguales de átomos de hidrógeno en ambos carbonos en un doble enlace entonces los dos productos se formarán en cantidades aproximadamente iguales. Por ejemplo, la hidratación del 2-penteno da como resultado dos productos. En el primer producto, el\(\ce{-OH}\) grupo está en el tercer carbono y en el segundo producto, el\(\ce{-OH}\) grupo está en el segundo carbono. Si bien estas dos moléculas tendrán propiedades similares, habrá diferencias.
Reacciones de condensación
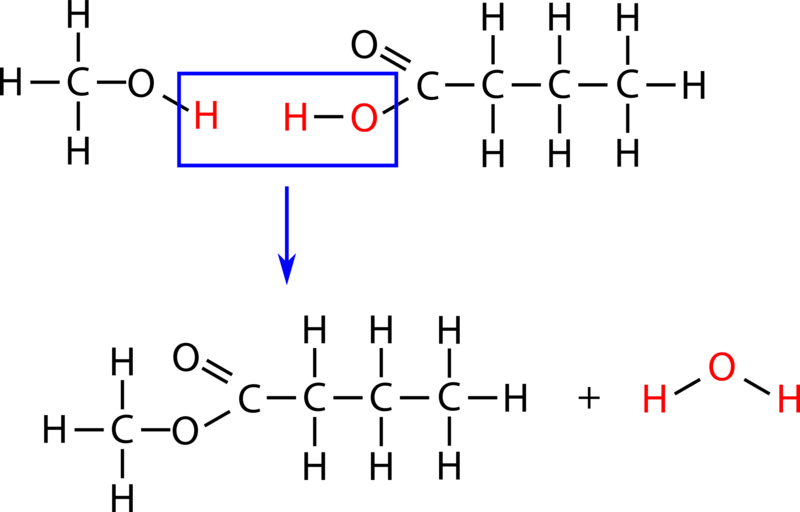
Una reacción de condensación es una reacción en la que dos moléculas se combinan para formar una sola molécula. Una molécula pequeña, a menudo agua, generalmente se elimina durante una reacción de condensación. Los aminoácidos son moléculas biológicas importantes que tienen un grupo funcional amina en un extremo de la molécula y un grupo funcional ácido carboxílico en el otro extremo. Cuando dos aminoácidos se combinan en una reacción de condensación, se forma un enlace covalente entre el nitrógeno amínico de un aminoácido y el carbono carboxilo del segundo aminoácido. Luego se retira una molécula de agua como segundo producto (ver figura a continuación).

Esta reacción forma una molécula llamada dipéptido, y el enlace covalente carbono-nitrógeno resultante a menudo se denomina enlace peptídico. Cuando se repite numerosas veces, finalmente se produce una molécula larga llamada proteína.
Una esterificación es una reacción de condensación en la que se forma un éster a partir de un alcohol y un ácido carboxílico. La esterificación es una subcategoría de reacciones de condensación porque en la reacción se produce una molécula de agua. La reacción puede ser catalizada por un ácido fuerte, generalmente ácido sulfúrico. Cuando el ácido carboxílico, ácido butanoico, se calienta con un exceso de metanol y unas gotas de ácido sulfúrico, se produce el éster metil butanoato. El butanoato de metilo tiene el aroma de las piñas. La reacción se muestra a continuación con fórmulas moleculares y estructurales. Las reacciones de esterificación son reversibles.
\[\ce{CH_3CH_2CH_2COOH} + \ce{HOCH_3} \overset{\ce{H_2SO_4}}{\rightarrow} \ce{CH_3CH_2CH_2COOCH_3} + \ce{H_2O}\]
La saponificación describe la reacción de hidrólisis alcalina de un éster. El término saponificación originalmente describió la hidrólisis de ésteres de cadena larga llamados ésteres de ácidos grasos para producir moléculas de jabón, que son las sales de ácidos grasos. Una de esas moléculas de jabón es el estearato de sodio, formado a partir de la hidrólisis del estearato de etilo.
\[\begin{array}{ccccccc} \ce{C_{17}H_{35}COOC_2H_5} & + & \ce{NaOH} & \rightarrow & \ce{C_{17}H_{35}COO^-Na^+} & + & \ce{C_2H_5OH} \\ \text{ethyl stearate} & & & & \text{sodium stearate (soap)} & & \end{array}\]
Reacciones de hidrólisis
La hidrólisis es el reverso de la condensación. “Hydro” indica que el agua está involucrada y “lisis” significa romperse. En una reacción de hidrólisis, se agrega agua y la molécula se rompe, generalmente en un\(\ce{C-O-C}\) enlace.
Polimación
Los polímeros son muy diferentes a los otros tipos de moléculas orgánicas que has visto hasta ahora. Mientras que otros compuestos son de masa molar relativamente baja, los polímeros son moléculas gigantes de masa molar muy alta. Los polímeros son los componentes principales de todo tipo de plásticos y compuestos relacionados. Un polímero es una molécula grande formada por muchas moléculas más pequeñas unidas covalentemente entre sí en un patrón repetitivo. Las pequeñas moléculas que componen el polímero se llaman monómeros. Los polímeros se forman generalmente por reacciones de adición o condensación. El teflón (ver figura abajo) es un recubrimiento no reactivo y antiadherente que se utiliza en utensilios de cocina, así como en contenedores y tuberías para productos químicos reactivos o corrosivos.

Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)