8.6: Ley de Carlos- La relación entre volumen y temperatura
- Page ID
- 73320
Mientras que la Ley de Boyle explora el efecto de la presión sobre el volumen de un gas, la Ley de Charles examina el efecto de la temperatura. De nuevo probablemente estés familiarizado con el hecho de que aumentar la temperatura de un gas provocará que el gas se expanda. Este efecto fue estudiado cuantitativamente por primera vez en 1787 por Jacques Charles (1746 a 1823) de Francia. Los datos típicos de dicho experimento se dan en la Tabla\(\PageIndex{1}\). Se puede ver que para 0.0466 mol H 2 (g) a presión constante, un aumento de temperatura de 50°C produce un aumento de volumen de 0.18 litros, ya sea que la temperatura aumente de 0.0 a 50.0° o de 100.0 a 150.0°C.Si bien este experimento muestra que la temperatura y el volumen están interrelacionados, también tiene implicaciones más profundas y significativas.
TABLA\(\PageIndex{1}\) Variación en el Volumen de H 2 (g) con Temperatura.
| Temperatura (grado C) | Volumen (L) |
|---|---|
| Datos para 0.0446 mol H 2 (g) a 1 atm (101.3 kPa) | |
| 0.0 | 1.00 |
| 50.0 | 1.18 |
| 100.0 | 1.37 |
| 150.0 | 1.55 |
| Datos para 0.100 mol H 2 (g) 1 atm (101.3 kPa) | |
| 0.0 | 2.24 |
| 50.0 | 2.65 |
| 100.0 | 3.06 |
| 150.0 | 3.47 |
La Escala de Temperatura Kelvin y el Cero Absoluto
Cuando se\(\PageIndex{1}\) grafican los datos experimentales de la Tabla, se obtiene la Figura\(\PageIndex{1}\). Observe que los cuatro puntos correspondientes a 0.0446 mol H 2 (g) se encuentran en línea recta, al igual que los puntos para 0.100 mol H 2 (g). Si las líneas son extrapoladas (extendidas más allá de los puntos experimentales) a temperaturas muy bajas, encontramos que ambas se cruzan con el eje horizontal a —273°C.El comportamiento de H 2 (g) (y de muchos otros gases) a temperaturas normales sugiere que si se enfriar un gas suficientemente, su volumen se convertirá en cero a —273°C.
Por supuesto que una sustancia real se condensaría en un líquido y se congelaría a un sólido a medida que se enfriaba. Cuando la presión es de 1.00 atm (101.3 kPa), H 2 (g) se licua a —253°C y se congela a —259°C, por lo que todos los experimentos que involucran tendrían que realizarse por encima de —253°C. Si pudiéramos encontrar un gas que no se condense, sin embargo, sería imposible enfriarlo por debajo de —273°C, porque a esa temperatura su volumen sería cero. Ir a una temperatura más baja correspondería a un volumen negativo, algo que es muy difícil de concebir. Por lo tanto —273°C se conoce como el cero absoluto de temperatura, es imposible ir más bajo.
En la Figura\(\PageIndex{1}\) b el cero del eje de temperatura se ha desplazado a cero absoluto. La escala de temperatura utilizada en esta gráfica se denomina temperatura absoluta o termodinámica. Se mide en unidades SI llamadas K elvins (abreviado K), en honor al físico inglés William Thomson, Lord Kelvin (1824 a 1907).
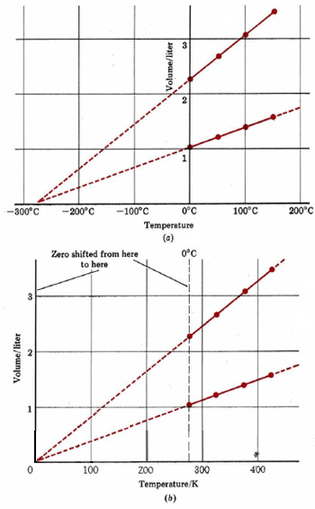
El intervalo de temperatura 1 K corresponde a un cambio de 1°C, pero cero en la escala termodinámica es (0 K) es —273.15°C. El punto de congelación del agua a 1.00 atm (101.3 kPa) de presión es de 273.15 K. Al cambiar a la escala de temperatura absoluta, hemos simplificado la gráfica de volumen de gas versus temperatura.
Ley de Carlos
La Figura 1 b muestra que el volumen de un gas es directamente proporcional a su temperatura termodinámica, siempre que la cantidad de gas y la presión permanezcan constantes. Esto se conoce como ley de Charles, y se puede expresar matemáticamente como donde T representa la temperatura absoluta (generalmente medida en Kelvins).
\[V \propto T \nonumber \]Como en el caso de las leyes de gas anteriores, podemos introducir una constante de proporcionalidad, en este caso, k C:\[V=k_{\text{C}}T\text{ or }\frac{V}{T}=k_{\text{C}}\text{ (2)} \nonumber \]
Como recurso adicional, el Consorcio Concord cuenta con una herramienta que permite cambiar la temperatura de un gas en un contenedor y observar el cambio de volumen resultante. Esta herramienta puede ayudar a cimentar su comprensión de la Ley de Carlos y la relación entre volumen y temperatura: Charles' Law Interactive.
Una muestra de H 2 (g) ocupa un volumen de 69.37 cm³ a una presión de exactamente 1 atm cuando se sumerge en una mezcla de hielo y agua. Cuando el gas (a la misma presión) se sumerge en benceno hirviendo, su volumen se expande a 89.71 cm 3. ¿Cuál es el punto de ebullición del benceno?
Solución Como en el caso de la ley de Boyle, son posibles dos métodos de solución.
a) Álgebraicamente, tenemos, a partir de la Ec. (2),\(\frac{V_{\text{1}}}{T_{\text{1}}}=k_{\text{C}}=\frac{V_{\text{2}}}{T_{\text{2}}}\) y sustituyendo en la ecuación\(T_{\text{2}}=\frac{V_{\text{2}}T_{\text{1}}}{V_{\text{1}}}=\frac{\text{89}\text{.71 cm}^{\text{3}}\text{ }\times \text{ 273}\text{.15 K}}{\text{69}\text{.37 cm}^{\text{3}}}=\text{353}\text{.2 K}\) arroja el resultado deseado. (La mezcla de hielo-agua debe estar a 273.15 K, el punto de congelación del agua.) b) Por sentido común argumentamos que desde que el gas se expandió, su temperatura debió haber aumentado. Así\(T_{\text{2}}=\text{273}\text{.15 K }\times \text{ ration greater than 1}=\text{273}\text{.15 K }\times \text{ }\frac{\text{89}\text{.71 cm}^{\text{3}}}{\text{69}\text{.37 cm}^{\text{3}}}=\text{353}\text{.2 K}\) Nota: En este ejemplo hemos utilizado la expansión de un gas en lugar de la expansión de mercurio líquido para medir la temperatura.

