8.6: Tendencias Periódicas
- Page ID
- 74891
- Ser capaz de exponer cómo varían ciertas propiedades de los átomos en función de su posición relativa en la tabla periódica.
Una razón por la que la tabla periódica es tan útil es que su estructura nos permite determinar cualitativamente cómo varían algunas propiedades de los elementos según su posición en la tabla periódica. Las variaciones de propiedades según posiciones en la tabla periódica se denominan tendencias periódicas. No hay otra herramienta en la ciencia que nos permita juzgar las propiedades relativas de una clase de objetos como esta, lo que hace de la tabla periódica una herramienta muy útil. Muchas tendencias periódicas son generales. Puede haber algunos puntos donde se vea una tendencia opuesta, pero hay una tendencia general cuando se considera a lo largo de toda una fila, o a la baja de una columna completa de la tabla periódica.
La primera tendencia periódica que consideraremos es el radio atómico. El radio atómico es una indicación del tamaño de un átomo. Aunque el concepto de un radio definido de un átomo es un poco borroso, los átomos se comportan como si tuvieran cierto radio. Dichos radios pueden estimarse a partir de diversas técnicas experimentales, como la cristalografía de rayos X de cristales.
A medida que baja una columna de la tabla periódica, los radios atómicos aumentan. Esto se debe a que la capa de electrones de valencia es cada vez más grande y hay un mayor número cuántico principal, por lo que la capa de valencia se encuentra físicamente más lejos del núcleo. Esta tendencia se puede resumir de la siguiente manera:
\[as\downarrow PT,atomic\; radius \uparrow\nonumber \]
donde PT significa tabla periódica. Al cruzar una fila en la tabla periódica, de izquierda a derecha, la tendencia es diferente. Esto se debe a que aunque el proyectil de valencia mantiene el mismo número cuántico principal, el número de protones —y de ahí la carga nuclear— va aumentando a medida que cruzas la fila. La carga positiva creciente arroja un agarre más firme sobre los electrones de valencia, así que a medida que atraviesas la tabla periódica, los radios atómicos disminuyen. Nuevamente, podemos resumir esta tendencia de la siguiente manera:
\[as\rightarrow PT,atomic\; radius \downarrow\nonumber \]
La figura\(\PageIndex{1}\) muestra esferas que representan los átomos de los bloques s y p de la tabla periódica a escala, mostrando las dos tendencias para el radio atómico.
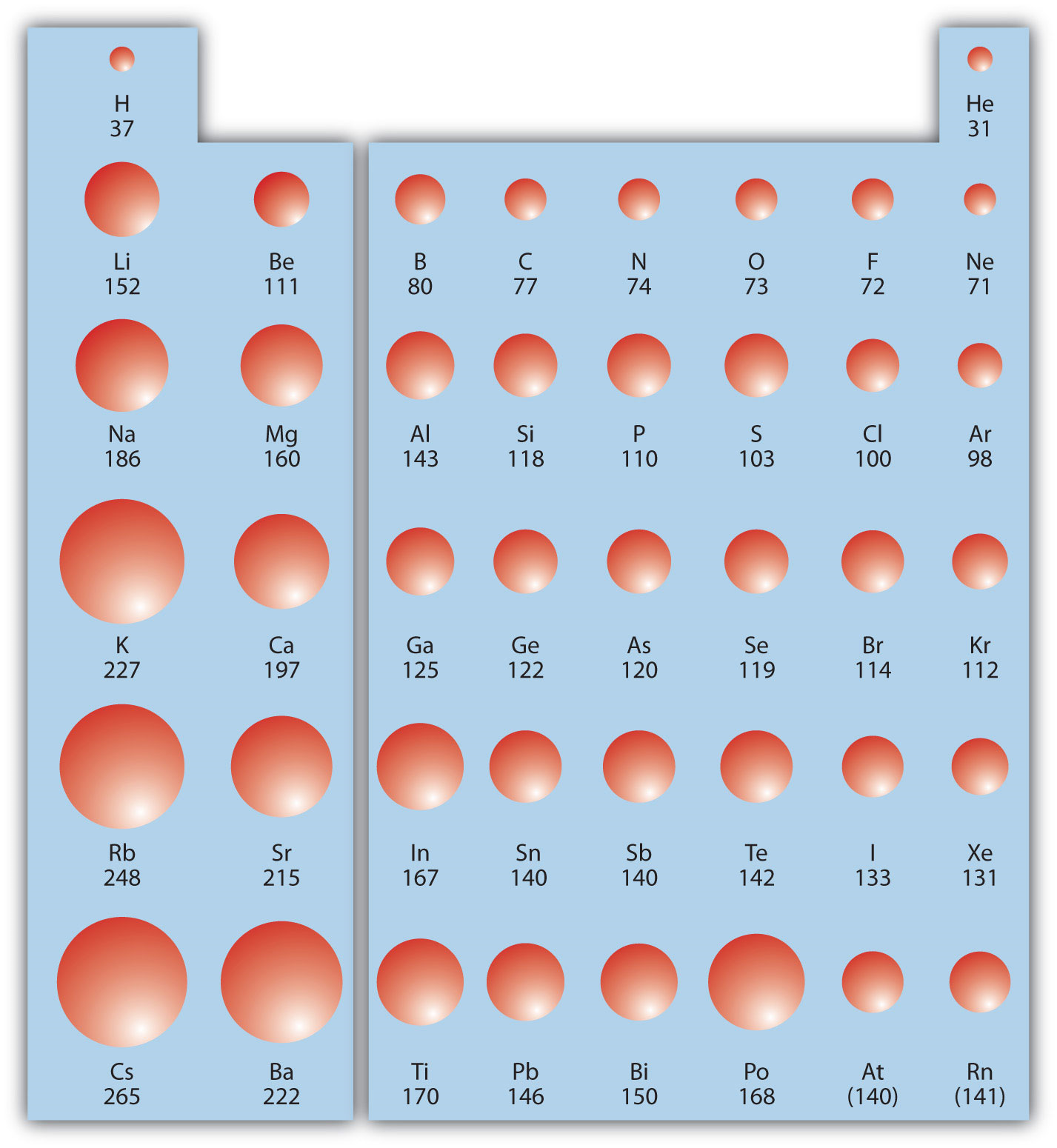
Refiriéndose únicamente a una tabla periódica y no a Figura\(\PageIndex{1}\), ¿qué átomo es mayor en cada par?
- Si o S
- S o Te
Solución
- Si está a la izquierda de S en la tabla periódica, por lo que es más grande porque a medida que cruzas la fila, los átomos se hacen más pequeños.
- S está por encima de Te en la tabla periódica, por lo que Te es más grande porque a medida que bajas por la columna, los átomos se hacen más grandes.
Refiriéndose únicamente a una tabla periódica y no a Figura\(\PageIndex{1}\), ¿qué átomo es más pequeño, Ca o Br?
Contestar
Br
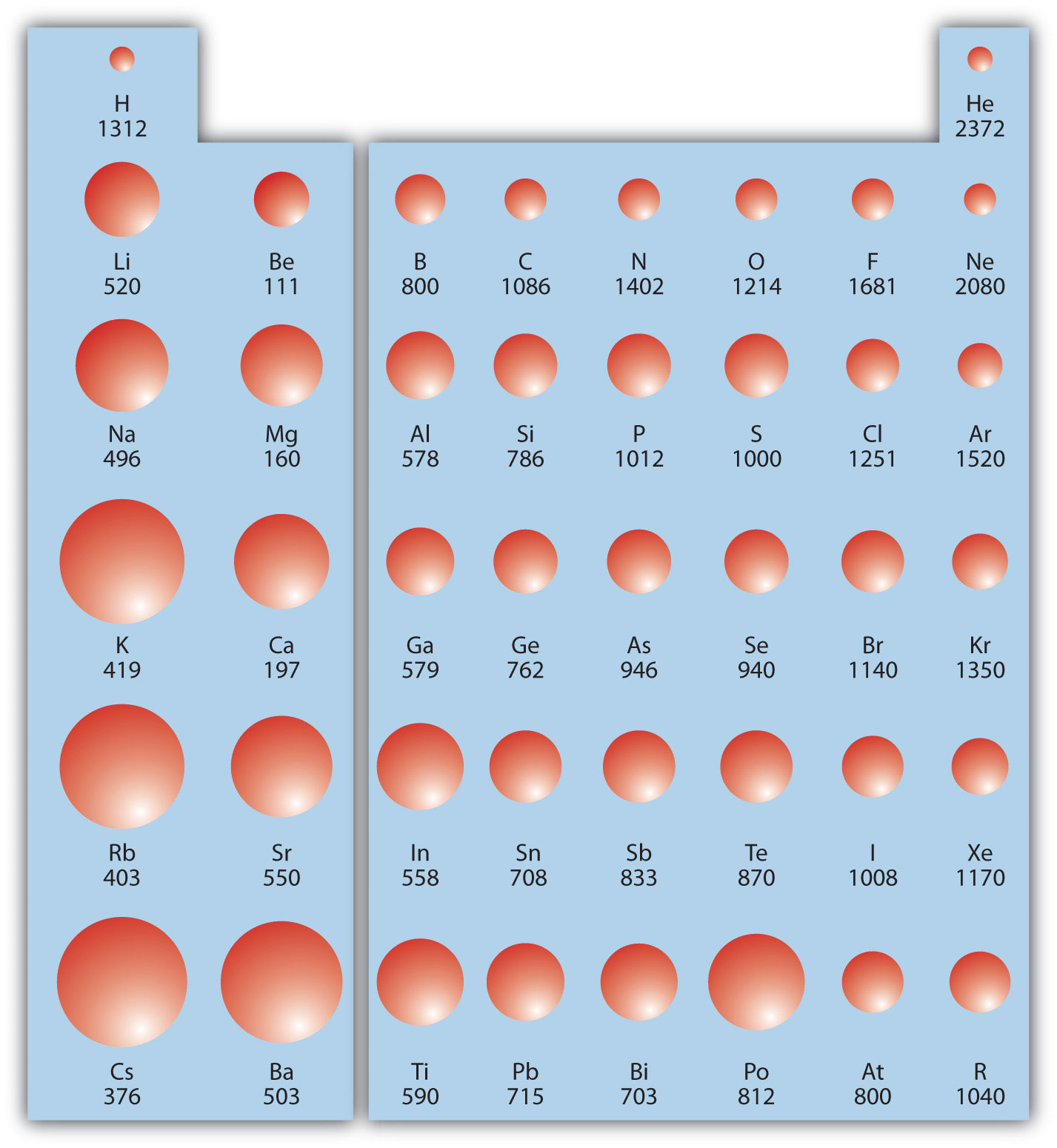
La energía de ionización (IE) es la cantidad de energía requerida para eliminar un electrón de un átomo en la fase gaseosa:
\[A(g)\rightarrow A^{+}(g)+e^{-}\; \; \; \; \; \Delta H\equiv IE\nonumber \]
El IE se expresa generalmente en kJ/mol de átomos. Siempre es positivo porque la eliminación de un electrón siempre requiere que se ponga energía (es decir, es endotérmica). IE también muestra tendencias periódicas. A medida que baja por la tabla periódica, se vuelve más fácil eliminar un electrón de un átomo (es decir, IE disminuye) porque el electrón de valencia está más lejos del núcleo. Por lo tanto,
\[as\downarrow PT,\; IE\downarrow\nonumber \]
Sin embargo, a medida que cruzas la tabla periódica y los electrones se acercan más, se necesita más energía para eliminar un electrón. Como resultado, IE aumenta:
\[as\rightarrow PT,\; IE\uparrow\nonumber \]
La figura\(\PageIndex{2}\) muestra los valores de IE versus posición en la tabla periódica. Nuevamente, la tendencia no es absoluta, pero las tendencias generales que van a través y hacia abajo de la tabla periódica deberían ser obvias.
IE también muestra una tendencia interesante dentro de un átomo dado. Esto se debe a que se puede definir más de un IE eliminando electrones sucesivos (si el átomo los tiene para empezar):
- Primera Energía de Ionización (IE 1):
\[A(g) → A^+(g) + e^-\nonumber \]
- Segunda Energía de Ionización (IE 2):
\[A^{+}(g) → A^{2+}(g) + e^-\nonumber \]
- Tercera Energía de Ionización (IE 3):
\[A^{2+}(g) → A^{3+}(g) + e^-\nonumber \]
y así sucesivamente.
Cada IE sucesivo es mayor que el anterior porque se está eliminando un electrón de un átomo con una carga positiva progresivamente mayor. Sin embargo, IE da un gran salto cuando una ionización sucesiva baja a un nuevo caparazón. Por ejemplo, los siguientes son los tres primeros IE para Mg, cuya configuración electrónica es 1 s 2 2 s 2 2 p 6 3 s 2:
Primera Energía de Ionización (IE 1) = 738 kJ/mol:
\[Mg(g) → Mg^{+}(g) + e^−\nonumber \]
Segunda Energía de Ionización (IE 2) = 1,450 kJ/mol:
\[Mg^+(g) → Mg^{2+}(g) + e^−\nonumber \]
Tercera Energía de Ionización (IE 3) = 7,734 kJ/mol:
\[Mg^{2+}(g) → Mg^{3+}(g) + e^− \nonumber \]
El segundo IE es dos veces el primero, lo que no es una sorpresa: el primer IE implica eliminar un electrón de un átomo neutro, mientras que el segundo implica eliminar un electrón de un ion positivo. El tercer IE, sin embargo, es más de cinco veces el anterior. ¿Por qué es mucho más grande? Debido a que los dos primeros electrones se eliminan de la subcapa de 3 s, pero el tercer electrón tiene que ser eliminado de la cáscara n = 2 (específicamente, la subcapa 2 p, que es menor en energía que la capa n = 3). Por lo tanto, se necesita mucha más energía de lo que sugeriría solo superar una carga iónica más grande. Tendencias como esta demuestran que los electrones dentro de los átomos están organizados en grupos.
¿Qué átomo de cada par tiene la mayor energía de ionización de la primera?
- Ca o Sr
- K o K +
Solución
- Debido a que Sr está por debajo de Ca en la tabla periódica, es más fácil eliminar un electrón de ella; así, Ca tiene el IE más alto.
- Debido a que K + tiene una carga positiva, será más difícil eliminar otro electrón de él, por lo que su IE es mayor que el de K. Efectivamente, será significativamente mayor porque el siguiente electrón en K + que se eliminará proviene de otra concha.
¿Qué átomo tiene la menor energía de ionización, C o F?
Contestar
C
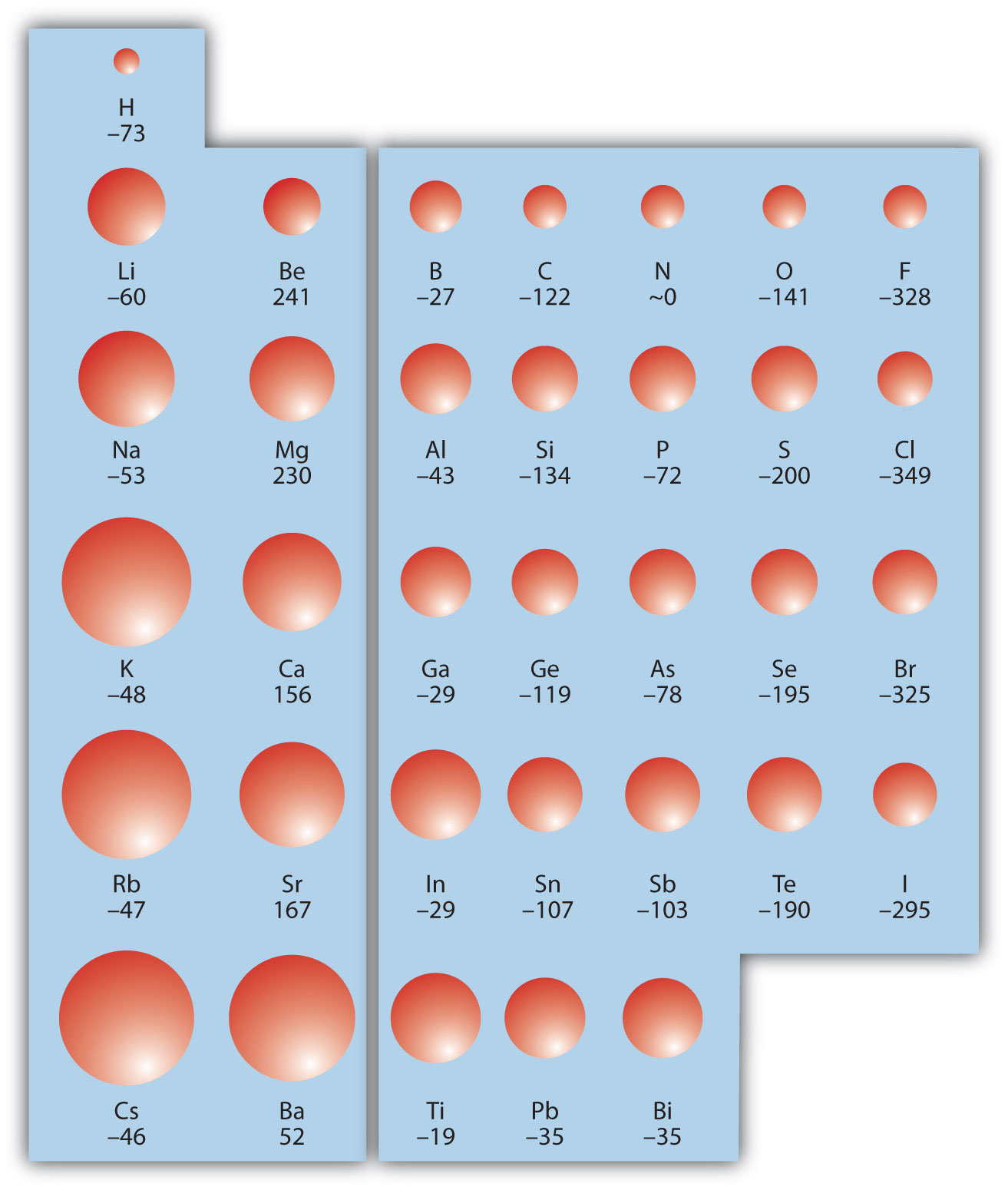
Lo contrario de IE se describe por afinidad electrónica (EA), que es el cambio de energía cuando un átomo en fase gaseosa acepta un electrón:
\[A(g)+e^{-}\rightarrow A^{-}(g)\; \; \; \; \; \Delta H\equiv EA\nonumber \]
La EA también se expresa generalmente en kJ/mol. EA también demuestra algunas tendencias periódicas, aunque son menos obvias que las otras tendencias periódicas discutidas anteriormente. Generalmente, a medida que recorres la tabla periódica, EA aumenta su magnitud:
\[as\rightarrow PT,\; EA\uparrow\nonumber \]
No hay una tendencia definitiva a medida que vas bajando por la tabla periódica; a veces la EA aumenta, a veces disminuye. La figura\(\PageIndex{3}\) muestra los valores de EA versus posición en la tabla periódica para los elementos s - y p -block. La tendencia no es absoluta, sobre todo considerando los grandes valores positivos de EA para la segunda columna. No obstante, la tendencia general que pasa por la tabla periódica debería ser obvia.
Predecir qué átomo de cada par tendrá la mayor magnitud de Afinidad de Electrones.
- C o F
- Na o S
Solución
- C y F están en la misma fila en la tabla periódica, pero F está más a la derecha. Por lo tanto, F debería tener la mayor magnitud de EA.
- Na y S están en la misma fila en la tabla periódica, pero S está más a la derecha. Por lo tanto, S debería tener la mayor magnitud de EA.
Predecir qué átomo tendrá la mayor magnitud de Afinidad Electrónica: As o Br.
Contestar
Br
Resumen
Ciertas propiedades —como el radio atómico, las energías de ionización y las afinidades electrónicas — pueden ser entendidas cualitativamente por las posiciones de los elementos en la tabla periódica.


