9.3: Transferencia de Electrones - Enlaces Ionicos
- Page ID
- 74918
Objetivos de aprendizaje
- Indicar la regla del octeto.
- Definir enlace iónico.
- Demostrar transferencia de electrones entre átomos para formar enlaces iónicos.
En la Sección 9.2, vimos cómo se forman los iones perdiendo electrones para hacer cationes, o ganando electrones para formar aniones. El lector astuto puede haber notado algo: muchos de los iones que se forman tienen ocho electrones en su caparazón de valencia. O bien los átomos ganan suficientes electrones para tener ocho electrones en la capa de valencia y convertirse en el anión cargado apropiadamente, o pierden los electrones en su caparazón de valencia original. En el caso de la pérdida de electrones, la capa inferior, ahora la capa de valencia, tiene ocho electrones en ella; por lo que el átomo se carga positivamente. Por cualquier razón, tener ocho electrones en una capa de valencia es una disposición particularmente energéticamente estable de electrones. La tendencia de que a los átomos les gusta tener ocho electrones en su caparazón de valencia se llama la regla del octeto. Cuando los átomos forman compuestos, la regla del octeto no siempre se satisface para todos los átomos en todo momento, pero es una muy buena regla general para comprender los tipos de arreglos de unión que los átomos pueden hacer.
No es imposible violar la regla del octeto. Considera el sodio: en su forma elemental, tiene un electrón de valencia y es estable. Es bastante reactivo, sin embargo, y no requiere mucha energía para eliminar ese electrón para hacer el ion Na +. Podríamos eliminar otro electrón agregando aún más energía al ion para hacer el ion Na 2 +. Sin embargo, eso requiere mucha más energía de la que normalmente está disponible en las reacciones químicas, por lo que el sodio se detiene a una carga 1+ después de perder un solo electrón. Resulta que el ion Na + tiene un octeto completo en su nuevo caparazón de valencia, el caparazón n = 2, que satisface la regla del octeto. La regla del octeto es resultado de las tendencias en las energías y es útil para explicar por qué los átomos forman los iones que hacen.
Considera un átomo de Na en presencia de un átomo de Cl. Los dos átomos tienen estos diagramas de puntos electrónicos de Lewis y configuraciones de electrones:
\[\mathbf{Na\, \cdot }\; \; \; \; \; \; \; \; \; \; \mathbf{\cdot }\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :}\nonumber \]
\[\left [ Ne \right ]3s^{1}\; \; \; \; \left [ Ne \right ]3s^{2}3p^{5}\nonumber \]
Para que el átomo de Na obtenga un octeto, debe perder un electrón; para que el átomo de Cl obtenga un octeto, debe ganar un electrón. Un electrón se transfiere del átomo de Na al átomo de Cl:
\[\mathbf{Na\, \cdot }\curvearrowright \mathbf{\cdot }\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :}\nonumber \]
dando como resultado dos iones, el ion Na + y el ion Cl −:
\[\mathbf{Na\, \cdot }^{+}\; \; \; \; \; \; \; \; \mathbf{:}\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :}^{-}\nonumber \]
\[\left [ Ne \right ]\; \; \; \; \; \left [ Ne \right ]3s^{2}3p^{6}\nonumber \]
Ambas especies ahora tienen octetos completos, y las conchas de electrones son energéticamente estables. A partir de la física básica, sabemos que las cargas opuestas atraen. Esto es lo que sucede con los iones Na + y Cl −:
\[\mathbf{Na\, \cdot }^{+}\; + \; \mathbf{:}\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :}^{-}\rightarrow Na^{+}Cl^{-}\; \; or\; \; NaCl\nonumber \]
donde hemos escrito la fórmula final (la fórmula para el cloruro de sodio) según la convención para compuestos iónicos, sin enumerar explícitamente las cargas. La atracción entre iones cargados opuestamente se llama enlace iónico, y es uno de los principales tipos de enlaces químicos en la química. Los enlaces iónicos son causados por electrones que se transfieren de un átomo a otro.
En la transferencia de electrones, el número de electrones perdidos debe ser igual al número de electrones ganados. Esto lo vimos en la formación de NaCl. Un proceso similar ocurre entre los átomos de Mg y los átomos de O, excepto en este caso se transfieren dos electrones:
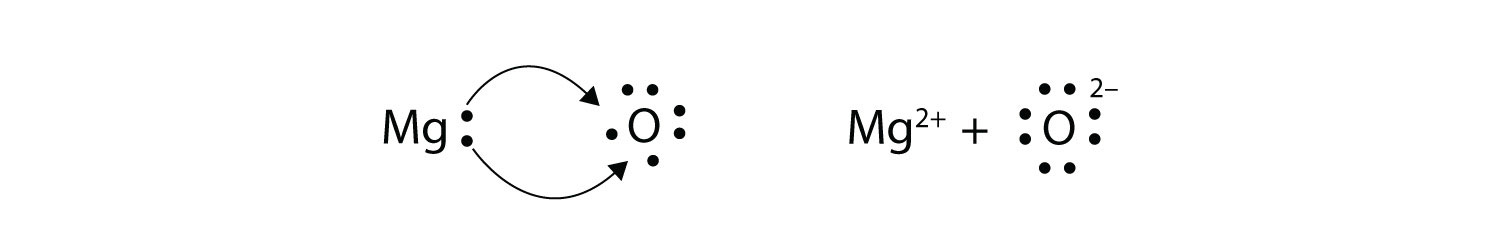
Cada uno de los dos iones tiene octetos como su capa de valencia, y las dos partículas con carga contraria se atraen, formando un enlace iónico:
\[\mathbf{Mg\,}^{2+}\; + \; \mathbf{:}\mathbf{\ddot{\underset{.\: .}O}}\mathbf{\: :}^{2-}\; \; \; \; \; Mg^{2+}O^{2-}\; or\; MgO\nonumber \]
Recuerda, en la fórmula final para el compuesto iónico, no escribimos las cargas sobre los iones.
¿Qué pasa cuando un átomo de Na interactúa con un átomo de O? El átomo de O necesita dos electrones para completar su octeto de valencia, pero el átomo de Na suministra solo un electrón:
\[\mathbf{Na\, \cdot }\curvearrowright \mathbf{\cdot }\mathbf{\ddot{\underset{.}O}}\mathbf{\: :}\nonumber \]
El átomo O todavía no tiene un octeto de electrones. Lo que necesitamos es un segundo átomo de Na para donar un segundo electrón al átomo de O:
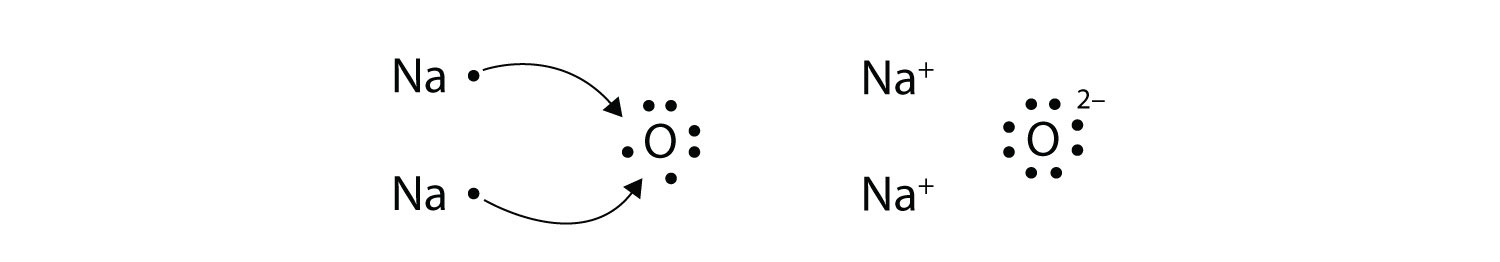
Estos tres iones se atraen entre sí para formar un compuesto iónico global cargado neutralmente, que escribimos como Na 2 O. La necesidad de que el número de electrones perdidos sea igual al número de electrones ganados explica por qué los compuestos iónicos tienen la relación de cationes a aniones que hacen. Esto también lo exige la ley de conservación de la materia.
Ejemplo\(\PageIndex{1}\)
Con flechas, ilustran la transferencia de electrones para formar cloruro de calcio a partir de átomos de Ca y átomos de Cl.
Solución
Un átomo de Ca tiene dos electrones de valencia, mientras que un átomo de Cl tiene siete electrones. Un átomo de Cl solo necesita uno más para completar su octeto, mientras que los átomos de Ca tienen dos electrones que perder. Necesitamos dos átomos de Cl para aceptar los dos electrones de un átomo de Ca. El proceso de transferencia es el siguiente:
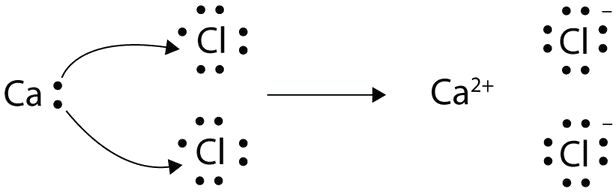
Los iones cargados opuestamente se atraen entre sí para hacer CaCl 2.
Ejercicio\(\PageIndex{1}\)
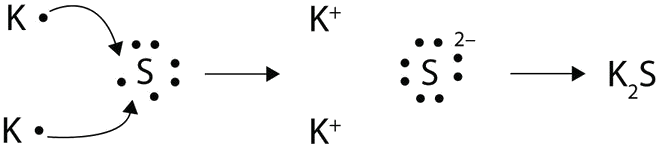
Con flechas, ilustran la transferencia de electrones para formar sulfuro de potasio a partir de átomos de K y átomos de S.
- Contestar
-
La fuerza del enlace iónico depende de dos características principales: la magnitud de las cargas y el tamaño del ion. Cuanto mayor sea la magnitud de la carga, más fuerte será el enlace iónico. Cuanto más pequeño es el ion, más fuerte es el enlace iónico (porque un tamaño de iones más pequeño permite que los iones se acerquen más). La fuerza medida del enlace iónico se llama energía reticular. Algunas energías de celosía se dan en Tabla\(\PageIndex{1}\) - Energías de Enrejado de Algunos Compuestos Iónicos.
| Compuesto | Energía de celosía (kJ/mol) |
|---|---|
| LiF | 1,036 |
| LiCl | 853 |
| NaCl | 786 |
| NaBr | 747 |
| MGF 2 | 2,957 |
| Na 2 O | 2,481 |
| MgO | 3,791 |
La química está en todas partes: la sal
El elemento sodio (parte [a] en la figura acompañante) es un metal muy reactivo; dada la oportunidad, reaccionará con el sudor de tus manos y formará hidróxido de sodio, que es una sustancia muy corrosiva. El elemento cloro (parte [b] en la figura acompañante) es un gas corrosivo de color amarillo pálido que no debe inhalarse debido a su naturaleza venenosa. Reunir estas dos sustancias peligrosas, sin embargo, y reaccionan para hacer el compuesto iónico cloruro de sodio (parte [c] en la figura que lo acompaña), conocido simplemente como sal.

La sal es necesaria para la vida. Los iones Na + son uno de los principales iones en el cuerpo humano y son necesarios para regular el equilibrio de fluidos en el cuerpo. Los iones Cl − son necesarios para la función nerviosa y la respiración adecuadas. Ambos iones son suministrados por la sal. El sabor de la sal es uno de los sabores fundamentales; la sal es probablemente el saborizante más antiguo conocido, y una de las pocas rocas que comemos.
Los efectos de demasiada sal en la salud siguen siendo objeto de debate, aunque un informe de 2010 del Departamento de Agricultura de Estados Unidos concluyó que “la ingesta excesiva de sodio... eleva la presión arterial, un factor de riesgo bien aceptado y extraordinariamente común de accidente cerebrovascular, cardiopatía coronaria y enfermedad renal” ( Comité de Política y Promoción Nutricional del Departamento de Agricultura de Estados Unidos, Informe del Comité Asesor de Directrices Alimentarias sobre las Directrices Alimentarias para Estadounidenses, consultado el 5 de enero de 2010). Está claro que la mayoría de las personas ingieren más sal de la que sus cuerpos necesitan, y la mayoría de los nutricionistas recomiendan frenar la ingesta de sal. Curiosamente, las personas que sufren de baja sal (llamada hiponatria) lo hacen no porque ingieran muy poca sal, sino porque beben demasiada agua. Los atletas de resistencia y otras personas involucradas en el ejercicio extenuante prolongado necesitan vigilar su ingesta de agua para que el contenido de sal de su cuerpo no se diluya a niveles peligrosos.
Resumen
- La tendencia a formar especies que tienen ocho electrones en la capa de valencia se llama regla del octeto.
- La atracción de iones cargados opuestamente causada por la transferencia de electrones se llama enlace iónico.
- La fuerza del enlace iónico depende de la magnitud de las cargas y los tamaños de los iones.


