9.4: Enlaces covalentes
- Page ID
- 74907
- Definir enlace covalente.
- Ilustrar la formación de enlaces covalentes con diagramas de puntos electrónicos de Lewis.
La unión iónica suele ocurrir cuando es fácil que un átomo pierda uno o más electrones, y que otro átomo gane uno o más electrones. Sin embargo, algunos átomos no se rendirán ni ganarán electrones fácilmente. Sin embargo, siguen participando en la formación de compuestos. ¿Cómo? Existe otro mecanismo para obtener un caparazón de valencia completo: compartir electrones. Cuando los electrones se comparten entre dos átomos, forman un enlace covalente.
Ilustremos un enlace covalente mediante el uso de átomos de H, entendiendo que los átomos de H solo necesitan dos electrones para llenar la subcapa de 1 s. Cada átomo H comienza con un solo electrón en su caparazón de valencia:
\[\mathbf{H\, \cdot }\; \; \; \; \; \mathbf{\cdot \: H}\nonumber \]
Los dos átomos de H pueden compartir sus electrones:
\[\mathbf{H}\: \mathbf{: H}\nonumber \]
Podemos usar círculos para mostrar que cada átomo H tiene dos electrones alrededor del núcleo, llenando completamente la capa de valencia de cada átomo:
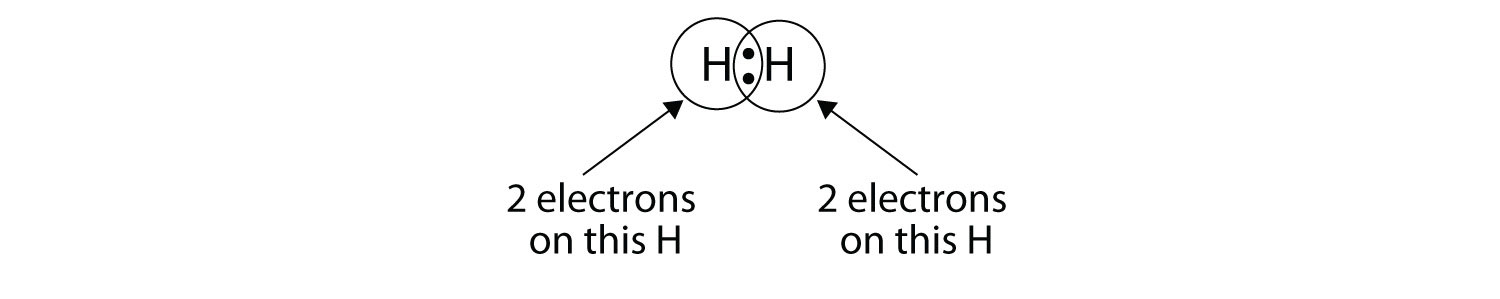
Debido a que cada átomo de H tiene una capa de valencia llena, este enlace es estable, y hemos hecho una molécula de hidrógeno diatómico. (Esto explica por qué el hidrógeno es uno de los elementos diatómicos). Por simplicidad, no es raro representar el enlace covalente con un guión, en lugar de con dos puntos:
H—H
Debido a que dos átomos comparten un par de electrones, este enlace covalente se denomina enlace sencillo. Como otro ejemplo, considere el flúor. Los átomos F tienen siete electrones en su caparazón de valencia:
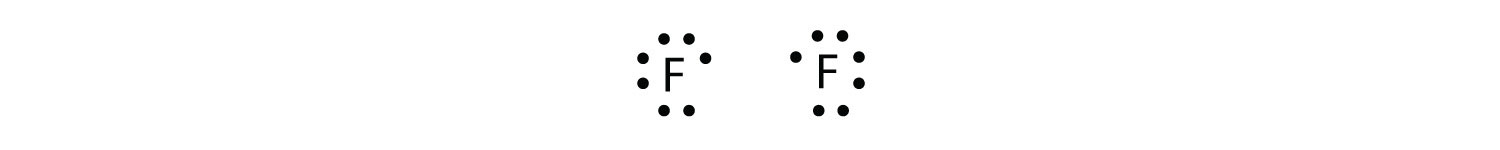
Estos dos átomos pueden hacer lo mismo que hicieron los átomos de H; comparten sus electrones desapareados para hacer un enlace covalente.

Tenga en cuenta que cada átomo F tiene un octeto completo a su alrededor ahora:
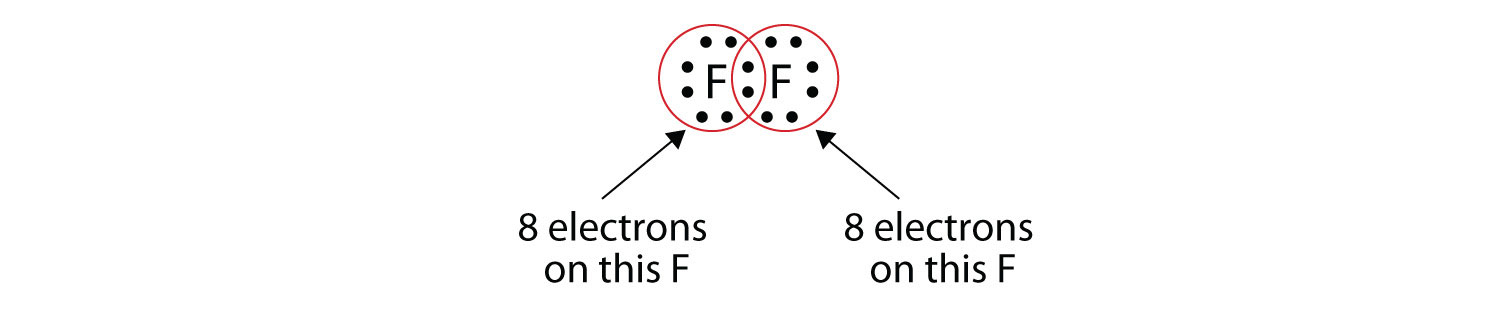
También podemos escribir esto usando un guión para representar el par de electrones compartido:
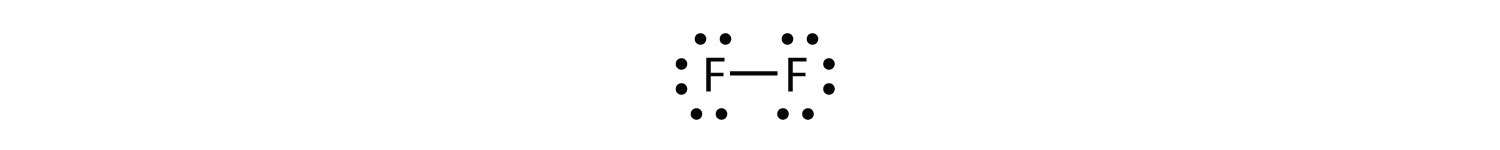
Hay dos tipos diferentes de electrones en la molécula diatómica de flúor. El par de electrones de enlace hace el enlace covalente. Cada átomo F tiene otros tres pares de electrones que no participan en el enlace; se les llama electrones de par solitario. Cada átomo F tiene un par de enlace y tres pares solitarios de electrones.
También se pueden hacer enlaces covalentes entre diferentes elementos. Un ejemplo es HF. Cada átomo comienza con un número impar de electrones en su caparazón de valencia:

Los dos átomos pueden compartir sus electrones desapareados para formar un enlace covalente:

Obsérvese que el átomo H tiene una capa de valencia completa con dos electrones, mientras que el átomo F tiene un octeto completo de electrones.
Utilice diagramas de puntos electrónicos de Lewis para ilustrar la formación de enlaces covalentes en HBr.
Solución
HBr es muy similar al HF, excepto que tiene Br en lugar de F. Los átomos son los siguientes:

Los dos átomos pueden compartir su electrón desapareado:
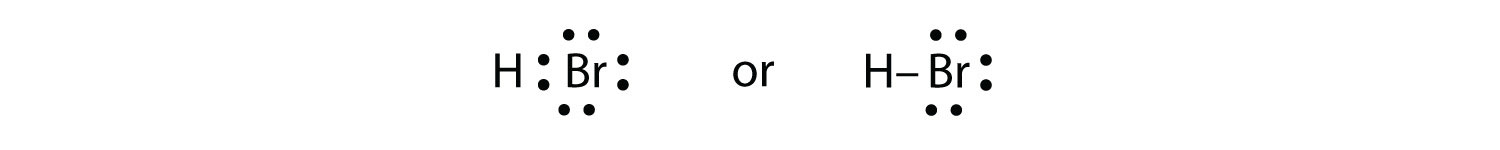
Utilice diagramas de puntos electrónicos de Lewis para ilustrar la formación de enlaces covalentes en Cl 2.
Contestar

Más de dos átomos pueden participar en enlaces covalentes, aunque cualquier enlace covalente dado será entre dos átomos solamente. Considere los átomos de H y O:

Los átomos de H y O pueden compartir un electrón para formar un enlace covalente:

El átomo H tiene una capa de valencia completa. Sin embargo, el átomo O solo tiene siete electrones a su alrededor, lo que no es un octeto completo. Esto se puede fijar incluyendo un segundo átomo de H, cuyo único electrón hará un segundo enlace covalente con el átomo de O:

(No importa en qué lado se posicione el segundo átomo de H). Ahora el átomo O tiene un octeto completo a su alrededor, y cada átomo H tiene dos electrones, llenando su caparazón de valencia. Es así como se elabora una molécula de agua, H 2 O.
Utilice un diagrama de puntos electrónicos de Lewis para mostrar el enlace covalente en NH 3.
Solución
El átomo de N tiene el siguiente diagrama de puntos electrónicos de Lewis:

Tiene tres electrones desapareados, cada uno de los cuales puede formar un enlace covalente al compartir electrones con un átomo de H. El diagrama de puntos electrónicos de NH 3 es el siguiente:

Utilice un diagrama de puntos electrónicos de Lewis para mostrar el enlace covalente en pCl 3.
- Contestar
-

Hay un conjunto simple de pasos para determinar el diagrama de puntos electrónicos de Lewis de una molécula simple. Primero, se debe identificar el átomo central y los átomos circundantes. El átomo central es el átomo en el centro de la molécula, mientras que los átomos circundantes son los átomos que hacen enlaces al átomo central. El átomo central generalmente se escribe primero en la fórmula del compuesto (H 2 O es la notable excepción). Después de que se hayan identificado los átomos centrales y circundantes, siga estos pasos:
- Contar el número total de electrones de valencia. Agrega extra si la especie tiene cargas negativas y elimina algunos por cada carga positiva sobre la especie.
- Escribe el átomo central y rodearlo con los átomos circundantes.
- Poner un par de electrones entre el átomo central y cada átomo circundante.
- Completar los octetos alrededor de los átomos circundantes (excepto H).
- Poner los electrones restantes, si los hay, alrededor del átomo central.
- Comprueba que cada átomo tenga un caparazón de valencia completo.
Intentemos estos pasos para determinar el diagrama de puntos electrónicos para BF 4 −. El átomo B es el átomo central, y los átomos F son los átomos circundantes. Hay un signo negativo en la especie, por lo que tenemos un electrón extra a considerar.
1. Contar el número total de electrones. B tiene 3, cada F tiene 7, y hay un electrón extra: 3 + 7 + 7 + 7 + 7 + 1 = 32.
2. Escribe el átomo central rodeado de átomos circundantes.

3. Poner un par de electrones entre el átomo central y cada átomo circundante. Esto consume hasta ocho electrones, así que nos quedan 32 − 8 = 24 electrones.

4. Completar los octetos alrededor de los átomos circundantes (excepto H). Esto consume hasta 24 electrones más, dejando 24 − 24 = 0 electrones a la izquierda.

5. Poner los electrones restantes, si los hay, alrededor del átomo central. No hay electrones adicionales para agregar al átomo central.
6. Cheque. El átomo B tiene ocho electrones a su alrededor, al igual que cada átomo F. Cada átomo tiene un octeto completo. Este es un buen diagrama de puntos de electrones de Lewis para BF 4 −.
A veces, sin embargo, estos pasos no funcionan. Si tuviéramos que seguir estos pasos para el compuesto formaldehído (CH 2 O), obtendríamos lo siguiente:

Los átomos H y O tienen el número apropiado de electrones, pero el átomo C solo tiene seis electrones a su alrededor, no los ocho electrones para un octeto. ¿Cómo solucionamos esto?
Arreglamos esto reconociendo que dos átomos pueden compartir más de un par de electrones. En el caso de CH 2 O, los átomos de O y C comparten dos pares de electrones, con el siguiente diagrama de puntos de electrones de Lewis como resultado:

Al dar vueltas a los electrones alrededor de cada átomo, ahora podemos ver que los átomos de O y C tienen octetos, mientras que cada átomo de H tiene dos electrones:
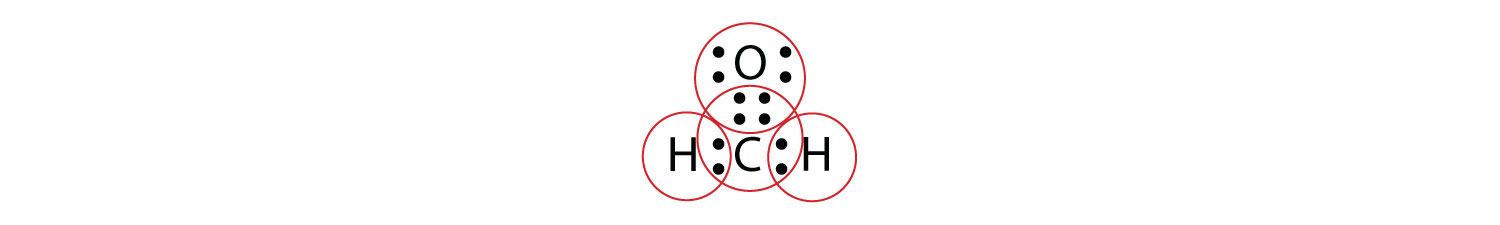
Cada caparazón de valencia está lleno, por lo que este es un diagrama de puntos electrónicos de Lewis aceptable. Si usáramos líneas para representar los enlaces, usaríamos dos líneas entre los átomos C y O:

El enlace entre los átomos C y O es un doble enlace y representa dos pares de enlaces de electrones entre los átomos. Si las reglas para dibujar diagramas de puntos electrónicos de Lewis no funcionan como están escritas, es posible que se requiera un doble enlace.
¿Cuál es el diagrama de puntos electrónicos de Lewis adecuado para CO 2?
Solución
El átomo central es un átomo de C, con átomos de O como átomos circundantes. Tenemos un total de 4 + 6 + 6 = 16 electrones de valencia. Seguir las reglas para los diagramas de puntos electrónicos de Lewis para compuestos nos da

Los átomos O tienen octetos completos a su alrededor, pero el átomo C solo tiene cuatro electrones a su alrededor. La manera de resolver este dilema es hacer un doble enlace entre el carbono y cada átomo de O:

Cada átomo O todavía tiene ocho electrones a su alrededor, pero ahora el átomo C también tiene un octeto completo. Este es un diagrama de puntos electrónicos de Lewis aceptable para CO 2.
¿Cuál es el diagrama de puntos electrónicos de Lewis adecuado para el sulfuro de carbonilo (COS)?
Contestar

También es posible tener un triple enlace, en el que hay tres pares de electrones entre dos átomos. Buenos ejemplos de esto son nitrógeno elemental (N 2) y acetileno (C 2 H 2):

El acetileno es un ejemplo interesante de una molécula con dos átomos centrales, que son ambos átomos de C. Los iones poliatómicos están unidos con enlaces covalentes. Debido a que son iones, sin embargo, participan en la unión iónica con otros iones. Por lo que ambos tipos principales de unión pueden ocurrir al mismo tiempo.
Las vitaminas son nutrientes que nuestro organismo necesita en pequeñas cantidades pero que no pueden sintetizar; por lo tanto, deben obtenerse de la dieta. La palabra vitamina proviene de “amina vital” porque alguna vez se pensó que todos estos compuestos tenían un grupo amina (NH 2) en ella. Esto no es realmente cierto, pero el nombre se quedó de todos modos.
Todas las vitaminas son moléculas unidas covalentemente. La mayoría de ellos son comúnmente nombrados con una letra, aunque todos ellos también tienen nombres químicos formales. Así, la vitamina A también se llama retinol, la vitamina C se llama ácido ascórbico, y la vitamina E se llama tocoferol. No hay una sola vitamina B; hay un grupo de sustancias llamadas vitaminas del complejo B que son todas solubles en agua y participan en el metabolismo celular. Si a una dieta le falta una vitamina, se desarrollan enfermedades como el escorbuto o el raquitismo. Por suerte, todas las vitaminas están disponibles como suplementos, por lo que cualquier deficiencia dietética en una vitamina se puede corregir fácilmente.
Un mineral es cualquier elemento químico que no sea carbono, hidrógeno, oxígeno o nitrógeno que necesita el cuerpo. Los minerales que el cuerpo necesita en cantidad incluyen sodio, potasio, magnesio, calcio, fósforo, azufre y cloro. Los minerales esenciales que el cuerpo necesita en pequeñas cantidades (los llamados oligoelementos) incluyen manganeso, hierro, cobalto, níquel, cobre, zinc, molibdeno, selenio y yodo. También se obtienen minerales de la dieta. Curiosamente, la mayoría de los minerales se consumen en forma iónica, más que como elementos o a partir de moléculas covalentes. Al igual que las vitaminas, la mayoría de los minerales están disponibles en forma de píldora, por lo que cualquier deficiencia puede compensarse tomando suplementos.

Resumen
- Los enlaces covalentes se forman cuando los átomos comparten electrones.
- Se pueden dibujar diagramas de puntos electrónicos de Lewis para ilustrar la formación de enlaces covalentes.
- Pueden ser necesarios dobles enlaces o triples enlaces entre átomos para ilustrar adecuadamente el enlace en algunas moléculas.


