14.2: Reacciones de Oxidación-Reducción
- Page ID
- 74760
- Definir oxidación y reducción.
- Asignar números de oxidación a átomos en compuestos simples.
- Reconocer una reacción como una reacción de oxidación-reducción.
Considera esta reacción química:
\[\ce{Mg(s) + Cl2(g) → MgCl2}\nonumber \]
Los reactivos son dos elementos eléctricamente neutros; tienen el mismo número de electrones que los protones. El producto, sin embargo, es iónico; está compuesto por iones Mg 2 + y Cl −. De alguna manera, los átomos de Mg individuales pierden dos electrones para hacer el ion Mg 2 +, mientras que los átomos de Cl ganan un electrón para convertirse en iones Cl −. Esta reacción implica la transferencia de electrones entre átomos.
El proceso de perder y ganar electrones ocurre simultáneamente. Sin embargo, mentalmente podemos separar los dos procesos. La oxidación se define como la pérdida de uno o más electrones por un átomo. La reducción se define como la ganancia de uno o más electrones por un átomo. De manera que la oxidación y la reducción siempre ocurren juntas; es sólo mentalmente que podemos separarlas. Las reacciones químicas que implican la transferencia de electrones se denominan reacciones de oxidación-reducción (o redox).
Las reacciones redox requieren que hagamos un seguimiento de los electrones asignados a cada átomo en una reacción química. ¿Cómo lo hacemos? Utilizamos números de oxidación para realizar un seguimiento de los electrones en los átomos. Los números de oxidación se asignan a los átomos en base a cuatro reglas. Los números de oxidación no son necesariamente iguales a la carga en el átomo (aunque a veces pueden serlo); debemos mantener separados los conceptos de carga y números de oxidación.
Las reglas para asignar números de oxidación a átomos son las siguientes:
- A los átomos en su estado elemental se les asigna un número de oxidación de 0.
- A los átomos en iones monatómicos (es decir, de un átomo) se les asigna un número de oxidación igual a su carga. Los números de oxidación suelen escribirse con el signo primero, luego la magnitud, para diferenciarlos de las cargas.
- En los compuestos, al flúor se le asigna un número de oxidación −1; al oxígeno generalmente se le asigna un número de oxidación −2 (excepto en los compuestos de peróxido [donde es −1] y en compuestos binarios con flúor [donde es positivo]); y al hidrógeno se le asigna generalmente un número de oxidación +1 (excepto cuando existe como ión hidruro [H −], en cuyo caso prevalece la regla 2).
- En los compuestos, a todos los demás átomos se les asigna un número de oxidación para que la suma de los números de oxidación en todos los átomos de la especie sea igual a la carga sobre la especie (que es cero si la especie es neutra).
Aquí hay algunos ejemplos para la práctica. En H 2, ambos átomos de H tienen un número de oxidación de 0 por regla 1. En MgCl 2, el magnesio tiene un número de oxidación de +2, mientras que el cloro tiene un número de oxidación de −1 por regla 2. En H 2 O, los átomos de H tienen cada uno un número de oxidación de +1, mientras que el átomo de O tiene un número de oxidación de −2, aunque el hidrógeno y el oxígeno no existen como iones en este compuesto (regla 3). Por el contrario, por regla 3, cada átomo de H en el peróxido de hidrógeno (H 2 O 2) tiene un número de oxidación de +1, mientras que cada átomo de O tiene un número de oxidación de −1. Podemos usar la regla 4 para determinar los números de oxidación de los átomos en SO 2. Cada átomo de O tiene un número de oxidación de −2; para que la suma de los números de oxidación sea igual a la carga en la especie (que es cero), al átomo de S se le asigna un número de oxidación de +4. ¿Significa esto que el átomo de azufre tiene una carga 4+ en él? No, solo significa que al átomo S se le asigna un número de oxidación +4 por nuestras reglas de reparto de electrones entre los átomos en un compuesto.
Asignar números de oxidación a los átomos en cada sustancia.
- Cl 2
- GeO 2
- Ca (NO 3) 2
Solución
- Cl 2 es la forma elemental del cloro. La regla 1 establece que cada átomo tiene un número de oxidación de 0.
- Por regla 3, al oxígeno se le asigna normalmente un número de oxidación de −2. Para que la suma de los números de oxidación sea igual a la carga en la especie (cero), al átomo de Ge se le asigna un número de oxidación de +4.
- Ca (NO 3) 2 se puede separar en dos partes: el ion Ca 2 + y el ion NO 3 −. Considerando estos por separado, el ion Ca 2 + tiene un número de oxidación de +2 por regla 2. Ahora considere el ion NO 3 −. Al oxígeno se le asigna un número de oxidación de −2, y hay tres de ellos. Según la regla 4, la suma de los números de oxidación en todos los átomos debe ser igual a la carga en la especie, por lo que tenemos la ecuación algebraica simple x + 3 (−2) = −1
donde x es el número de oxidación del átomo de N y −1 representa la carga en la especie. Evaluando para x,
x + (−6) = −1 x = +5Así, el número de oxidación en el átomo de N en el ion NO 3 − es +5.
Asignar números de oxidación a los átomos en H 3 PO 4.
- Contestar
-
H: +1; O: −2; P: +5
Todas las reacciones redox ocurren con un cambio simultáneo en los números de oxidación de algunos átomos. Al menos dos elementos deben cambiar sus números de oxidación. Cuando se incrementa un número de oxidación de un átomo en el curso de una reacción redox, ese átomo se está oxidando. Cuando un número de oxidación de un átomo disminuye en el curso de una reacción redox, ese átomo se está reduciendo. La oxidación y reducción también se pueden definir en términos de aumentar o disminuir los números de oxidación, respectivamente.
Identificar lo que se está oxidando y reduciendo en esta reacción redox.
\[\ce{2Na + Br2 → 2NaBr} \nonumber \nonumber \]Solución
Ambos reactivos son las formas elementales de sus átomos, por lo que los átomos de Na y Br tienen números de oxidación de 0. En el producto iónico, los iones Na + tienen un número de oxidación de +1, mientras que los iones Br − tienen un número de oxidación de −1.
\[2\underset{0}{Na}+\underset{0}{Br_{2}}\rightarrow 2\underset{+1 -1}{NaBr} \nonumber \nonumber \]
El sodio está aumentando su número de oxidación de 0 a +1, por lo que se está oxidando; el bromo está disminuyendo su número de oxidación de 0 a −1, por lo que se está reduciendo:
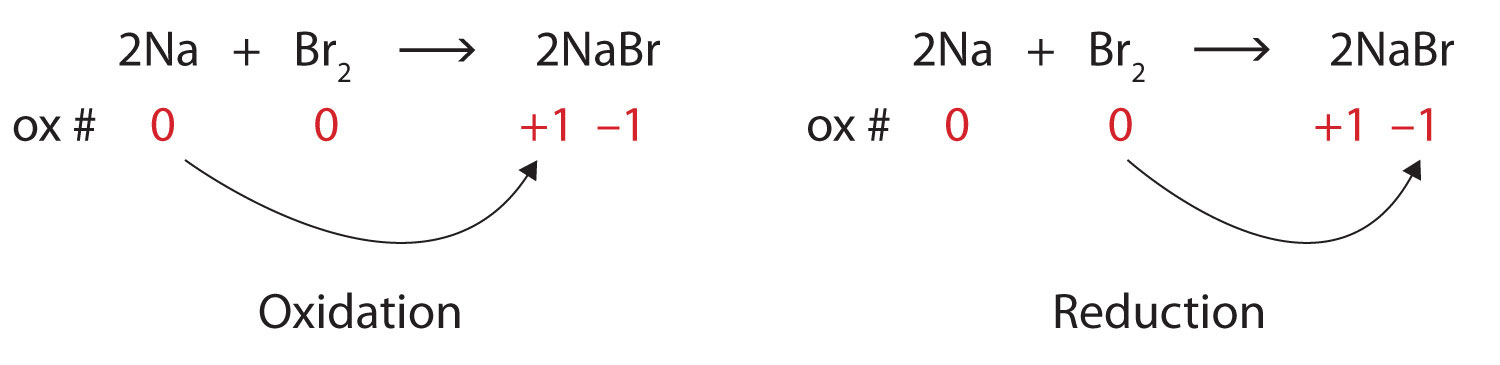
Debido a que los números de oxidación están cambiando, esta es una reacción redox. El número total de electrones que se pierden por el sodio (dos, uno perdido de cada átomo de Na) es ganado por el bromo (dos, uno ganado por cada átomo de Br).
Identificar lo que se está oxidando y reduciendo en esta reacción redox.
\[\ce{C + O2 → CO2}\nonumber \nonumber \]
- Contestar
-
C está siendo oxidado de 0 a +4; O se está reduciendo de 0 a −2.
Las reacciones de oxidación pueden llegar a ser bastante complejas, como lo atestigua la siguiente reacción redox:
\[6H^{+}(aq)+2\underset{+7}{MnO_{4}^{-}}(aq)+5\underset{-1}{H_{2}O_{2}}(l)\rightarrow 2\underset{+2}{Mn^{2+}}(aq)+5\underset{0}{O_{2}}(g)+8H_{2}O(l)\nonumber \]
Para demostrar que se trata de una reacción redox, se listan los números de oxidación de las especies que se oxidan y reducen; ¿se puede determinar qué se está oxidando y qué se está reduciendo? Este es también un ejemplo de una reacción iónica neta; los iones espectadores que no cambian los números de oxidación no se muestran en la ecuación. Eventualmente, necesitaremos aprender técnicas para escribir reacciones redox correctas (es decir, equilibradas).
El hierro es un mineral esencial en nuestra dieta; compuestos que contienen hierro como la proteína hemo en la hemoglobina no podrían funcionar sin él. La mayor parte del hierro biológico tiene la forma del ion Fe 2 +; el hierro con otros números de oxidación es casi intrascendente en la biología humana (aunque el cuerpo sí contiene una enzima para reducir Fe 3 + a Fe 2 +, por lo que el Fe 3 + debe tener algún significado biológico, aunque menor). Para asegurarnos de que ingerimos suficiente hierro, muchos alimentos se enriquecen con hierro. Si bien los compuestos de Fe 2 + son las sustancias más lógicas para usar, algunos alimentos utilizan como ingrediente el “hierro reducido” (el pan y los cereales para el desayuno son los ejemplos más conocidos). El hierro reducido es simplemente hierro metálico; el hierro se agrega como un polvo metálico fino. El hierro metálico se oxida a Fe 2 + en el sistema digestivo y luego es absorbido por el cuerpo, pero la pregunta sigue siendo: ¿Por qué estamos ingiriendo hierro metálico? ¿Por qué no solo usar sales de Fe 2 + como aditivo?

Si bien es difícil establecer razones concluyentes, una búsqueda de literatura científica y médica sugiere algunas razones. Una razón es que las limaduras finas de hierro no afectan el sabor del producto. El tamaño del polvo de hierro (varias docenas de micrómetros) no se nota al masticar alimentos suplementados con hierro, y la lengua no detecta ningún cambio de sabor que se pueda detectar al usar sales de Fe 2 +. Los compuestos de Fe 2 + pueden afectar otras propiedades de los alimentos durante la preparación y cocción, como la flexibilidad de la masa, el crecimiento de la levadura y el color. Por último, de las sustancias comunes de hierro que podrían usarse, el hierro metálico es el menos costoso. Estos factores parecen estar entre las razones por las que el hierro metálico es el complemento de elección en algunos alimentos.
Claves para llevar
- Las reacciones de oxidación-reducción (redox) implican la transferencia de electrones de un átomo a otro.
- Los números de oxidación se utilizan para realizar un seguimiento de los electrones en los átomos.
- Existen reglas para asignar números de oxidación a átomos.
- La oxidación es un aumento en el número de oxidación (pérdida de electrones); la reducción es una disminución en el número de oxidación (ganancia de electrones).


