14.4: Aplicaciones de Reacciones Redox - Celdas Voltáicas
- Page ID
- 74753
- Aprende las partes de una celda voltaica.
- Combine medias reacciones para determinar el voltaje de una celda voltaica.
- Entender cómo se utilizan las celdas voltaicas como baterías.
Considera esta reacción redox:
\[\ce{Zn + Cu^{2+} → Zn^{2+} + Cu}\nonumber \]
Si tuvieras que mezclar iones de zinc metálico y cobre en un recipiente, esta reacción procedería por sí misma; decimos que esta reacción es espontánea.
Supongamos, sin embargo, que configuramos esta reacción de una manera representada en la Fig 14.4.1 - Una reacción redox en la que las dos medias reacciones están físicamente separadas. Los iones de zinc y zinc están en un lado del sistema, mientras que los iones de cobre y cobre están en el otro lado del sistema. Las dos partes están conectadas con un cable.
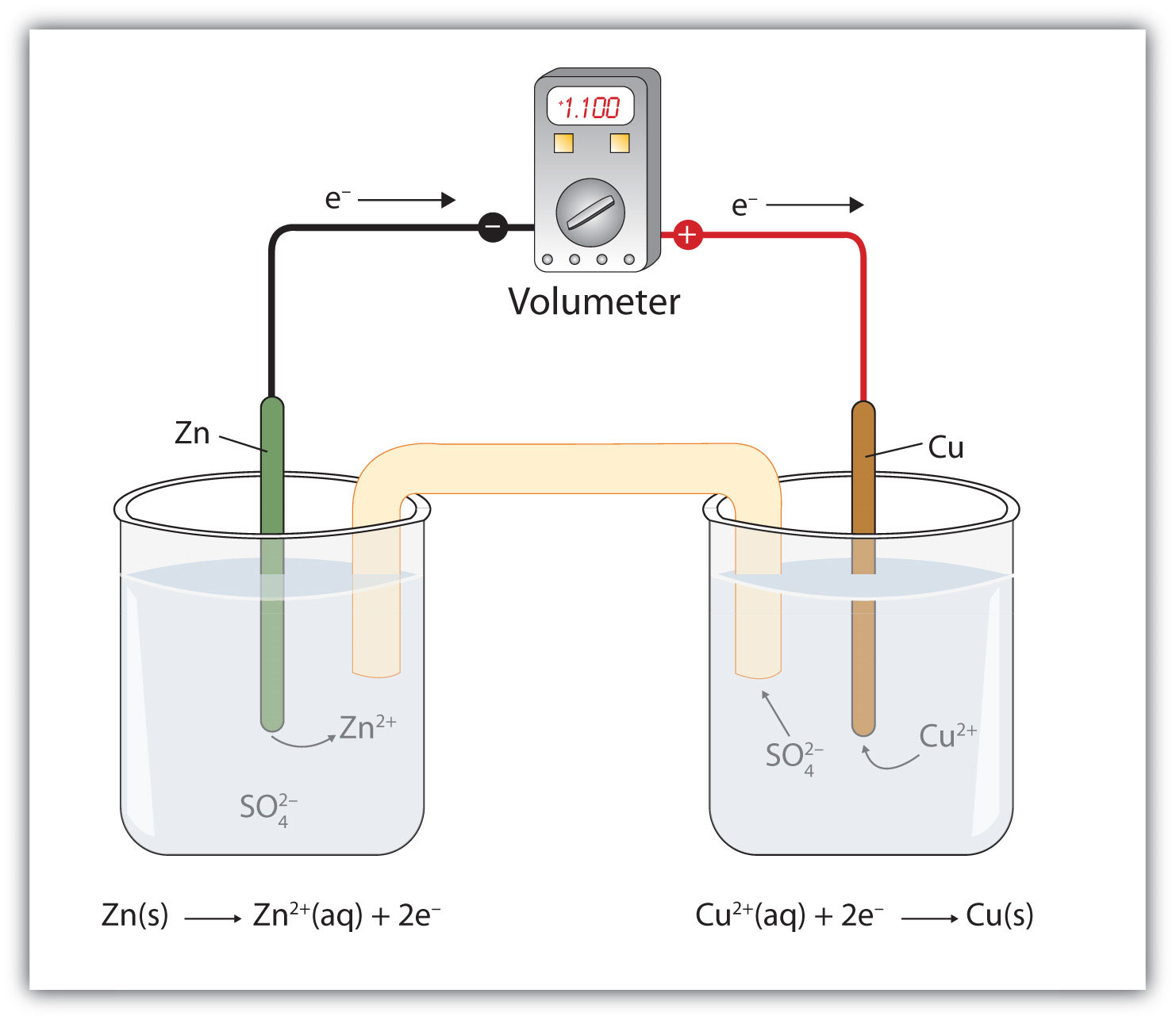
A pesar de que las dos medias reacciones están físicamente separadas, todavía se produce una reacción redox espontánea. Sin embargo, en este caso, los electrones se transfieren a través del cable conectando las dos medias reacciones; es decir, esta configuración se convierte en una fuente de electricidad. El trabajo útil se puede extraer de los electrones a medida que se transfieren de un lado a otro. Por ejemplo, se puede encender una bombilla o se puede operar un motor. El aparato en su conjunto, que permite extraer trabajo eléctrico útil de una reacción redox, se denomina celda voltaica (galvánica).
Cada sistema individual que contiene una media reacción se llama media célula. La media celda que contiene la reacción de oxidación se llama ánodo, mientras que la media celda que contiene la reacción de reducción se llama cátodo. El cátodo y el ánodo colectivamente son los electrodos de la celda voltaica. Debido a que los electrones vienen del ánodo, el ánodo se considera el electrodo negativo de la celda, mientras que el cátodo se considera el electrodo positivo de la celda. Finalmente, debido a que los electrones se mueven de una media celda a la otra, se acumula un desequilibrio de carga a medida que avanza la reacción. Para contrarrestar eso, se utiliza un puente de sal; el puente de sal contiene una solución de algún compuesto iónico cuyos iones migran a ambos lados de la célula voltaica para mantener el equilibrio de carga.
La tendencia de los electrones a pasar de una media celda a otra se denomina voltaje de la celda voltaica, representada por E. A veces se usa el término potencial para representar el voltaje de una celda. El voltaje se expresa en voltios (V). El voltaje de una celda voltaica está determinado por la diferencia en las tendencias de las medias celdas individuales y es característico de una reacción redox dada cuando las concentraciones son específicas (1.0 M para especies disueltas y 1.0 atm para gases). Debido a que el voltaje de una reacción redox está determinado por la diferencia de las tendencias de las medias reacciones individuales, los voltajes absolutos son innecesarios; solo se necesitan voltajes relativos de cada media reacción. El voltaje relativo de cada media celda se representa como E 1/2 y se basa en el estándar que el E 1/2 para la reacción
\[H^{+}+e^{-}\rightarrow \frac{1}{2}H_{2}\nonumber \]
se asigna para ser exactamente 0.000 V bajo condiciones estándar de presión y concentración. Cuadro\(\PageIndex{1}\) - Potenciales de reducción estándar de medias reacciones, enumera algunos valores relativos de E 1/2 para algunas medias reacciones. Tenga en cuenta que todas las medias reacciones se enumeran como reacciones de reducción, por lo que estos valores se denominan potenciales de reducción estándar de cada media reacción.
| Media reacción de reducción | E 1/2 (V) |
|---|---|
| F 2 + 2e − → 2F − | 2.87 |
| Ce 4 + e − → Ce 3 + | 1.61 |
| MnO 4 − + 8H + + 5e − → Mn 2 + + 4H 2 O | 1.51 |
| Cl 2 + 2e − → 2Cl − | 1.36 |
| O 2 + 4H + + 4e − → 2H 2 O | 1.23 |
| Br 2 + 2e − → 2Br − | 1.06 |
| NO 3 − + 4H + + 3e − → NO + 2H 2 O | 0.96 |
| Ag + + e − → Ag | 0.80 |
| Fe 3 + + e − → Fe 2 + | 0.77 |
| I 2 + 2e − → 2I − | 0.54 |
| Cu 2 + + 2e − → Cu | 0.34 |
| AgCl + e − → Ag + Cl − | 0.222 |
| Sn 4 + + 2e − → Sn 2 + | 0.15 |
| 2H + + 2e − → H 2 | 0.000 |
| Pb 2 + + 2e − → Pb | −0.126 |
| Ni 2 + + 2e − → Ni | −0.25 |
| Cr 3 + + e − → Cr 2 + | −0.41 |
| Fe 2 + + 2e − → Fe | −0.44 |
| Cr 3 + + 3e − → Cr | −0.74 |
| Zn 2 + + 2e − → Zn | −0.76 |
| Cr 2 + + 2e − → Cr | −0.91 |
| Ba 2 + + 2e − → Ba | −1.57 |
| Al 3 + + 3e − → Al | −1.66 |
| Mg 2 + + 2e − → Mg | −2.37 |
| Na + + e − → Na | −2.714 |
| Li + e − → Li | −3.045 |
Tabla Potenciales de reducción\(\PageIndex{1}\) estándar de medias reacciones
La tabla anterior enumera solo reacciones de reducción, pero una reacción redox tiene una reducción y una oxidación. Para realizar la reacción de oxidación, simplemente invierta la reacción de reducción en la tabla anterior y cambie el signo en el valor de E 1/2. Si el potencial de reducción es negativo, haga que el voltaje para la oxidación sea positivo; si el potencial de reducción es positivo, haga que el voltaje para la oxidación sea negativo.
¿Cuál es el valor de E 1/2 para esta media reacción?
Ag + Cl − → AgCl + e −Solución
La reacción dada es la inversa de esta reacción:
AgCl + e − → Ag + Cl − E 1/2 = 0.222 VPor lo tanto, el E 1/2 de la reacción dada es −0.222 V.
¿Cuál es el valor de E 1/2 para esta media reacción?
Na → Na + + e −Responder
2.714 V
Para determinar el voltaje general de una celda voltaica particular, simplemente combine los voltajes de las medias reacciones de oxidación y reducción. Incluso si necesitas tomar una reacción múltiple de media para que los electrones se cancelen, no tomes el múltiplo del E 1/2. Utilice los valores directamente como está de la Tabla\(\PageIndex{1}\) - Potenciales de Reducción Estándar de Semireacciones.
Las reacciones redox espontáneas tienen voltajes globales positivos. Si el voltaje de la reacción tal como está escrito es negativo, no es espontáneo en esa dirección. Más bien, la reacción inversa es la reacción redox espontánea.
¿Cuál es el voltaje de una célula voltaica basada en esta reacción? ¿La reacción es espontánea como está escrita?
2NO 3 − + 8H + + 3Cu → 2NO + 4H 2 O + 3Cu 2 +Solución
La reacción redox global se forma a partir de estas dos medias reacciones:
NO 3 − + 4H + + 3e − → NO + 2H 2 O E 1/2 = 0.96 vCu 2 + + 2 e − → Cu E 1/2 = 0.34 VLa segunda reacción se invierte en la reacción redox global, por lo que su voltaje cambia signo de la reacción de reducción:
Cu → Cu 2 + + 2 e − E 1/2 = −0.34 VPara obtener el voltaje de la celda voltaica basado en la reacción general, simplemente combinamos los dos voltajes de las medias reacciones:
E = 0.96 + (−0.34) = 0.62 VDebido a que el voltaje general es positivo, la reacción es espontánea tal y como está escrito.
¿Cuál es el voltaje de una célula voltaica basada en esta reacción? ¿La reacción es espontánea como está escrita?
5Ni + 2MnO 4 − + 16H + → 3Mn 2 + + 8H 2 O + 5Ni 2 +Responder
1.76 V; espontáneo
Técnicamente, cualquier reacción redox se puede configurar para hacer una célula voltaica. En la sociedad moderna, sin embargo, solo se ponen en práctica ciertas reacciones redox. Una célula voltaica portátil que genera electricidad para alimentar dispositivos para nuestra conveniencia se llama batería. Todas las baterías se basan en reacciones redox.
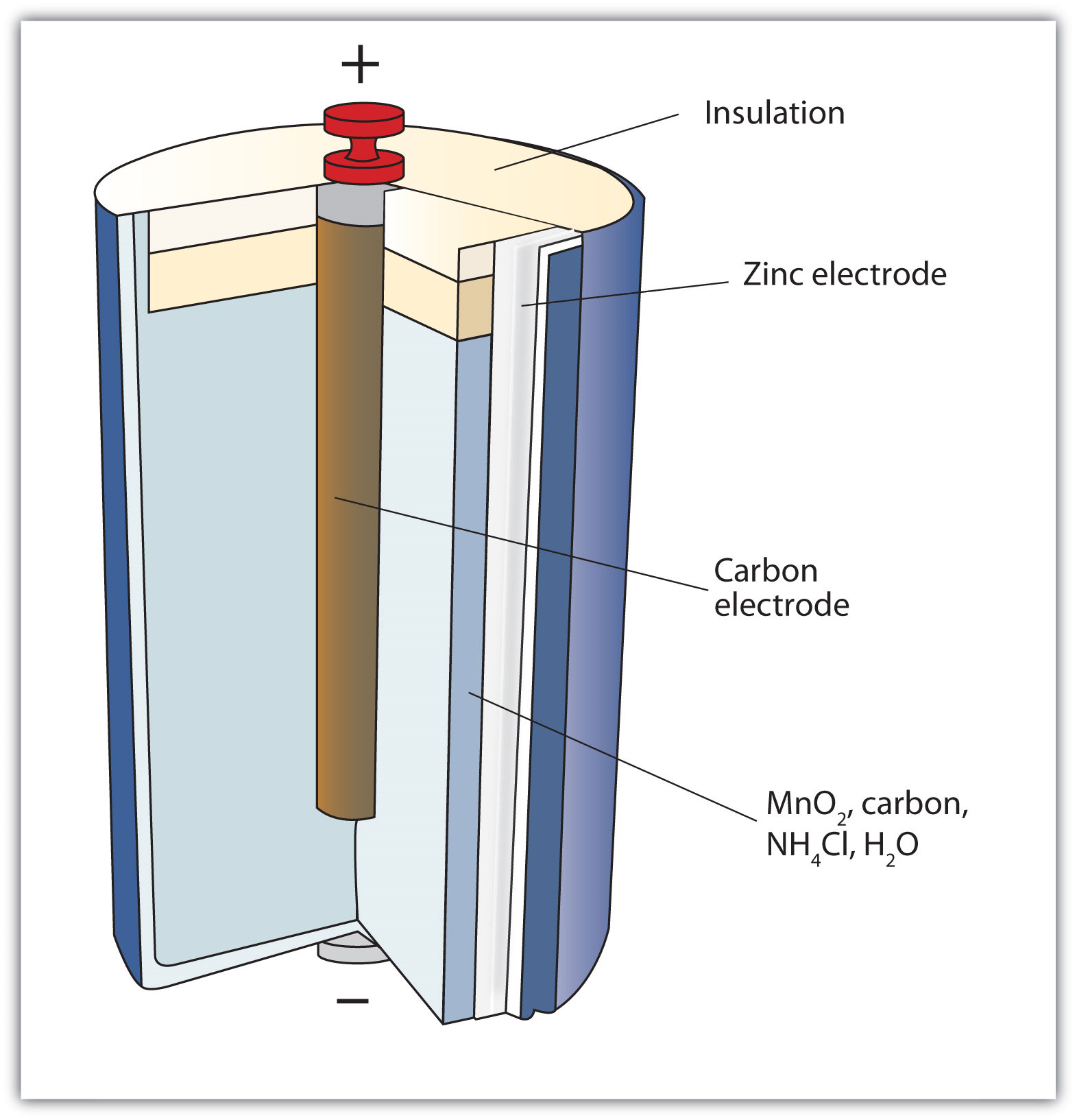
La primera batería (llamada “pila voltaica”) fue construida por el científico italiano Alessandro Volta en 1800 y se basó en la reacción cobre/zinc representada en Figura\(\PageIndex{1}\) - Una reacción redox en la que las dos medias reacciones están físicamente separadas. Desafortunadamente, estaba desordenado, requiriendo cantidades de sales de cobre y zinc disueltas en agua. En 1866, el científico francés Georges Leclanché inventó la célula seca, un precursor de la batería moderna de hoy en día. Un esquema de una celda seca se muestra en la Figura\(\PageIndex{2}\) - Celda Seca. La caja de zinc y la varilla central de carbono sirven como ánodo y cátodo, respectivamente. Los otros reactivos se combinan en una pasta húmeda que minimiza el líquido libre, por lo que la batería es menos desordenada (de ahí el nombre de celda seca).
La reacción redox real es compleja pero puede representarse mediante la siguiente reacción redox:
Zn + 2MnO 2 + 2NH 4 + → Zn 2 + + Mn 2 O 3 + 2NH 3 + H 2 O
Una celda seca tiene un voltaje de aproximadamente 1.56 V. Si bien son comunes y útiles, las celdas secas tienen una vida útil relativamente corta y contienen componentes ácidos. Tampoco se pueden recargar, por lo que son de un solo uso. Las baterías que solo se pueden usar una vez se llaman baterías primarias.
A finales de la década de 1950, Lewis Urry de la Eveready Battery Company en Ohio inventó la batería alcalina (todavía comercializada hoy bajo el nombre comercial Energizer). Las baterías alcalinas son similares a las celdas secas, pero utilizan una pasta húmeda básica en lugar de una ácida. Además, la cantidad neta de base no cambia durante el transcurso de la reacción redox. La reacción redox global es la siguiente:
Zn + 2MnO 2 → ZnO + Mn 2 O 3
Las baterías alcalinas tienen la ventaja de ser más duraderas y mantener su voltaje mejor, aproximadamente 1.54 V, a lo largo de su vida útil.
Un tipo común de batería, especialmente con la creciente popularidad de los dispositivos electrónicos personales, es la batería de botón (Figura\(\PageIndex{3}\) - Batería de botón). Una batería de botón es una batería pequeña que puede alimentar pequeños dispositivos electrónicos; las baterías pueden ser tan pequeñas como 5 mm de ancho. Dos reacciones redox populares utilizadas para las baterías de botón son la reacción alcalina de celda seca y una reacción basada en óxido de plata:
Zn + Ag 2 O → ZnO + 2Ag
Algunas baterías de botón utilizan una reacción redox basada en litio, tipificada por esta reacción anódica:
Li → Li + + e − E 1/2 = 3.045 V
La reacción redox real depende de la composición del cátodo y es variable dependiendo del voltaje. Las baterías de litio también se pueden utilizar para aplicaciones que requieren más energía, como computadoras portátiles y vehículos eléctricos. Algunas baterías a base de litio son recargables y se pueden usar una y otra vez; tales baterías se llaman baterías secundarias.
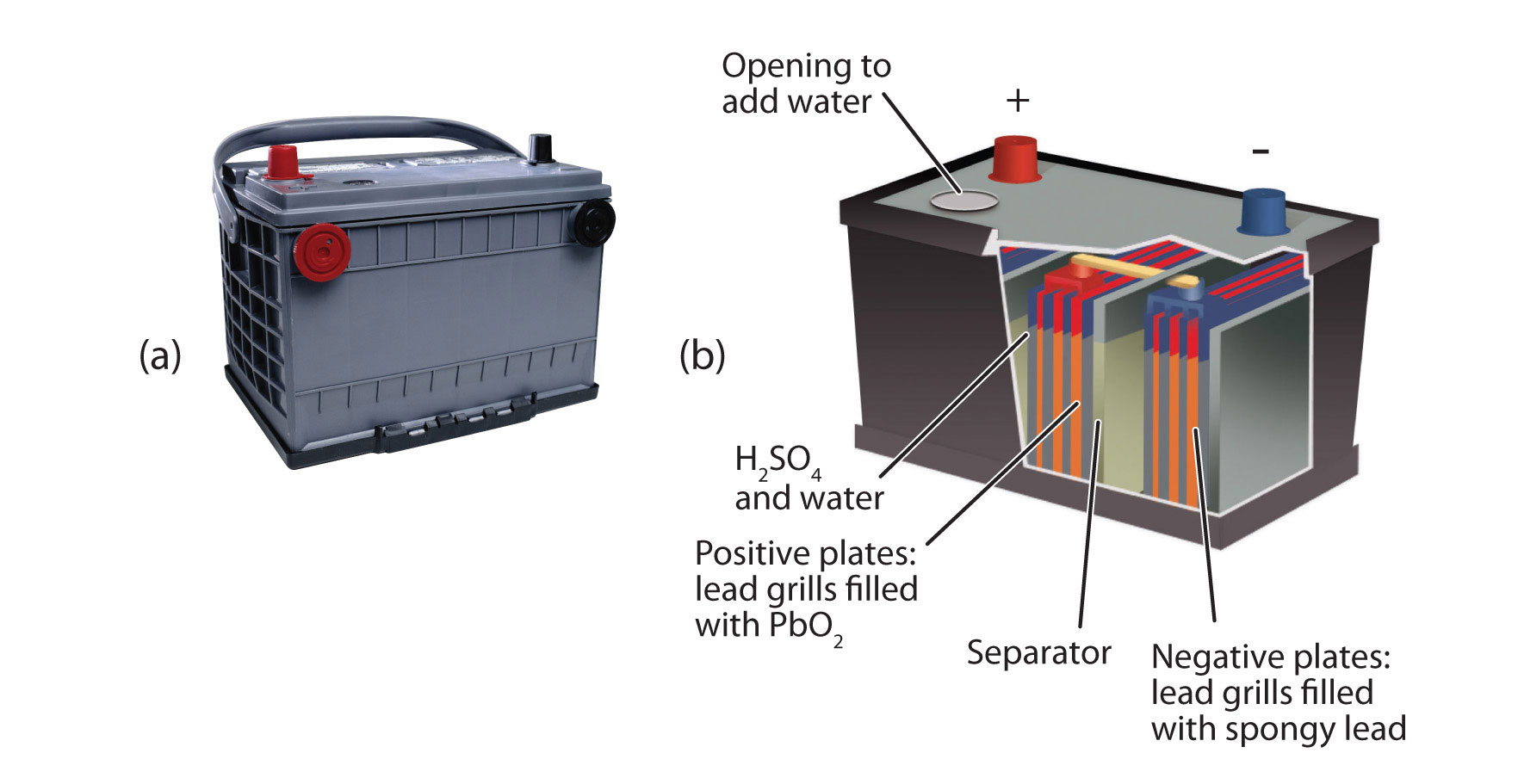
Una batería secundaria importante es la batería de almacenamiento de plomo, que se muestra en la Figura\(\PageIndex{4}\) - Baterías de Almacenamiento de Plomo. La batería de almacenamiento de plomo se basa en esta reacción redox:
Pb + PbO 2 + 4H + + SO 4 2 − → 2PbSO 4 + 2H 2 O
La reacción redox produce alrededor de 2 V, pero es típico unir varias baterías individuales para generar un voltaje mayor. La batería de almacenamiento de plomo tiene la distinción de que el producto de ambas medias reacciones es el PbSO 4, que como un sólido que se acumula en las muchas placas dentro de cada celda. La batería de almacenamiento de plomo es una batería secundaria, ya que se puede recargar y reutilizar muchas veces. Debido a que se basa en plomo, estas baterías son bastante pesadas. También deben reciclarse cuando se reemplazan para que el plomo potencialmente peligroso no escape al medio ambiente. Debido a sus características, las baterías de almacenamiento de plomo se utilizan para arrancar motores grandes en automóviles, embarcaciones y aviones.
Una pila de combustible es un tipo de batería en la que los reactivos fluyen continuamente hacia una cámara de reacción especializada, y los productos fluyen continuamente mientras los electrones se extraen de la reacción. Debido a que todas las reacciones en una pila de combustible consisten en un combustible y un oxidante sometidos a una reacción redox, una introducción de celdas de combustible está en casa en una discusión sobre la química redox.
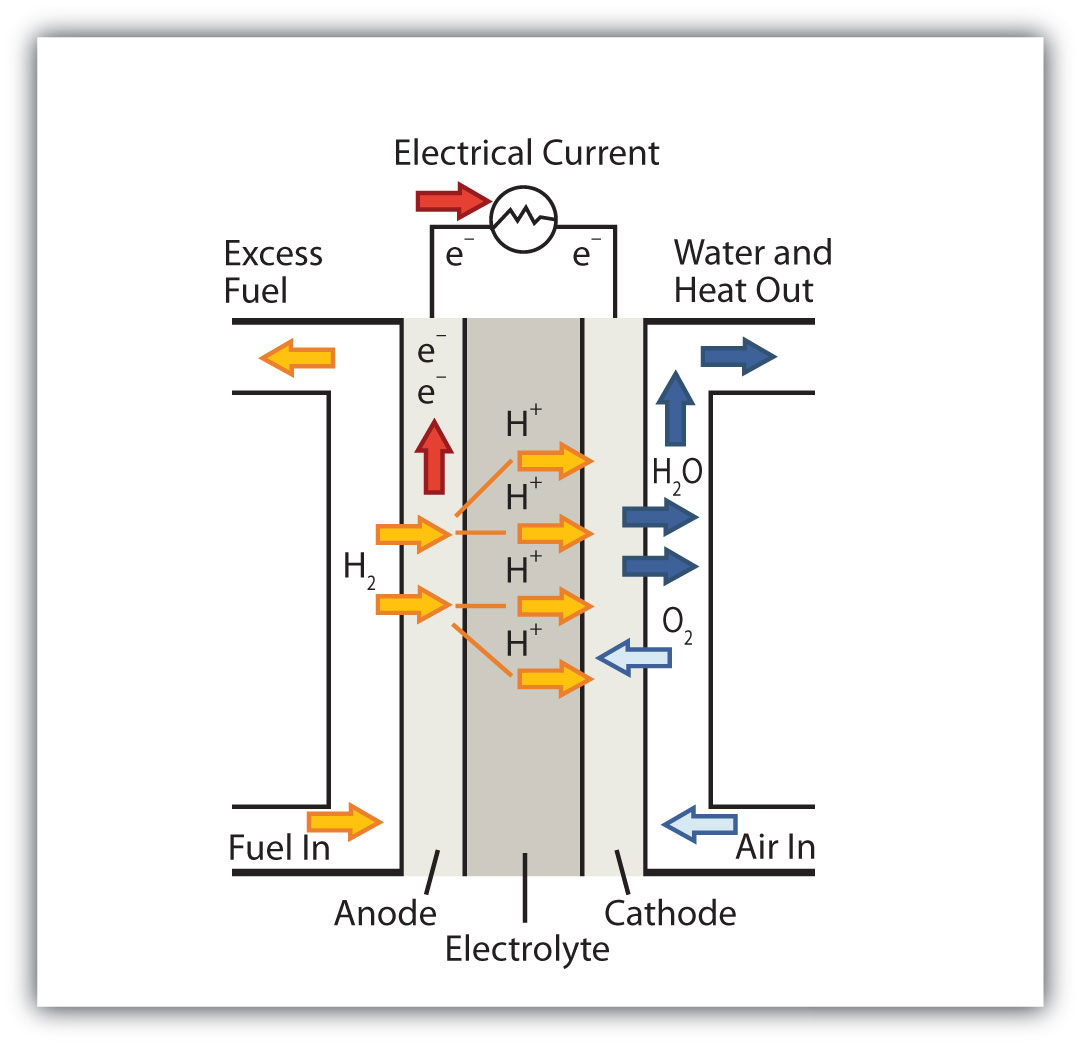
Con mucho, la reacción de pila de combustible más común se basa en hidrógeno y oxígeno:
2H 2 + O 2 → 2H 2 O E = 1.23 V en condiciones estándar
Sin embargo, las pilas de combustible normalmente no funcionan bajo condiciones estándar ni siquiera óptimas, por lo que normalmente generan alrededor de 0.6—0.7 V. En esta pila de combustible, los únicos dos productos son el agua y la electricidad, por lo que la pila de combustible no solo no crea contaminación, sino que también fabrica un subproducto que en algunos ambientes es un mercancía valiosa (agua). Se pueden usar otros combustibles además del hidrógeno; se han desarrollado pilas de combustible que funcionan con metano, alcohol metílico, alcohol etílico, materiales ricos en carbono e incluso magnesio metálico.
Las pilas de combustible a base de hidrógeno fueron y son utilizadas para proporcionar electricidad a los vehículos espaciales tripulados, en parte porque su único producto químico es el agua, que podría ser utilizada para beber. Sin embargo, recientemente ha habido un resurgimiento en el interés por las pilas de combustible debido a su uso potencial en los autos eléctricos. La mayoría de los autos eléctricos funcionan con baterías convencionales, que pueden ser muy pesadas y costosas de reemplazar. Se piensa que las pilas de combustible, en lugar de las baterías convencionales, podrían ser mejores fuentes de electricidad para los automóviles.
Varias barreras actuales para el uso de celdas de combustible en autos eléctricos incluyen capacidad, costo y eficiencia energética general. El Honda FCX 2008, el primer modelo de producción de un vehículo propulsado con una pila de combustible, puede contener 4.1 kg (poco menos de 9 lb) de gas H 2 altamente presurizado y tiene un alcance de 450 km (280 mi). Cuesta alrededor de $120,000—$140,000 construir, lo que hace que el vehículo esté más allá de la capacidad de la mayoría de las personas para poseer. Por último, siempre requiere más energía para producir hidrógeno elemental como combustible que la que puede extraerse del hidrógeno como combustible. Como tal, el hidrógeno se describe como un portador de energía (como la electricidad) en lugar de una fuente de energía (como el petróleo y el gas). Esta distinción señala un argumento fundamental en contra de las pilas de combustible como una “mejor” fuente de energía.

El Honda FCX 2008 fue el primer automóvil de producción en utilizar una pila de combustible como fuente de energía. Sin embargo, el automóvil está en servicio muy limitado debido a su necesidad de cantidades relativamente grandes de hidrógeno elemental como combustible.
A pesar de las limitaciones, existe mucho interés en la investigación sobre pilas de combustible. Si se pueden encontrar formas de eludir sus limitaciones actuales, las celdas de combustible pueden volverse cada vez más comunes como fuentes de energía.
Claves para llevar
- Una célula voltaica produce electricidad a medida que se produce una reacción redox.
- El voltaje de una celda voltaica puede ser determinado por los potenciales de reducción de las medias reacciones.
- Las celdas voltáicas se convierten en baterías, que son una fuente conveniente de electricidad.


