4.12: Formas y propiedades- Moléculas polares y no polares
( \newcommand{\kernel}{\mathrm{null}\,}\)
- Determinar si una molécula es polar o no polar.
Polaridad Molecular
Para determinar si una molécula es polar o no polar, frecuentemente es útil observar las estructuras de Lewis. Los compuestos no polares serán simétricos, lo que significa que todos los lados alrededor del átomo central son idénticos, unidos al mismo elemento sin pares de electrones no compartidos. Observe que una molécula tetraédrica comoCCl4 es la Figura no polar (4.12.1. Otra molécula no polar que se muestra a continuación es trifluoruro de boro, BF 3. BF 3 es una molécula plana trigonal y los tres átomos periféricos son iguales.



Las moléculas polares son asimétricas, ya sea conteniendo pares solitarios de electrones en un átomo central o teniendo átomos con diferentes electronegatividades enlazadas. Esto funciona bastante bien, siempre y cuando se pueda visualizar la geometría molecular. Esa es la parte difícil. Para saber cómo se orientan los vínculos en el espacio, hay que tener un fuerte conocimiento de las estructuras de Lewis y la teoría VSEPR. Suponiendo que lo hagas, puedes mirar la estructura de cada uno y decidir si es polar o no, ya sea que conozcas o no la electronegatividad del átomo individual. Esto se debe a que sabes que todos los enlaces entre elementos disímiles son polares, y en estos ejemplos particulares, no importa en qué dirección estén apuntando los vectores de momento dipolo (hacia fuera o hacia adentro).
Una molécula polar es una molécula en la que un extremo de la molécula es ligeramente positivo, mientras que el otro extremo es ligeramente negativo. Una molécula diatómica que consiste en un enlace covalente polar, tal comoHF, es una molécula polar.
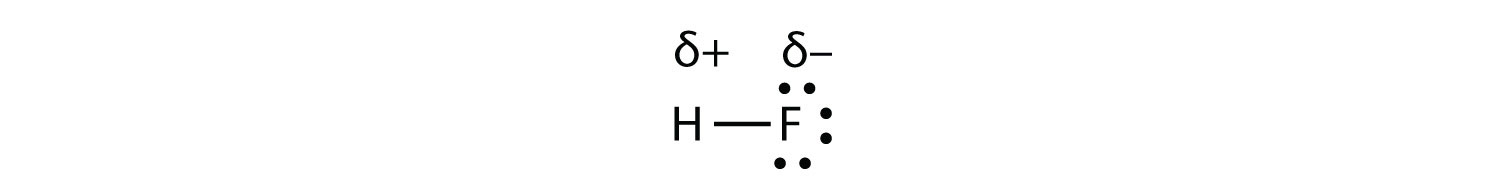
Como se menciona en la sección 4.7, debido a que los electrones en el enlace están más cerca del átomo F, este lado de la molécula adquiere una carga negativa parcial, que está representada por δ− (δ es la letra griega minúscula delta). El otro lado de la molécula, el átomo de H, adopta una carga positiva parcial, la cual está representada por δ+. Las dos regiones cargadas eléctricamente en cada extremo de la molécula se denominan polos, similares a un imán que tiene un polo norte y otro sur. Una molécula con dos polos se llama dipolo (ver figura abajo). El fluoruro de hidrógeno es un dipolo.

Para las moléculas con más de dos átomos, también se debe tomar en cuenta la geometría molecular a la hora de determinar si la molécula es polar o no polar. La siguiente figura muestra una comparación entre dióxido de carbono y agua. (CO2)El dióxido de carbono es una molécula lineal. Los átomos de oxígeno son más electronegativos que el átomo de carbono, por lo que hay dos dipolos individuales que apuntan hacia afuera desde elC átomo hacia cadaO átomo. Sin embargo, dado que los dipolos son de igual fuerza y están orientados de esta manera, se cancelan y la polaridad molecular global deCO2 es cero.
El agua es una molécula doblada debido a los dos pares solitarios en el átomo de oxígeno central. Los dipolos individuales apuntan desde losH átomos hacia elO átomo. Debido a la forma, los dipolos no se cancelan entre sí y la molécula de agua es polar. En la siguiente figura, el dipolo neto se muestra en azul y apunta hacia arriba.
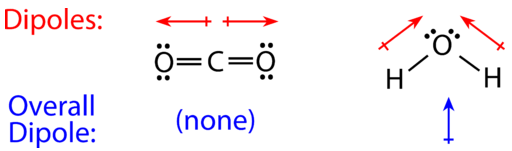
A continuación se muestran otras tres moléculas polares con las flechas apuntando a los átomos más densos de electrones. Al igual que la molécula de agua, ninguno de los momentos de enlace se cancela.

Para resumir, para ser polar, una molécula debe:
- Contienen al menos un enlace covalente polar.
- Tener una estructura molecular tal que la suma de los vectores de cada momento dipolo de enlace no se cancele.
- Dibuja la estructura de Lewis
- Determinar la geometría (usando la teoría VSEPR)
- Visualizar o dibujar la geometría
- Encuentra el momento dipolo neto (no tienes que hacer cálculos si puedes visualizarlo)
- Si el momento dipolo neto es cero, es no polar. De lo contrario, es polar.
Marcar cada uno de los siguientes como polares o no polares.
- Agua, H 2 O:
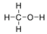
- Metanol, CH 3 OH:
- Cianuro de Hidrógeno, HCN:
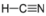
- Oxígeno, O 2:
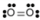
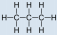
- Propano, C 3 H 8:
Solución
- El agua es polar. Cualquier molécula con pares solitarios de electrones alrededor del átomo central es polar.
- El metanol es polar. Esta no es una molécula simétrica. El−OH lado es diferente de los otros 3−H lados.
- El cianuro de hidrógeno es polar. La molécula no es simétrica. El nitrógeno y el hidrógeno tienen diferentes electronegatividades, creando un tirón desigual en los electrones.
- El oxígeno es no polar. La molécula es simétrica. Los dos átomos de oxígeno tiran de los electrones exactamente en la misma cantidad.
- El propano es no polar, porque es simétrico, conH átomos unidos a cada lado alrededor de los átomos centrales y sin pares de electrones no compartidos.
Marcar cada uno de los siguientes como polares o no polares.
a. SO 3
b. NH 3- Contestar a
-
no polar
- Respuesta b
-
polar
Resumen
- Las moléculas no polares son simétricas sin electrones no compartidos.
- Las moléculas polares son asimétricas, ya sea conteniendo pares solitarios de electrones en un átomo central o teniendo átomos con diferentes electronegatividades enlazadas.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
- StackExchange (thomij).
Henry Agnew (UC Davis)

