4.11: Formas Moleculares- La Teoría VSEPR
( \newcommand{\kernel}{\mathrm{null}\,}\)
- Determinar la forma de moléculas simples e iones poliatómicos.
Las moléculas tienen formas. Existe una abundancia de evidencia experimental a ese efecto, desde sus propiedades físicas hasta su reactividad química. Las moléculas pequeñas (moléculas con un solo átomo central) tienen formas que se pueden predecir fácilmente. La idea básica en las formas moleculares se llama repulsión de pares de electrones de capa de valencia (VSEPR). Básicamente dice que los pares de electrones, al estar compuestos por partículas cargadas negativamente, se repelen entre sí para alejarse lo más posible entre sí. VSEPR hace una distinción entre la geometría del grupo de electrones, que expresa cómo se disponen los grupos de electrones (enlaces y pares de electrones no enlazantes), y la geometría molecular, que expresa cómo se disponen los átomos en una molécula. Sin embargo, las dos geometrías están relacionadas.
Hay dos tipos de grupos de electrones: cualquier tipo de enlace (simple, doble o triple) y pares de electrones solitarios. Al aplicar VSEPR a moléculas simples, lo primero que se debe hacer es contar el número de grupos de electrones alrededor del átomo central. Recuerde que un enlace múltiple cuenta como un solo grupo de electrones.
Cualquier molécula con solo dos átomos es lineal. Una molécula cuyo átomo central contiene solo dos grupos de electrones orienta esos dos grupos lo más lejos posible entre sí, separados 180°. Cuando los dos grupos de electrones están separados 180°, los átomos unidos a esos grupos de electrones también están separados 180°, por lo que la forma molecular general es lineal. Los ejemplos incluyen BeH 2 y CO 2:

Las dos moléculas, mostradas en la siguiente figura en un modelo de “bola y palo”.
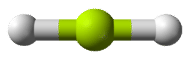
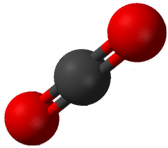
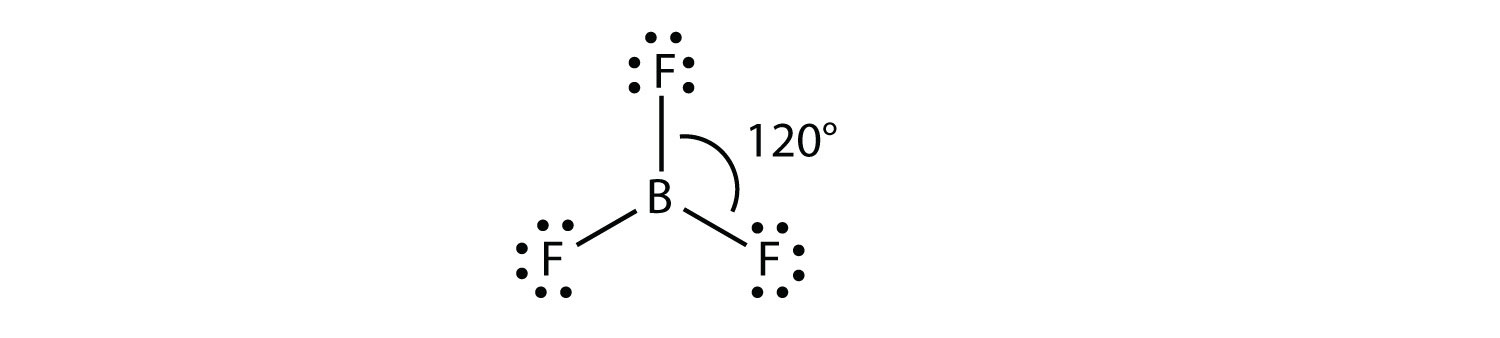
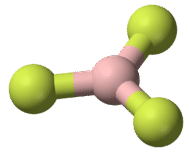
Una molécula con tres grupos de electrones orienta los tres grupos lo más lejos posible. Adoptan las posiciones de un triángulo equilátero—120° de distancia y en un plano. La forma de tales moléculas es plana trigonal. Un ejemplo es BF 3:
Algunas sustancias tienen una distribución de grupos electrónicos planos trigonales pero tienen átomos unidos a solo dos de los tres grupos de electrones. Un ejemplo es GEF 2:
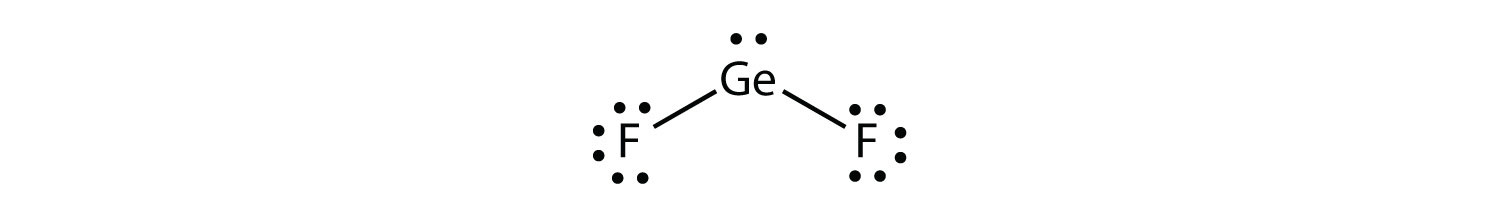
Desde la perspectiva de la geometría del grupo de electrones, el GEF 2 tiene una forma plana trigonal, pero su forma real está dictada por las posiciones de los átomos. Esta forma se llama doblada o angular.
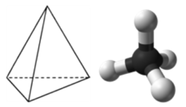
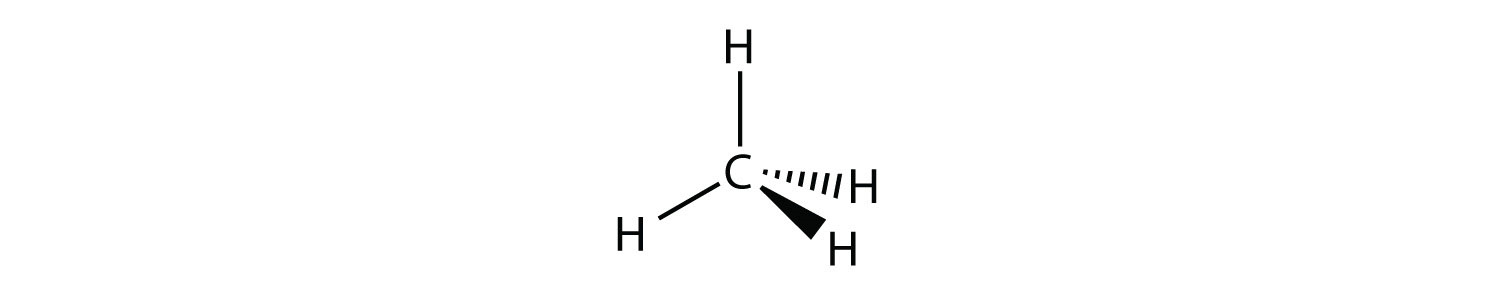
Una molécula con cuatro grupos de electrones alrededor del átomo central orienta los cuatro grupos en la dirección de un tetraedro, como se muestra en la Figura Geometría4.11.1 Tetraédrica. Si hay cuatro átomos unidos a estos grupos de electrones, entonces la forma molecular también es tetraédrica. El metano (CH 4) es un ejemplo.
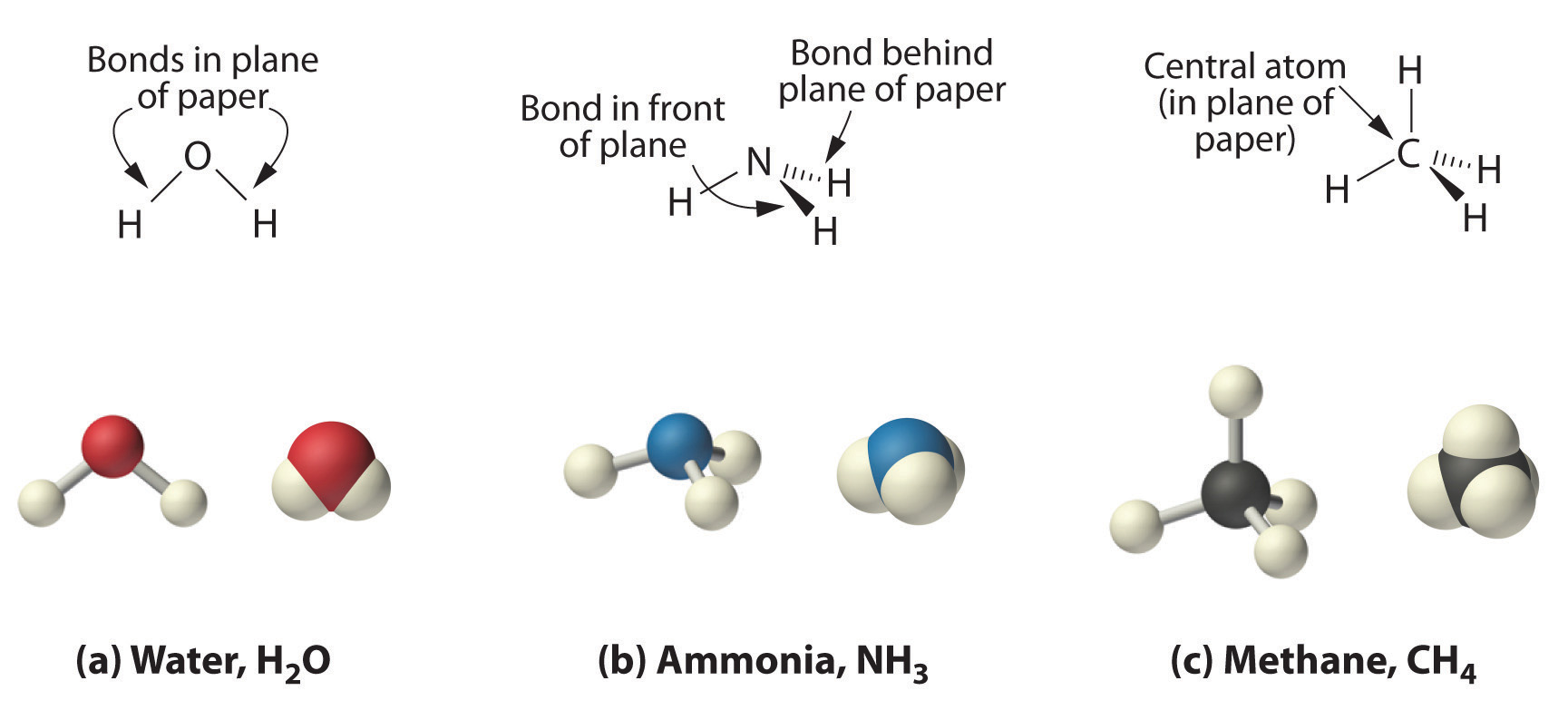
Este diagrama de CH 4 ilustra la convención estándar de mostrar una molécula tridimensional en una superficie bidimensional. Las líneas rectas están en el plano de la página, la línea acuñada sólida sale del plano hacia el lector, y la línea acuñada discontinua sale del plano alejándose del lector.
NH 3 es un ejemplo de una molécula cuyo átomo central tiene cuatro grupos de electrones pero solo tres de ellos están unidos a átomos circundantes.
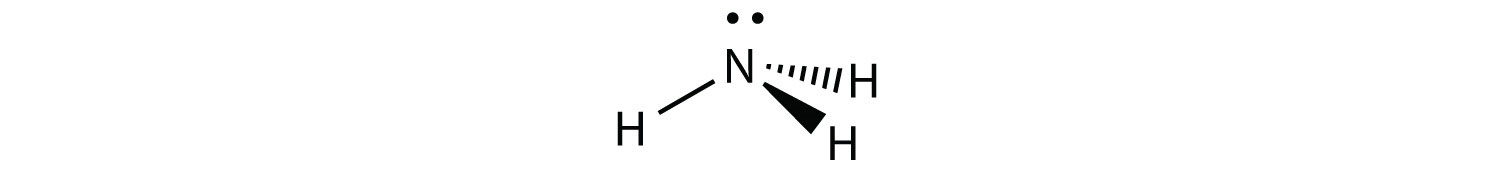
Aunque los grupos de electrones están orientados en forma de tetraedro, desde una perspectiva de geometría molecular, la forma del NH 3 es piramidal trigonal.
H 2 O es un ejemplo de una molécula cuyo átomo central tiene cuatro grupos de electrones pero solo dos de ellos están unidos a átomos circundantes.
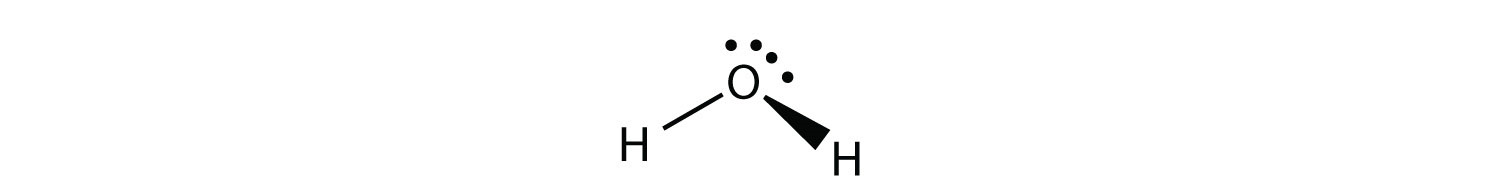
Aunque los grupos de electrones están orientados en forma de tetraedro, la forma de la molécula es doblada o angular. Una molécula con cuatro grupos de electrones alrededor del átomo central pero solo un grupo de electrones unido a otro átomo es lineal porque solo hay dos átomos en la molécula.
Los enlaces dobles o triples cuentan como un solo grupo de electrones. El diagrama de puntos electrónicos de Lewis del formaldehído (CH 2 O) se muestra en la Figura4.11.9.
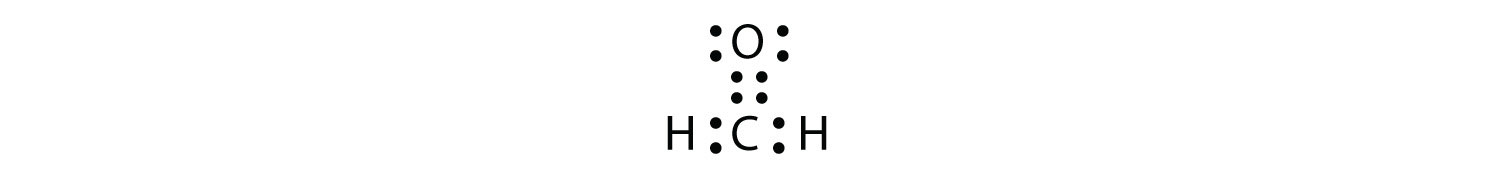
El átomo de C central tiene tres grupos de electrones a su alrededor porque el doble enlace cuenta como un grupo de electrones. Los tres grupos de electrones se repelen entre sí para adoptar una forma plana trigonal.
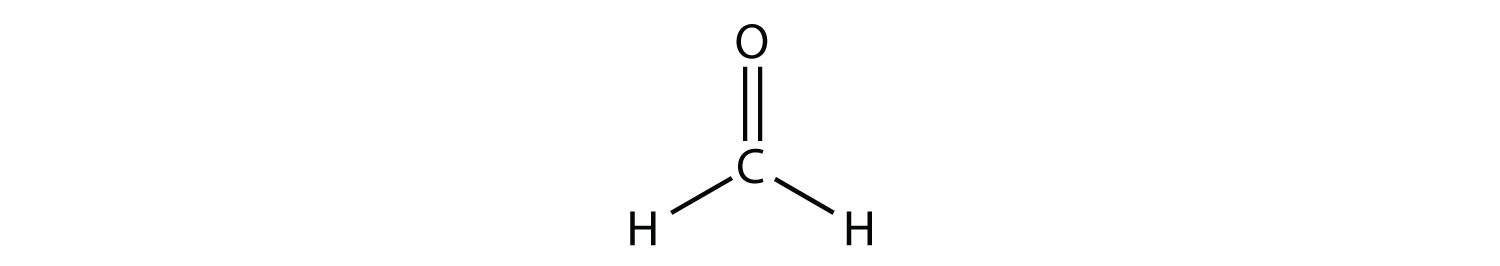
(Los pares de electrones solitarios en el átomo de O se omiten para mayor claridad). La molécula no será un triángulo equilátero perfecto porque el doble enlace C-O es diferente de los dos enlaces C-H, pero tanto plano como triangular describen la forma aproximada apropiada de esta molécula. La figura4.11.11 ilustra varias representaciones de las moléculas de agua, amoníaco y metano.
| Número de grupos de electrones en el átomo central | Número de grupos de unión | Número de Pares Solitarios | Geometría de electrones | Forma Molecular |
|---|---|---|---|---|
| 2 | 2 | 0 | lineal | lineal |
| 3 | 3 | 0 | plano trigonal | plano trigonal |
| 3 | 2 | 1 | plano trigonal | doblada |
| 4 | 4 | 0 | tetraédrico | tetraédrico |
| 4 | 3 | 1 | tetraédrico | piramidal trigonal |
| 4 | 2 | 2 | tetraédrico | doblada |
Figura Estructuras4.11.12: comunes para moléculas e iones Ppoliatómicos que consisten en un átomo central unido a otros dos o tres átomos.
¿Cuál es la forma aproximada de cada molécula?
- PCl 3
- NOF
Solución
El primer paso es dibujar la estructura de Lewis de la molécula.
- Para PCl 3, el diagrama de puntos electrónicos es el siguiente:
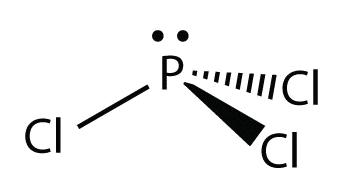
Los pares de electrones solitarios en los átomos de Cl se omiten para mayor claridad. El átomo P tiene cuatro grupos de electrones con tres de ellos unidos a los átomos circundantes, por lo que la forma molecular es piramidal trigonal.
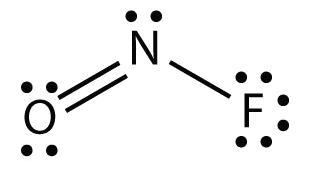
El átomo de N tiene tres grupos de electrones en él, dos de los cuales están unidos a otros átomos. La forma molecular está doblada.
¿Cuál es la forma molecular aproximada de CH 2 Cl 2?
- Contestar
-
Tetraédrico
El etileno (C 2 H 4) tiene dos átomos centrales. Determinar la geometría alrededor de cada átomo central y la forma de la molécula general. Insinuación, el hidrógeno es un átomo terminal.
- Contestar
-
Plano trigonal alrededor de ambos átomos de C centrales
Resumen
La forma aproximada de una molécula se puede predecir a partir del número de grupos de electrones y el número de átomos circundantes.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
- TextMap: Beginning Chemistry (Ball et al.)
Henry Agnew (UC Davis)

