7: Estrategias en la Síntesis Longfolene
( \newcommand{\kernel}{\mathrm{null}\,}\)
La síntesis de Longifolene ha mantenido la fascinación de los químicos orgánicos sintéticos durante varias décadas. Dado que el compuesto estaba disponible en forma pura a partir de fuentes naturales en cantidades suficientes, la fascinación era puramente académica. Durante los estudios de elucidación de la estructura, se observó que esta estructura puenteada sufrió una gran cantidad de reacciones migratorias. Estos reordenamientos fueron de interés tanto desde el punto de vista teórico como práctico. El concepto de 'desconexión' y 'retrosíntesis' que evolucionó alrededor de 1960, condujo al desarrollo de la Lógica en la Síntesis Orgánica durante este periodo. La estructura de Longifolene fue un feliz terreno de exploración para aquellos grandes maestros que estuvieron involucrados en estos desarrollos. Por esta razón la síntesis de Longifolene se ha asociado estrechamente con estos desarrollos. Al analizar tales estructuras, Corey había sugerido algunas 'desconexiones de bonos estratégicos'
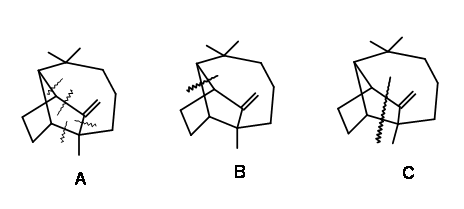
para enfoques lógicos hacia la síntesis (Fig 7.1). Tenga en cuenta que estas sugerencias estaban destinadas a proporcionar pautas y, por lo tanto, no es necesario restringir ninguna novedad adicional. Se señaló además que cualquiera de estas desconexiones podría dar lugar a varios caminos para la construcción de árboles sintéticos. Por ejemplo, consideremos una de esas desconexiones en el enlace 'a' mostrado en la Fig 7.2. Esto podría arrojar cuatro ramas abiertas sobre el árbol sintético. De estos, Corey primero seleccionó la estrategia de Michael porque una de esas ciclaciones ya era conocida en la química de Santonin.
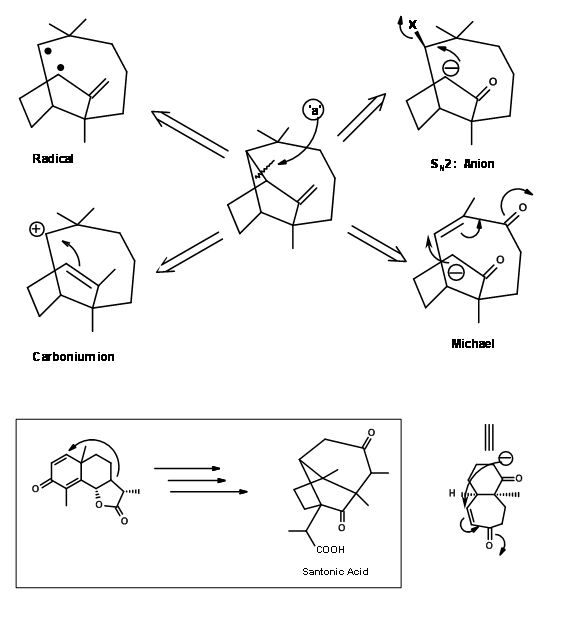
Ejecución de este concepto por Corey (J. Am. Chem. Soc., 83, 2151 (1961); ibid.,86, 478 (1964)) se muestra en la Fig 7.3.
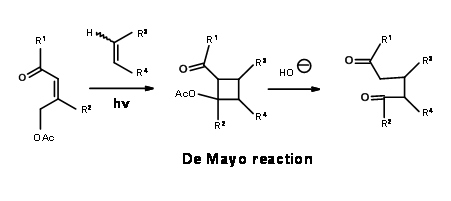
L.W. Oppolzer et.al., configuraron el sistema de anillos longifoleno a través de una transformación de reordenamiento. Hizo uso de la reacción de De Mayo, que es una secuencia de fotociclación — retroaldol que se muestra a continuación (Fig 7.4).
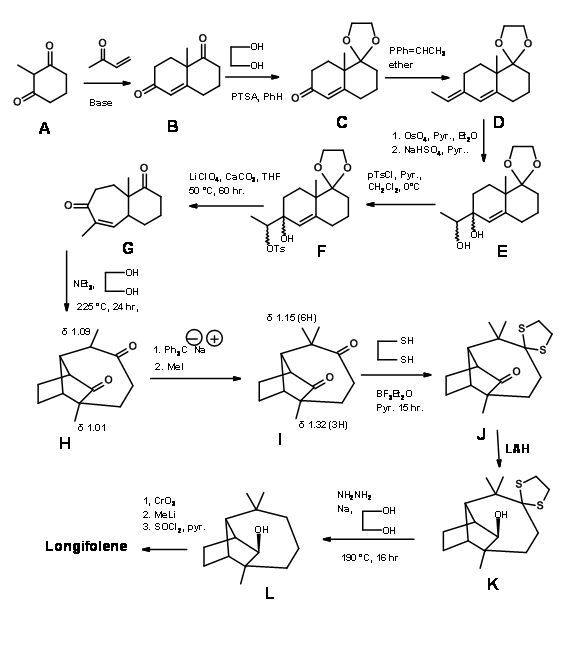
Como se muestra en el esquema sintético Figura 7.5, una reacción de cicloadición [2+2] sobre C dio D, que expuso los componentes retroaldólicos después de una hidrogenólisis. Otra característica útil de esta síntesis es la utilización de la reacción de hidrogenólisis en ciclopropano para exponer un grupo gem-dimetilo. Un material de partida quiral A produjo (+) -Longifoleno con 25% de rendimiento global.
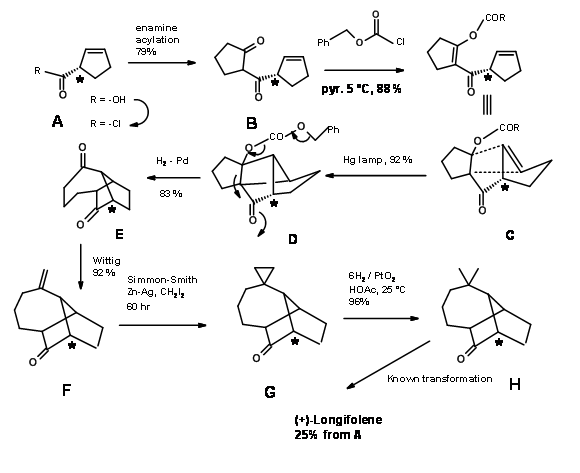
Una estrategia de inserción de carbeno fue reportada por A.G. Schutz et.al., (J. Org. Chem., 50, 915 (1985)). El retroanálisis se muestra en la Figura 7.6.
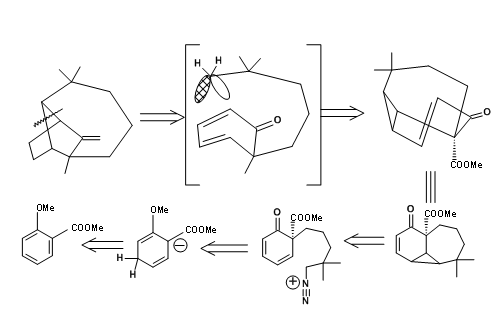
El esquema sintético se muestra en la Figura 7.7.
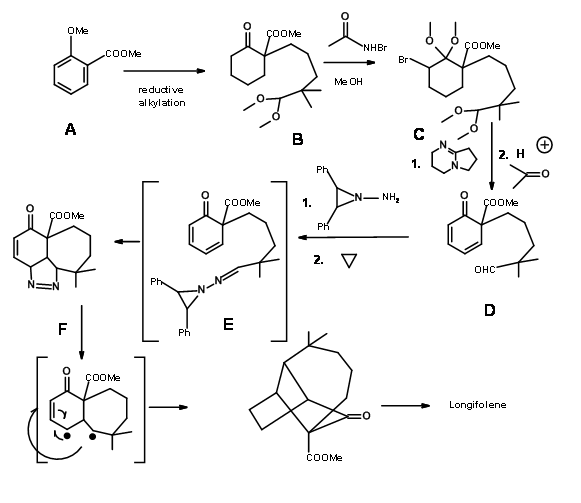
La estrategia de Diels-Alder indicada en la introducción a esta sección sobre Longifolene fue demostrada por Fallis et al., (Fig 7.8)
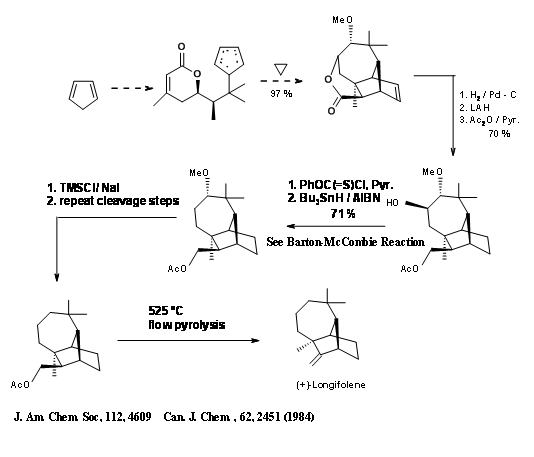
Otra estrategia de Diels-Alder vino de Ho y Liu (Fig 7.9). Obsérvese la utilización de la olefina exo- cíclica al convertir esta unidad en el resto de anillo de siete eslabones requerido.
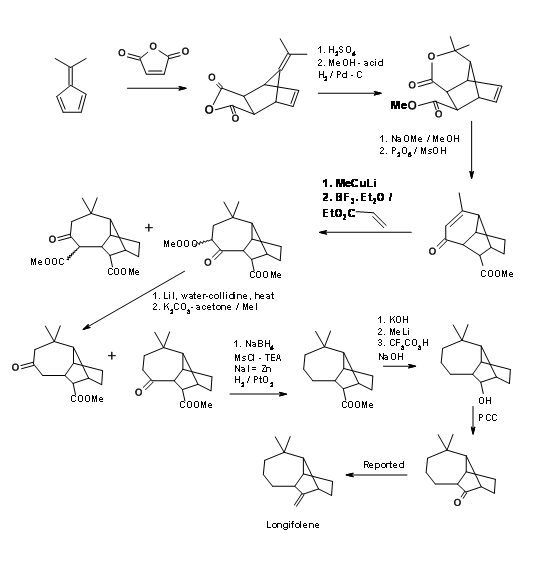
Una estrategia de ciclación catiónica para el esqueleto de Longifolene reportada por la escuela Johnson tiene algunas características interesantes. La Figura 7.10 representa la reacción de ciclación que forma la etapa clave en este esquema.
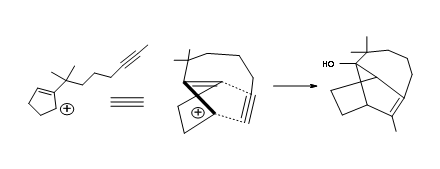
El plano sintético detallado se muestra en la Figura 7.11.
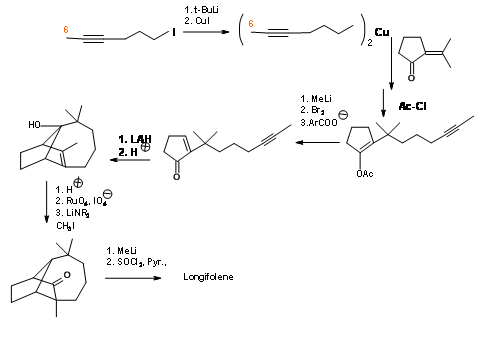
Tenga en cuenta que esta ciclación aún deja el grupo metilo en el carbono equivocado. El grupo -OH no deseado se eliminó mediante una reacción de transferencia de hidruro complejado con ácido de Lewis. La isomerización catalizada por ácido del doble enlace es seguida por una secuencia de hidroxilación-oxidación para exponer un grupo carbonilo. Luego se introdujo el grupo metilo cuaternario vía., un enolato. Se reintrodujo el metileno exocíclico para completar la síntesis.

