8: Estrategias en la Síntesis de Cedrene
( \newcommand{\kernel}{\mathrm{null}\,}\)
Cedreno representa un sesquiterpeno tricíclico muy complejo. Tal complejidad requería enfoques ingeniosos para la síntesis total del sistema de anillos. Existen varias síntesis reportadas para este sistema de anillos. Discutiríamos algunos enfoques. Algunas escisiones de enlaces estratégicos se muestran como líneas discontinuas en la Figura 8.1.
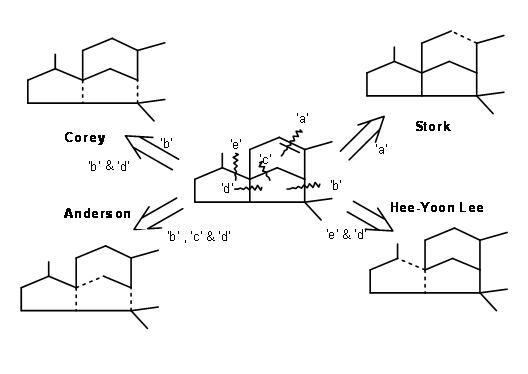
Desconexión en 'a': G. Stork et.al., (J. Am. Chem. Soc., 77, 1078 (1955); ibid, 83, 3114 (1961)) aprovechó que los anillos fusionados de cinco miembros estarían fusionados en cis. Tal sistema tendría una 'fase cóncava' abarrotada. Estas dos características formaron la base de la síntesis de Cedrene de Stork. Su esquema sintético se muestra en la Figura 8.2. La primera alquilación puso en movimiento la salida estérica proviene de los pasos restantes.
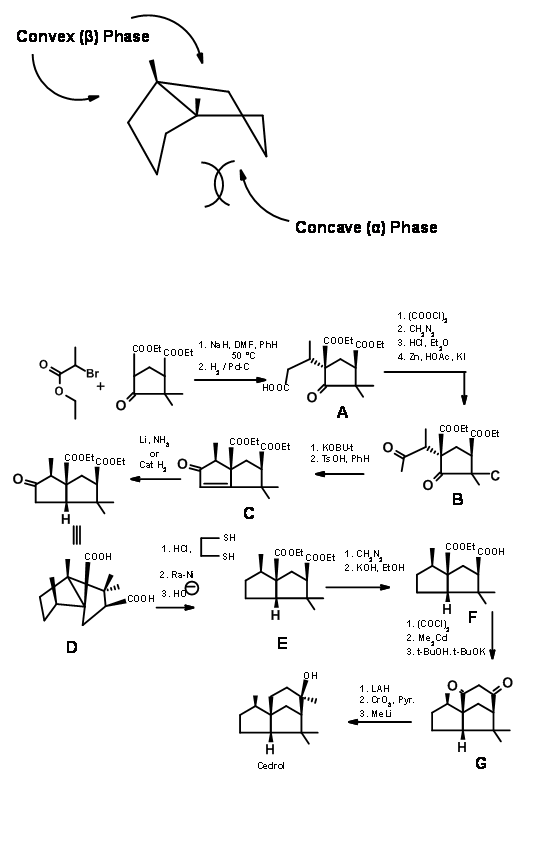
Desconexión en 'b': Para su síntesis de Cedrene de 1969 (J. Am. Chem. Soc., 91, 1557 (1969)), Corey estableció el sistema espiro-anillo (escisión del enlace 'b'). Una p- alquilación de fenolato dio el anillo espiro (J. Am. Chem. Soc., 84, 788 (1962)). La cilización catalizada por Lewis del enolato completó el esqueleto (Figura 8.3).
Desconexión en 'b' y 'd': Basado en el concepto de ciclación biogenética, Corey logró una ciclación en un solo paso de los anillos A y B (Figura 8.4) en un anillo C preformado (Tet. Let., 2455 (1972)). La clave del éxito en este esquema es la formación previa del enlace 'd' seguida de la formación del enlace 'b'. Nótese el papel de una ciclopropil cetona que orquestó el desarrollo de un ion carbonio seguido de un carbanión incipiente para completar los anillos A y B en este orden.
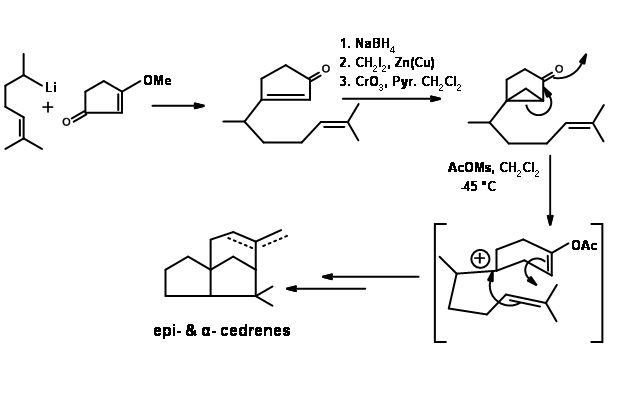
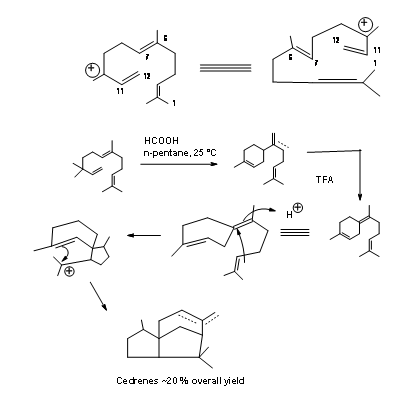
Ciclización de tipo biogenético: Anderson et al reportó una notable ciclación de tipo biogenético de Nerolidol a Cedrene. , (Tet. Let., 2455 (1972). Las ciclaciones podrían realizarse en dos etapas. Con ácido fórmico se forma primero un anillo de seis miembros. Otros tratamientos con ácido trifluoracético completaron la síntesis. El rendimiento general fue muy moderado (Figura 8.5).
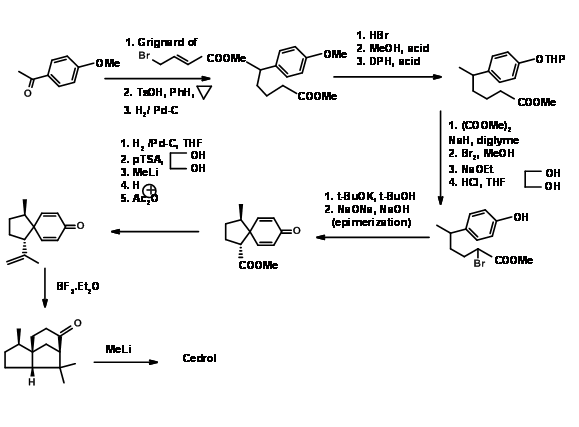
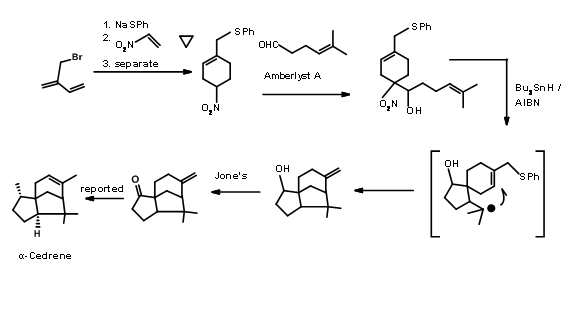
Desconexión en enlaces 'e' y 'd': En la ciclación de tipo biogenético de Anderson, primero se realizó la formación del anillo C de seis miembros. Un sistema de anillos de seis miembros también sirvió como paso clave para la ciclación de radicales libres reportada por Hee-Yoon Lee. La ciclación radical en tándem fue su tema central. Tales ciclaciones radicales han sido reportadas para la síntesis de productos naturales. Hee-Yoon Lee reportó la aplicación de esta estrategia a la síntesis de α-Cedreno (Ter. Let., 7713 (1998)). El éxito de este esquema se basó en dos factores.
- Formación selectiva de un radical para la formación de un enlace 'd' para lograr el anillo B
- El carbono aceptor debe generar un nuevo radical libre en el proceso para completar el anillo A. La primera tarea se logró mediante la incorporación de una unidad de xantano y la segunda tarea crucial se logró a través del grupo., N-aziridinilimina. El esquema sintético se muestra en la Figura 8.6.

Desconexión en 'b' y 'd': Una aproximación de Chen et.al., (Tet. Let., 2961 (1993)) se basó en la reacción de ciclación de radicales libres en un anillo C adecuadamente fuctionalizado (Figura 8.7). La síntesis del anillo C se logra a través de., una reacción DA. La reacción de Knoevenagal colocó la cadena requerida para completar los anillos A y B. La reducción con hidruro de estaño generó un radical libre en el sitio del grupo nitro, el cual se sometió a una ciclación en tándem para completar los anillos A y B en ese orden.
Breitholle et al., reportó un enfoque de Diels-Alder para el esqueleto de cedreno tricíclico, (Can. J. Chem., 54, 1991 (1976) (Figura 8.8). La alquilación de ciclobutadieno a la cadena requerida dio 8.8A después del equilibrio. La reacción DA procedió con 36% de rendimiento para dar una mezcla de isómeros. La cetona 8.8B no sufrió expansión de anillo con diazometano. La expansión del anillo finalmente se logró a través de la metilenamina 8.8C vía diazotación. El hecho de que se formaron dos productos de expansión de anillo 8.8D y 8.8E con 8.8D como el producto principal sugiere que la amina 8.8F era el isómero principal.


