4.4: Combustión. Calores de Reacción. Energías de enlace
- Page ID
- 72728
Todos los hidrocarburos son atacados por el oxígeno a temperaturas elevadas y, si el oxígeno está en exceso, se produce una combustión completa al dióxido de carbono y al agua:
\[ CH_4 + 2O_2 \rightarrow CO_Edit2 + 2H_2O\]
El calor evolucionado en este proceso -el calor de la reacción de combustión\(\Delta H\) - es una medida de la cantidad de energía almacenada en los\(C-H\) enlaces\(C-C\) y del hidrocarburo en comparación con la energía almacenada en los productos, dióxido de carbono y agua. Se puede medir experimentalmente con considerable precisión y generalmente se reporta como\(\Delta H^\text{0}\) la cantidad de calor (en kilocalorías)\(^2\) liberada en la combustión completa de un mol de hidrocarburo cuando los reactivos y los productos se encuentran en estados estándar, y a la misma temperatura, generalmente \(25^\text{o}\). \(^3\)No todas las reacciones químicas que ocurren liberan calor espontáneamente, algunas realmente absorben calor. Por convención,\(\Delta H^\text{0}\) se le da un signo negativo cuando se desprende calor (reacción exotérmica) y un signo positivo cuando se absorbe calor (reacción endotérmica). El calor evolucionado o absorbido también se llama el cambio de entalpía.
Para la combustión\(1 \: \text{mol}\) de metano en\(15^\text{o}\), encontramos por experimento (corregido de volumen constante a presión constante, si es necesario) que la reacción es exotérmica por\(212.8 \: \text{kcal}\). Esta afirmación puede expresarse de la siguiente manera:
\[ CH_4(g) + 2O_2(g) \rightarrow CO_2 (g) + 2H_2O (l)\]
con\(\Delta H^o = -212.8 \, kcal\).
El símbolo\(\left( g \right)\) denota que los reactivos y productos están en estado gaseoso excepto el agua, que es líquida\(\left( l \right)\). Si deseamos tener\(\Delta H^\text{0}\) con agua gaseosa\(H_2O \: \left( g \right)\) como producto tenemos que hacer una corrección para el calor de vaporización del agua (\(10.5 \: \text{kcal} \: \text{mol}^{-1}\)at\(25^\text{o}\)):
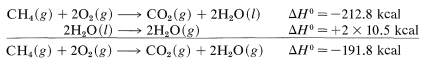
La tarea de medir los calores de todas las reacciones químicas es formidable y casi tan práctica como contar granos de arena en la playa. Sin embargo, es de interés práctico poder estimar calores de reacción, y esto se puede hacer simplemente con la ayuda de energías de enlace. Las energías de enlace necesarias se dan en la Tabla 4-3, y es importante notar que solo se aplican a la disociación completa de sustancias gaseosas a átomos gaseosos en\(25^\text{o}C\). Además, no aplican, sin correcciones adecuadas, a muchos compuestos, como el benceno, que tienen más de un doble enlace. Esta limitación se discutirá en los Capítulos 6 y 21.
Para calcular\(\Delta H^\text{0}\) para la combustión de un mol de metano, primero rompemos los enlaces de la siguiente manera, utilizando\(98.7 \: \text{kcal} \: \text{mol}^{-1}\) para la energía de cada uno de los
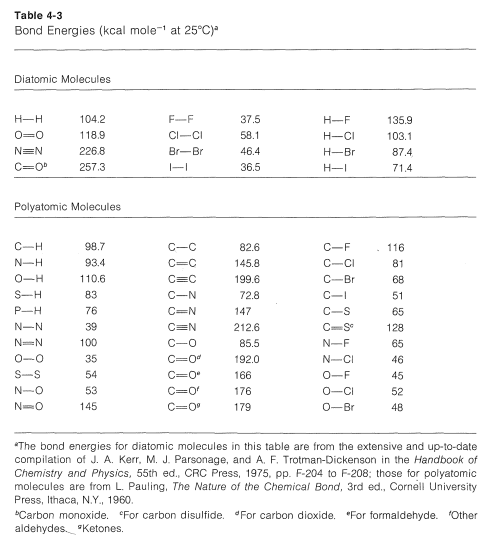
\(C-H\)bonos,
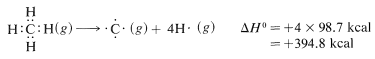
y luego\(118.9 \: \text{kcal} \: \text{mol}^{-1}\) para la energía del doble enlace en oxígeno:
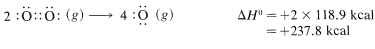
Luego hacemos enlaces, usando\(192 \: \text{kcal} \: \text{mol}^{-1}\) para cada\(O=C\) enlace en dióxido de carbono,
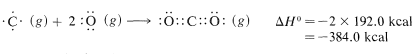
y\(110.6 \: \text{kcal} \: \text{mol}^{-1}\) para cada uno de los\(H-O\) enlaces en el agua:
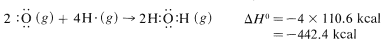
La suma neta de estos\(\Delta H^\text{0}\) valores es\(394.8 + 237.8 - 384.0 - 442.4 = -193.8 \: \text{kcal}\), que es razonablemente cercana al valor de\(-191.8 \: \text{kcal}\) para el calor de combustión de un mol de metano determinado experimentalmente.
El mismo tipo de procedimiento se puede utilizar para estimar\(\Delta H^\text{0}\) valores para muchos otros tipos de reacciones de compuestos orgánicos en la fase de vapor en\(25^\text{o}\). Además, si se dispone de calores apropiados de vaporización, es sencillo calcular\(\Delta H^\text{0}\) las reacciones en fase vapor de sustancias que normalmente son líquidos o sólidos en\(25^\text{o}\). Los problemas especiales que surgen cuando se involucran soluciones y sustancias iónicas se consideran en los Capítulos 8 y 11.
Es importante reconocer que las energías de enlace enumeradas en la Tabla 4-3 para todas las moléculas distintas de las moléculas diatómicas son valores promedio. Que se afirma que la energía de\(C-H\) enlace es\(98.7 \: \text{kcal}\) no significa que, si los hidrógenos del metano se desprendieran uno por uno, se\(98.7 \: \text{kcal}\) tendría que poner en cada paso. En realidad, la evidencia experimental está de acuerdo con energías bastante diferentes para los pasos de disociación separados:
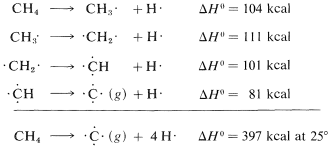
La moraleja es que debemos tratar de evitar el uso de las energías de enlace en la Tabla 4-3 como medida de\(\Delta H^\text{0}\) para la disociación de un solo enlace en una molécula poliatómica. Para ello necesitamos lo que se llaman energías de ligado-disociación, algunas de las cuales se dan en la Tabla 4-6. Los valores dados han sido seleccionados para enfatizar cómo la estructura influye en la energía de enlace. Así, las energías de\(C-H\) enlace en alcanos disminuyen en el orden primario\(>\) secundario\(>\) terciario; asimismo,\(C-H\) los enlaces disminuyen en fuerza a lo largo de la serie\(C \equiv C-H \: > \: C=C-H \: > \: C-C-H\).
¿Qué tan precisos son\(\Delta H^\text{0}\) los valores calculados a partir de las energías Generalmente bastante buenas siempre que las interacciones no enlazadas entre los átomos sean pequeñas y los ángulos de enlace y las distancias estén cerca de los valores normales (Sección 2-2B). En el Cuadro 4-4 se dan algunos ejemplos de calores calculados y experimentales de combustión de algunos hidrocarburos. Las discrepancias negativas representan calores de combustión menores de lo esperado a partir de las energías de enlace promedio y los valores positivos corresponden a calores de combustión mayores de lo esperado.
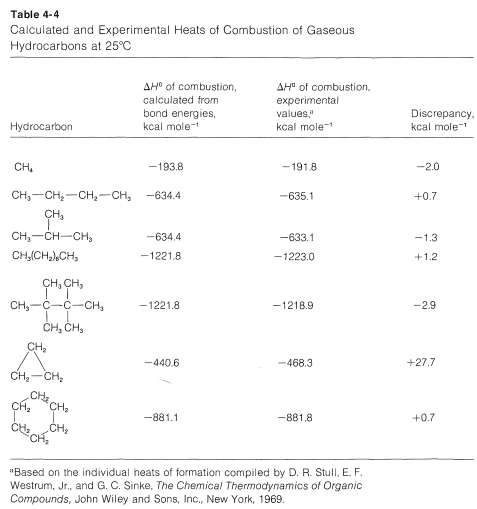
Comparando los isómeros en la Tabla 4-4, vemos que el 2-metilpropano y el 2,2,3,3-tetrametilbutano desprenden menos calor cuando se queman que el butano y el octano, y este es un resultado característico bastante general de la ramificación de la cadena.
El ciclopropano tiene una\(\Delta H^\text{0}\) combustión\(27.7 \: \text{kcal} \: \text{mol}^{-1}\) mayor de lo esperado de las energías de enlace, y esto claramente está asociado con los ángulos de\(C-C-C\) unión anormales en el anillo. Estos asuntos serán discutidos en detalle en el Capítulo 12. Para el ciclohexano, que tiene ángulos de unión normales, el calor de combustión es cercano al valor calculado.
\(^2\)En este libro utilizamos kilocalorías en lugar de los julios actualmente recomendados (SI) para unidades de energía. A la fecha de redacción, no está claro qué tan general será el uso del joule entre los químicos. Para convertir calorías a julios (o\(\text{kcal}\) a\(\text{kJ}\)), multiplica por 4.184.
\(^3\)Quizás te preguntes cómo puede ocurrir una reacción, como la combustión de metano, en\(25^\text{o}\). El hecho es que la reacción se puede llevar a cabo a cualquier temperatura deseada. Lo importante es que el\(\Delta H^\text{0}\) valor del que estamos hablando aquí es el calor liberado o absorbido cuando comienzas con los reactivos en\(25^\text{o}\) y terminas con los productos en\(25^\text{o}\). Siempre y cuando\(\Delta H^\text{0}\) se defina de esta manera, no importa a qué temperatura se produzca realmente la reacción. Los estados estándar para los gases son presión\(1 \: \text{atm}\) parcial. Los estados estándar para líquidos o sólidos suelen ser el líquido puro o sólido a presión\(1 \: \text{atm}\) externa.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


