6.6: Resonancia
- Page ID
- 73514
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
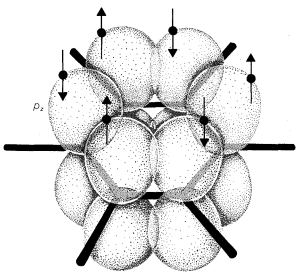
Un modelo atómico-orbital de benceno
Hasta ahora, hemos discutido la unión sólo en términos de pares de electrones asociados con dos núcleos. A estos podemos llamar electrones localizados. De hecho, los electrones de unión pueden asociarse con más de dos núcleos, y hay una medida de estabilidad que se puede ganar por esto porque el grado de unión aumenta cuando los electrones pueden distribuirse sobre un volumen mayor. Este efecto a menudo se llama deslocalización de electrones o resonancia. Es importante sólo si los orbitales atómicos componentes se superponen significativamente, y esto dependerá en gran parte de la geometría molecular.
El ejemplo clásico de resonancia lo proporciona la\(\pi\) unión del benceno. Este compuesto se mostró en el Capítulo 1 que tenía la fórmula molecular\(C_6H_6\), ser plano y hexagonal con ángulos de enlace de\(120^\text{o}\), y poseer seis\(C-C\) enlaces equivalentes y seis\(C-H\) enlaces equivalentes. El benceno generalmente se escribe con una fórmula estructural propuesta por Kekulé:
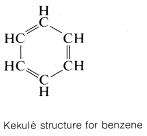
Que el benceno es más estable que una sola estructura de Kekulé, o 1,3,5-ciclohexatrieno, se puede medir comparando el calor experimental de combustión
de benceno con el valor calculado basado en las energías de enlace promedio de la Tabla 4-3:
\[\ce{C6H6(g) + 15/2 O2 -> 6CO2(g) + 3H2O(g)}\]
con
\ [\ begin {alineado}
&\ Delta H_ {\ exp} ^ {0} =-789\ mathrm {kcal}\\
&\ Delta H_ {\ text {calc}} ^ {0} =-827\ mathrm {kcal}
\ end {alineado}\]
Se libera aproximadamente\(38 \: \text{kcal}\) menos energía en la combustión que la calculada. El benceno, por lo tanto, es\(38 \: \text{kcal mol}^{-1}\) más estable de lo que predice la estructura del ciclohexatrieno.

Representación de Resonancia
Los modelos atómico-orbitales, como el que se muestra para el benceno, son descripciones útiles de unión a partir de las cuales evaluar el potencial de deslocalización de electrones. Pero son engorrosos de dibujar rutinariamente. Necesitamos una representación más simple de la deslocalización de electrones.
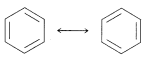
El método que comúnmente se usa es dibujar un conjunto de estructuras, cada una de las cuales representa una manera razonable en la que podrían aparearse los electrones (generalmente en\(p\) orbitales). Si se puede escribir más de una estructura de este tipo, la molécula, ion o radical real tendrá propiedades correspondientes a algún híbrido de estas estructuras. \(\leftrightarrow\)Se escribe una flecha de doble punta entre las estructuras que consideramos que contribuyen al híbrido. Por ejemplo, las dos formas de Kekulé son dos posibles esquemas de emparejamiento de electrones o estructuras de enlace de valencia que podrían contribuir al híbrido de resonancia del benceno:
Es muy importante saber qué atributos tiene que tener un conjunto razonable de estructuras de enlace de valencia para contribuir a una estructura híbrida. Es igualmente importante entender qué es y qué no implica escribir un conjunto de estructuras. Por lo tanto destacaremos los principales puntos a recordar en el resto de esta sección.
1. Los miembros de un conjunto de estructuras, como las dos estructuras Kekulé para benceno, no tienen realidad individual. Son estructuras hipotéticas que representan diferentes esquemas de emparejamiento de electrones. No debemos pensar en el benceno como una mezcla 50:50 de formas Kekulé equilibrantes.
2. Para ser razonable, todas las estructuras de un conjunto que representan un híbrido de resonancia deben tener exactamente las mismas ubicaciones de los átomos en el espacio. Por ejemplo, la fórmula\(7\) no representa un miembro válido del conjunto de estructuras de enlace de valencia del benceno, porque los átomos de\(7\) tienen diferentes posiciones de las del benceno (por ejemplo, no\(7\) es plana):

La estructura\(7\) en realidad representa un\(C_6H_6\) isómero conocido que tiene una química muy diferente a la del benceno.
3. Todos los miembros del conjunto deben tener el mismo número de electrones emparejados o desapareados. Para el estado normal del benceno, los seis\(\pi\) electrones tienen tres de un giro y tres del otro. Estructuras como\(8\), con cuatro electrones de un espín y dos del otro, no son contribuyentes válidos al estado fundamental del benceno:
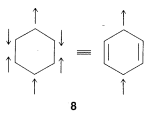
4. La importancia de la resonancia en cualquier caso dependerá de las energías de las estructuras contribuyentes. Cuanto más bajos y casi equivalentes sean los miembros del conjunto en energía, más importante se vuelve la resonancia. Es decir, la estabilización de electrones es mayor cuando hay dos o más estructuras de menor energía (como para las dos estructuras Kekulé del benceno). Como corolario, es menos probable que la estructura de una molécula esté representada satisfactoriamente por una fórmula estructural convencional cuando se pueden escribir dos (o más) estructuras energéticamente equivalentes de baja energía.
5. Si solo hay una estructura de baja energía en el conjunto entonces, a una primera aproximación, al híbrido de resonancia se le pueden asignar propiedades como las esperadas para esa estructura. Como ejemplo, mostramos tres posibles esquemas de emparejamiento para eteno\(9\),\(10\), y\(11\):
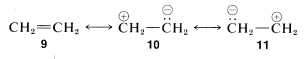
Si bien\(10\) y\(11\) son equivalentes, son mucho mayores en energía que\(9\) (ver discusión en la Sección 4-4C). Por lo tanto, no contribuyen sustancialmente a la estructura del eteno que mejor se representa por\(9\).
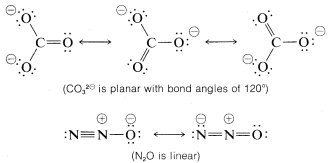
La resonancia no se limita de ninguna manera a moléculas orgánicas. Los siguientes conjuntos de estructuras de enlace de valencia representan las estructuras híbridas de ion nitrato\(NO_3^\ominus\)\(CO_3^{2 \ominus}\), ion carbonato y óxido nitroso\(N_2O\). Estos son sólo ejemplos representativos. Le sugerimos que revise estas estructuras cuidadosamente para verificar que cada miembro de un conjunto se ajuste a las reglas generales de resonancia resumidas anteriormente.

Con frecuencia se utiliza una notación taquigráfica de estructuras híbridas en la que la\(\pi\) unión deslocalizada se muestra como una línea discontinua. Para el benceno, también se usa un círculo inscrito para indicar la\(\pi\) unión continua:
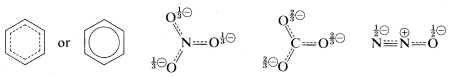
Resonancia y Reactividad
La deslocalización de electrones es un factor importante en la reactividad (o falta de ella) de las moléculas orgánicas. Como ejemplo, recordemos del Capítulo 4 que las energías de enlace de varios tipos de\(C-H\) enlaces difieren considerablemente (ver Cuadro 4-6). En particular, el\(C-H\) enlace metilo en propeno es aproximadamente\(9 \: \text{kcal}\) más débil que el\(C-H\) enlace metilo del etano o propano, y esta diferencia puede explicarse por el uso del concepto de resonancia. Están involucradas las siguientes disociaciones de enlaces:


la deslocalización es posible para el radical propilo, propano o propeno. En consecuencia, la fuerza del\(C-H\) enlace metilo en propeno es menor que en propano debido a la estabilización del radical 2-propenilo.
La discusión anterior se suma más a nuestra comprensión de la selectividad observada en las reacciones de halogenación discutidas en el Capítulo 4. Cuando el propeno es clorado a la luz solar, el producto es 3-cloropropeno, y podemos explicar esto sobre la base de que la reacción radical-cadena implica etapas de propagación en las que un átomo de cloro ataca al hidrógeno correspondiente al\(C-H\) enlace más débil:

La teoría de la resonancia es muy útil para contabilizar, y en muchos casos predecir, el comportamiento de sustancias con\(\pi\) enlaces. Sin embargo, no es omnipotente. Un ejemplo donde falla es el ciclobutadieno, para lo cual podemos escribir dos estructuras equivalentes de enlace de valencia correspondientes a las estructuras de Kekulé para benceno:
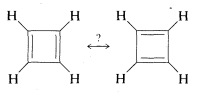
A pesar de esto, el ciclobutadieno es una sustancia extremadamente inestable, reaccionando consigo mismo casi instantáneamente a temperaturas superiores\(-250^\text{o}\). Para una mejor comprensión de este y algunos problemas relacionados, proporcionamos una discusión más detallada sobre la deslocalización de electrones en el Capítulo 21.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


