11.8: Alquinos terminales como ácidos
- Page ID
- 73688
Una reacción característica y sintéticamente importante del etino y 1-alquinos es la formación de sal (“acetilida”) con bases muy fuertes. En tales reacciones los alquinos se comportan como un ácido en el sentido de que renuncian a protones a bases adecuadamente fuertes:
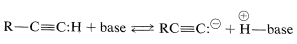
El agua es una base demasiado débil para aceptar protones de alquinos; en consecuencia, no\(\ce{H_3O}^\oplus\) se espera una concentración medible de la ionización de alquinos en soluciones acuosas diluidas. Por lo tanto, no tenemos ninguna medida cuantitativa de la acidez de 1-alquino en solución acuosa aparte de que probablemente sea aproximadamente\(10^{10}\) veces menos ácida que el agua, como se juzga a partir de mediciones en otros solventes que se discutirán en breve. En la fase gaseosa, sin embargo, la situación se invierte, y el etino es un ácido más fuerte que el agua:
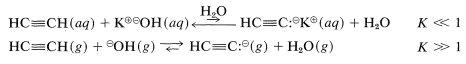
Esta inversión es de poco valor práctico debido a que las reacciones orgánicas que involucran iones normalmente no se llevan a cabo en fase gaseosa. Sin embargo, debería alertarnos del tremendo papel que juegan los solventes en la determinación de las acideces por sus habilidades (algunas mucho más que otras) para estabilizar iones por la propiedad conocida como solvatación. (Sección 11-8A.)
El amoníaco líquido es un disolvente más útil que el agua para la preparación de sales de 1-alquino. Una cantidad sustancial del alquino se puede convertir en la base conjugada por aniones amida (amida de potasio o sodio) porque un 1-alquino es un ácido más fuerte que el amoníaco.
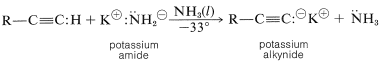
La acidez del hidrógeno terminal en 1-alquinos proporciona una prueba simple y útil para 1-alquinos. Con solución de plata-amoníaco (\(\ce{AgNO_3}\)en amoníaco acuoso), los 1-alquinos dan sales insolubles de plata, mientras que los alquinos disustituidos no:

Los “acetiluros” de plata parecen tener enlaces carbono-metal sustancialmente covalentes y son menos iónicos que los alquínidos de sodio y potasio. La solución de plata-amoníaco se puede utilizar para precipitar 1-alquinos de mezclas con otros hidrocarburos. Los 1-alquinos se regeneran fácilmente a partir de los precipitados de plata por tratamiento con ácidos inorgánicos fuertes. Cabe señalar, sin embargo, que los alquinidos de plata pueden ser sensibles a los golpes y pueden descomponerse explosivamente, especialmente cuando están secos.
Termodinámica de Solvación de Iones y Su Importancia
Se puede obtener alguna idea de la importancia de la solvatación a partir de la calculada\(\Delta H\) para el siguiente proceso:
\[ \ce{Na^+ (g) + Cl^- (g) \rightarrow Na^+ (aq) + Cl^- (aq)}\]
con\(Delta H^o = -187\,kcal\).
Las energías de solvatación de los iones son tan grandes que diferencias relativamente pequeñas para diferentes iones pueden tener un efecto muy grande en las constantes de equilibrio. Así, la relación entre las acidedades relativas de etino y agua en la fase gaseosa y en agua de\(10^{12}\) corresponde\(25^\text{o}\) a una\(\Delta G^0\) diferencia global en las energías de solvatación de aproximadamente\(16 \: \text{kcal}\), que es menor que\(10\%\) de las energías de solvatación totales de los iones. Otras dificultades surgen debido a las diferencias entre las energías de solvatación y las interacciones entre los iones en diferentes disolventes. Por lo tanto, se ha encontrado que las acidedades de los 1-alquinos con respecto a otros ácidos cambian por un factor de\(10^{11}\) en diferentes disolventes. Por esta razón, debemos ser particularmente cuidadosos al comparar las velocidades y constantes de equilibrio de las reacciones iónicas para tener debidamente en cuenta los efectos de solvatación e interacción iónica.
Una excelente regla general es que, siendo otras cosas iguales, los iones grandes son más estables que los iones pequeños en la fase gaseosa, siendo lo contrario cierto en los disolventes polares, donde los iones pequeños están más fuertemente solvatados (por lo tanto, más estables) que los iones grandes. A modo de comparación,
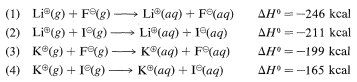
De (1) menos (3), la energía de solvatación del gaseoso\(\ce{Li}^\oplus\) es\(47 \: \text{kcal mol}^{-1}\) mayor que\(\ce{K}^\oplus\); y de (1) menos (2), la de\(\ce{F}^\ominus\) es\(35 \: \text{kcal mol}^{-1}\) mayor que la de\(\ce{I}^\ominus\). Tales diferencias en las energías de solvatación pueden tener efectos considerables sobre la reactividad, y tal vez recuerdes de la Sección 8-7E que\(\ce{F}^\ominus\) es un nucleófilo más débil que\(\ce{I}^\ominus\), en gran parte debido a su mayor energía de solvatación.
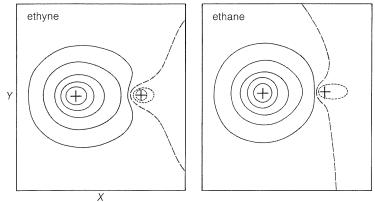
¿Por qué el etino es un ácido más fuerte que el etano o el eteno?
Si comparamos las fuerzas ácidas de los hidrocarburos simples, encontramos que el etino es sustancialmente más ácido que el eteno o el etano en fase gaseosa o en solución. ¿Por qué es esto? La explicación más simple es que existe una conexión directa entre la\(\ce{C-H}\) acidez y la cantidad de\(s\) carácter asociado con el orbital de carbono de\(\sigma\) unión. Al igual que otras cosas, la acidez aumenta con el\(s\) carácter creciente en la órbita de carbono.

Aniones alquínidos como nucleófilos
Los 1-alquinos son ácidos muy débiles, de ahí que sus bases conjugadas\(\ce{RC \equiv C}^\ominus\),, son bases bastante fuertes. Estos aniones también son nucleófilos de carbono reactivos, y es esta propiedad la que los hace útiles para la síntesis orgánica. Recordemos del Capítulo 8 que una de las reacciones orgánicas más generalmente útiles es una reacción de desplazamiento en la que un nucleófilo aniónico,\(\ce{Nu}^\ominus\), ataca a un derivado alquílico\(\ce{RX}\),, para desplazar\(\ce{X}^\ominus\) y formar un nuevo enlace entre el carbono y el nucleófilo:

El grupo desplazado\(\ce{X}\) a menudo es un ion haluro (cloruro, bromuro o yoduro), y si el nucleófilo entrante\(\ce{Nu}^\ominus\) es un anión alquínido, la reacción conduce a la formación de un enlace carbono-carbono:
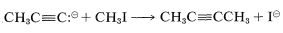
Con aquellos\(\ce{RX}\) derivados que experimentan desplazamiento nucleofílico fácilmente, este es un método general de formación de un\(\ce{C-C}\) enlace, lo que conduce a alquinos sustituidos. Las sales alquínidas generalmente utilizadas son las de litio, sodio, potasio o magnesio.
Reacciones de acoplamiento de alquinos
Otra reacción de 1-alquinos que extiende la cadena carbonada es una reacción de acoplamiento en la que el alquino se dimeriza bajo la influencia de una sal cuprosa, generalmente cloruro de amonio cuproso:
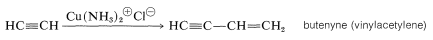
Esta adición de una molécula de alquino a otra es formalmente análoga a la dimerización de alquenos bajo la influencia del ácido sulfúrico (ver Sección 10-9), pero los mecanismos son bastante diferentes.
Si la reacción se lleva a cabo en presencia de un agente oxidante, tal como\(\ce{O_2}\) o una sal cúprica disuelta en piridina (una base débil), se obtiene un producto diferente. Bajo estas condiciones, se produce el acoplamiento oxidativo para dar un diino conjugado:
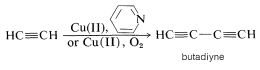
Si bien no se conocen los detalles de los mecanismos de estas reacciones alquinos, es probable que la capacidad de los 1-alquinos para formar enlaces carbono-metal con metales como el cobre sea un factor clave. Otras reacciones de acoplamiento oxidativo ocurren con los metales de transición, y esto se discutirá en detalle en el Capítulo 31.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


