5.6: Reacciones de dihidroxilación, aminohidroxilación y aziridinación
( \newcommand{\kernel}{\mathrm{null}\,}\)
5.6.1 Reacción de dihidroxilación
En 1980 apareció el primer intento de cis-dihidroxilación enantioselectiva de alquenos con tetróxido de osmio. Los esfuerzos continuos posteriores condujeron a mejorar el rendimiento de la reacción y la enantioselectividad en presencia de complejos alcaloides de osmio-cinchona (Esquema5.6.1). Las reacciones se pueden realizar en condiciones ambientales en un sistema bifásico líquido-líquido que tiene agua y t-BuOH empleando oxidante secundario tal como K 3 Fe (CN) 6 para proporcionar los 1,2-cis-dioles diana con alta enantioselectividad. Consulte el Módulo I, Reactivos y Reacciones Orgánicas, para conocer el mecanismo.
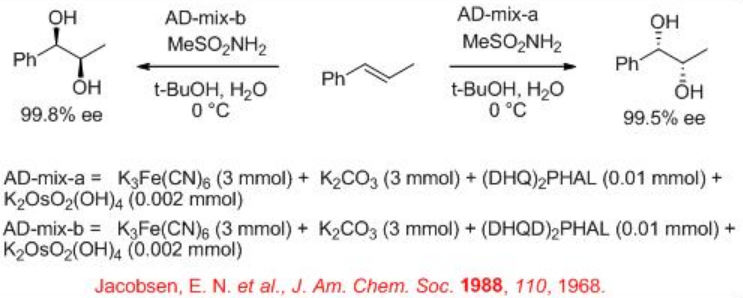
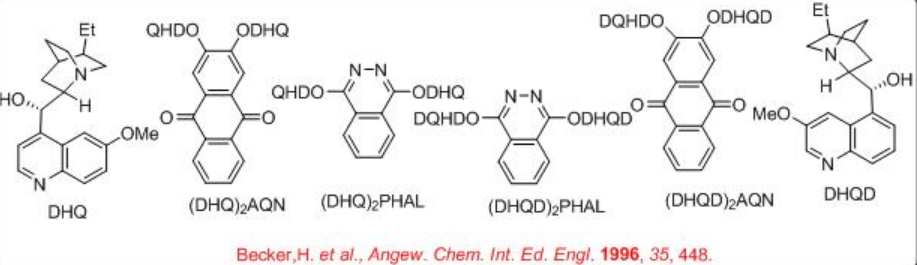
K 3 Fe (CN) 6 se utiliza como oxidante para reoxidar el Os (VI) después de cada ciclo catalítico. Dado que el OsO 4 es volátil y tóxico, el osmio generalmente se agrega como K 2 OsO 2 (OH) 4, que forma OsO 4 en la mezcla de reacción. K 2 CO 3 y metanosulfonamida (MESO 2 NH 2) se utilizan como aditivos para mejorar la velocidad de la reacción. El Esquema 2 resume algunos de los ligandos exitosos basados en alcaloides de cinchona para las reacciones de dihidroxilación asimétrica. El enfoque del grupo hidroxilo se dirige tanto a la cara superior como a la cara inferior del alqueno que depende de la naturaleza de los ligandos, DHQD o DHQ, se utilizan.
En paralelo a los procesos catalíticos descritos anteriormente, se ha demostrado el uso del ligando L basado en 1,2-diamina bidentado ópticamente activo en lugar de alcaloide como fuente quiral para la dihidroxilación asimétrica de alquenos usando OsO 4 (Esquema5.6.3). Las reacciones de una serie de alquenos se pueden lograr con un rendimiento y enantioselectividad de buenos a excelentes.
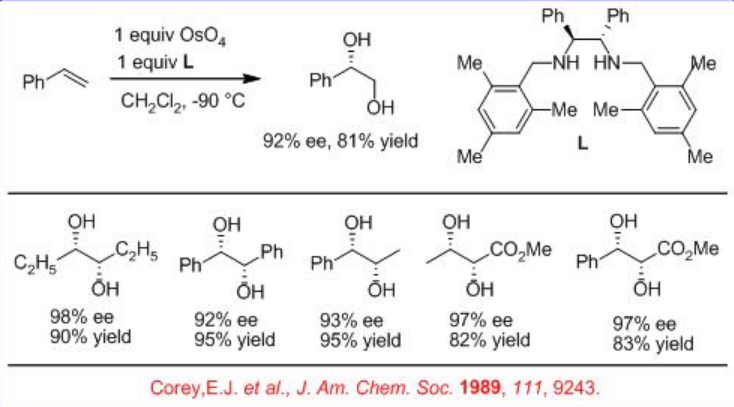
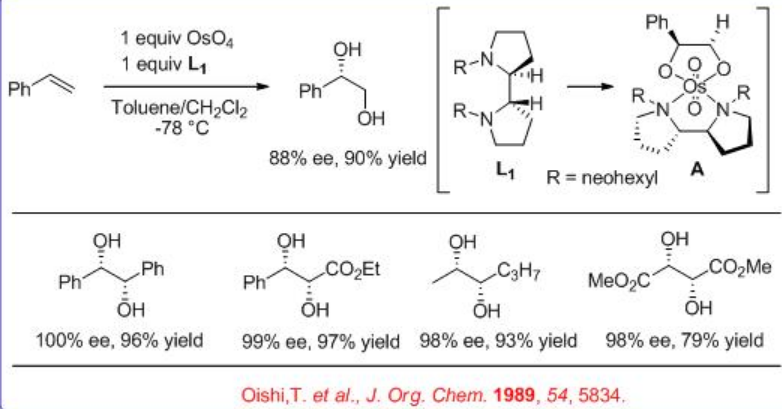
Además, se encuentra que el ligando bidentado L 1 es efectivo para la dihidroxilación mediada por OsO 4 de alquenos trans-disustituidos y monosustituidos (Esquema5.6.4). Se cree que la reacción implica el intermedio A y los productos se obtienen con alto rendimiento y enantioselectividad.
5.6.1.1 Síntesis de Moléculas Biológicamente Importantes
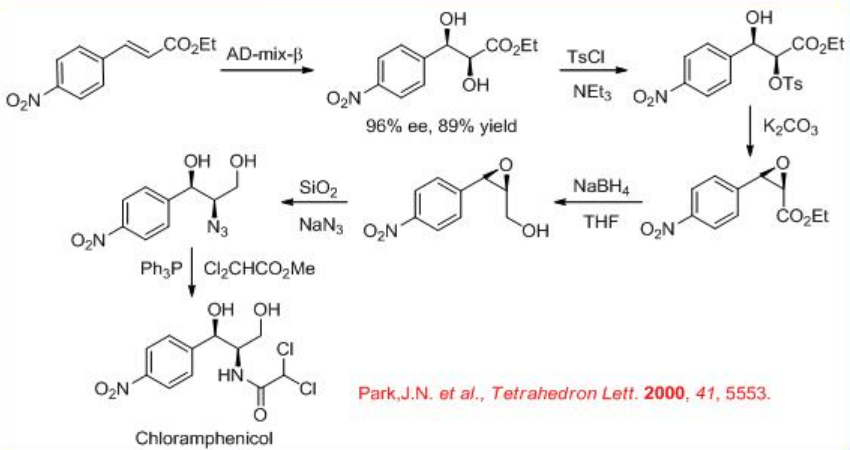
La dihidroxilación enantioselectiva catalizada por OS se utiliza como paso clave en la síntesis altamente expedita del agente antibacteriano (—) -cloranfenicol (Esquema5.6.5).
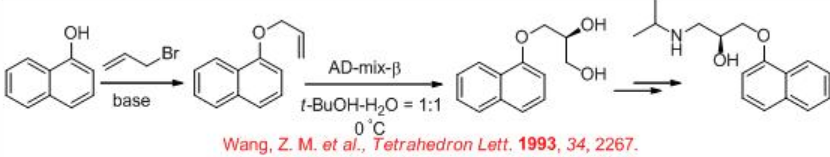
La síntesis del fármaco bloqueante del receptor β (S) -propranolol se ha demostrado empleando como paso clave la dihidroxilación catalizada por osmio (Esquema5.6.6). La reacción de α - naftol con bromuro alílico da alilnaftil éter que podría ser dihidroxilado usando Ad-mix - β con 91% ee. El derivado de diol podría convertirse en (S) - propranolol por métodos clásicos.
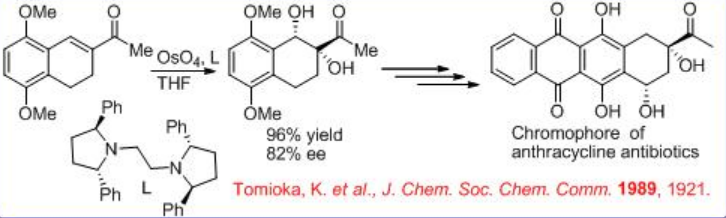
La síntesis de cromóforo de antibiótico antraciclina utiliza complejo quiral de osmio portador de diamina quiral L para la dihidroxilación asimétrica con buena enantioselectividad (Esquema5.6.7). El 1,2-diol resultante se pudo convertir posteriormente en el cromóforo deseado de antibiótico antraciclina con buen rendimiento.
5.6.2 Aminohidroxilación asimétrica
La unidad estructural quiral β -amino alcohol es un motivo clave en muchas moléculas biológicamente importantes. Es difícil imaginar un medio más eficiente de crear esta funcionalidad que mediante la adición directa de los dos sustituyentes heteroatómicos a un alqueno, especialmente si esta transformación se pudiera lograr de manera regioselectiva y enantioselectiva. Paralelamente a la epoxidación alílica y la dihidroxilación de alquenos; el grupo Sharpless ha desarrollado aminohidroxilación asimétrica de alquenos usando catálisis a base de osmio.
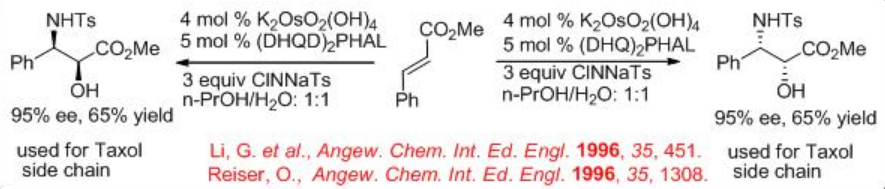
La síntesis de compuestos quirales α-sulfonamido hidroxi se puede obtener cuando los sustratos alquenos se someten a la reacción de aminohidroxilación usando cloramina-T (TsNClNa) como fuente de nitrógeno y H 2 O como fuente de oxígeno. La reacción se encontró exitosa en presencia de complejo de osmio que porta (DHQ) 2 PHAL o (DHQD) 2 PHAL. Los compuestos α -sulfonamido hidroxi pueden aislarse con alto rendimiento y pureza enantiomérica. Se obtienen mejores resultados con sales de cloramina-T (oxidante) que llevan sustituyentes orgánicos más pequeños en el azufre. Este reactivo podría prepararse por separado y añadirse a la mezcla de reacción como la sal anhidra estable o se puede generar in situ (Esquema5.6.8). El (E) -cinamato de metilo se puede convertir exitosamente en un producto α -hidroxi- β -amino con alta enantioselectividad. El producto resultante se utiliza para construir la cadena lateral de taxol, y este proceso establece la ruta más corta y eficiente hacia la cadena lateral de este agente farmacéutico importante.
El tema clave es la regioselectividad de la reacción. La sustitución de sulfonamida en cloramina-T con carbamatos de alquilo como BnO 2 CNH 2, EtO 2 CNH 2 y t-BuO 2 CNH 2 o amidas mejora en gran medida el alcance de reacción del sustrato y la selectividad hasta 99% ee y 80% de rendimiento. También el producto carbamato podría convertirse fácilmente en aminoalcohol libre. El carbamato de t-butilo es superior al carbamato de etilo en términos de rendimiento, enantioselectividad y facilidad de eliminación del grupo N-protector.
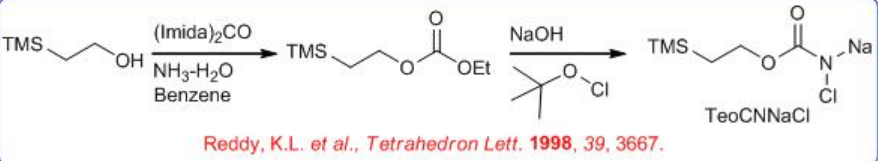
Fuente de nitrógeno Se podría sintetizar N-cloro-N-sodiocarbamato de 2-trimetilsililetil (TeoCNClNa) haciendo reaccionar NaOH y t-BuOCl con carbamato de 2- (trimetilsilil) etilo, que se puede preparar añadiendo sucesivamente carbonil diimidazol y amoníaco a 2- trimetilsililetanol en benceno (Esquema5.6.9 -5.6.10). El grupo TeoC puede ser dividido por fluoruro en condiciones muy suaves, produciendo el aminoalcohol libre con alta pureza enantiomérica.
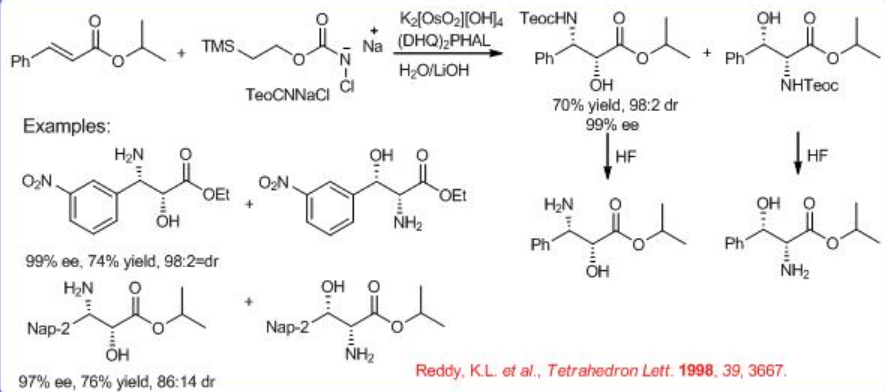
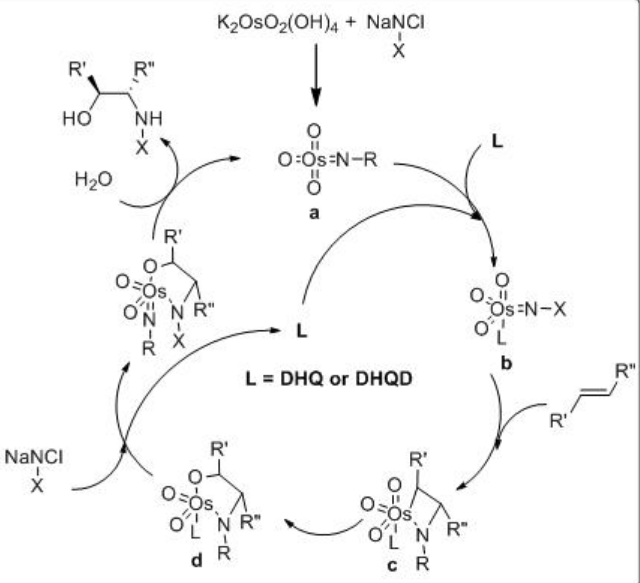
El mecanismo de la reacción se muestra en el Esquema5.6.11. El azaglicolato de Os (VI) es reoxidado por el sustrato de N-cloroamida y libera el producto objetivo después de la hidrólisis. El metalaciclo reoxidado se somete a una segunda cicloadición que conduce a un Os (VI) bis (azaglicolato). La realización de la reacción en un medio acuoso bajo condiciones más diluida favorece la hidrólisis.
5.6.3 Aziridinación asimétrica
Las aziridinas son bloques de construcción versátiles en la síntesis orgánica. Se han logrado avances considerables en el área de la aziridinación asimétrica empleando sistemas basados en cobre. Se ha demostrado que los complejos Mn (porfirina) y Mn-Saleno son catalizadores efectivos para esta reacción. Las reacciones proceden a través de especies activas de nitrenoides y la mayoría de los métodos utilizan un reactivo de yodo hipervalente como PHI=NTs como fuente de nitrenoides. La desprotección de los grupos N-sulfonilo requiere duras condiciones de reacción, el desarrollo de nuevos métodos se ha enfocado así sin grupo protector o con un grupo fácilmente removible. En este contexto, recientemente se ha demostrado el uso de compuestos azídicos como fuente de nitrógeno.
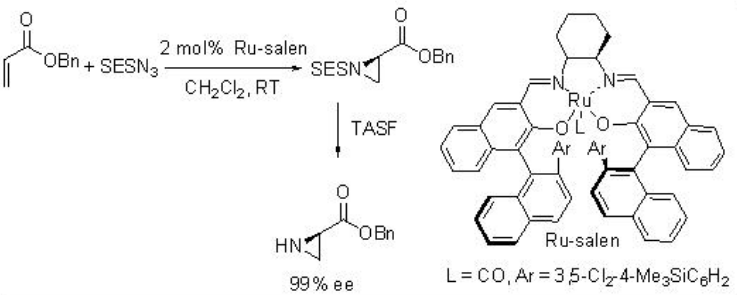
Se encontró que Ru-Salen es un catalizador efectivo para la aziridinación de alquenos con TsN 3 a temperatura ambiente con excelente enantioselectividad (Esquema5.6.12). La p-Nitro y O-nitrobencenosulfonilazida y la 2- (trimetilsilil) etanosulfonilazida (SESN 3) también son eficaces para esta reacción proporcionando la aziridina con alta enantioselectividad. Además, los ésteres menos nucleofílicos α, β -insaturados proceden a la aziridinación con alta enantioselectividad.
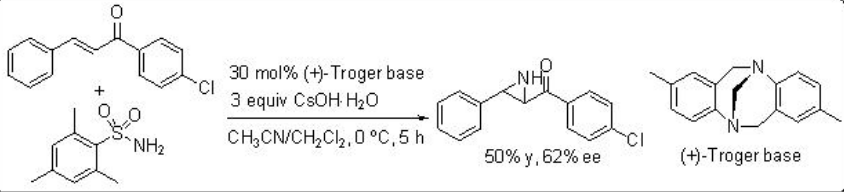
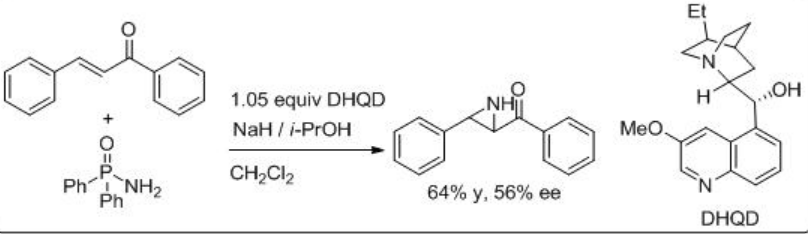
Una aminimida que se genera por desprotonación de la aminimina correspondiente se somete a aziridinación de chalcona mediante adición conjugada y cierre del anillo por escisión del enlace N-N. Por ejemplo, O-mesitilensulfonilhidroxilamina procede a la reacción en presencia de base (+) -Troger y CsoH∙.h 2 O con enantioselectividad moderada (Esquema5.6.13). Poco después se muestra el uso de quiniclidina para la reacción de O - (difenilfosfinil) hidroxilamina con chalcona con 56% ee (Esquema5.6.14).