20.7: Reacciones de Arilaminas
- Page ID
- 76170
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Reacción exagerada de anilina
Las arilaminas son muy reactivas hacia la sustitución aromomática electrofílica. Los sustituyentes activantes y orto/para-direccionantes más fuertes son los grupos amino (-NH 2) e hidroxilo (-OH). La nitración directa de fenol (hidroxibenceno) por ácido nítrico diluido da rendimientos modestos de fenoles nitrados y una considerable descomposición oxidativa a materiales alquitranados; la anilina (aminobenceno) se destruye en gran medida. La monobrominación tanto del fenol como de la anilina es difícil de controlar, con productos de di- y tri-bromo que se forman fácilmente.
Debido a su alta reactividad nucleofílica, la anilina y el fenol experimentan reacciones de sustitución con yodo, un halógeno que normalmente no reacciona con los derivados del benceno. El cloruro de yodo halógeno mixto (ICl) proporciona un resto de yodo más electrófilo, y es eficaz en la yodación de anillos aromáticos que tienen sustituyentes activadores menos potentes.
| C 6 H 5 —NH 2 + I 2 + NaHCO 3 |  |
p- I —C 6 H 4 —NH 2 + Na I + CO 2 + H 2 O |
Además de la sobrereactividad, hemos visto previamente que las reacciones de Friedel-Crafts que emplean catalizador AlCl 3 no funcionan con anilina. Un complejo salino forma y previene la sustitución aromática electrofílica.
Tanto este problema como la sobrereactividad de anilina se pueden eludir pasando primero por la amida correspondiente.
Modificación de la influencia de grupos activadores fuertes
Al acetilar el sustituyente heteroatómico en la anilina, su influencia activadora puede atenuarse sustancialmente. Por ejemplo, la acetilación de anilina da acetanilida (primer paso en la siguiente ecuación), la cual se somete a nitración a baja temperatura, produciendo el producto para-nitro en alto rendimiento. El grupo acetilo modificador puede entonces ser eliminado por hidrólisis catalizada por ácido (última etapa), para producir para-nitroanilina. Aunque la influencia activadora del grupo amino se ha reducido por este procedimiento, el derivado acetilo sigue siendo un sustituyente orto/para-director y activador.
C 6 H 5 —NH 2 + (CH 3 CO) 2 O |
piridina (una base) |
C 6 H 5 —NHCOCH 3 |
HNO 3, 5 ºC |
P-o 2 N—C 6 H 4 —NHCOCH 3 |
H 3 O (+) y calor |
P-o 2 N—C 6 H 4 —NH |
Iones Diazonio y sus Sales
Una descripción de resonancia de iones diazonio muestra que la carga positiva se deslocaliza sobre los dos átomos de nitrógeno. No es posible que los nucleófilos se unan al nitrógeno interno, pero la unión (o acoplamiento) de nucleófilos negativos al nitrógeno terminal da compuestos azoicos neutros. Como se muestra en la siguiente ecuación, este acoplamiento al nitrógeno terminal debe ser relativamente rápido y reversible. Los productos azo pueden existir como estereoisómeros E/Z. En la práctica se encuentra que el isómero E predomina en equilibrio.
A menos que estos productos azo sean atrapados o estabilizados de alguna manera, la inversión al ion diazonio y la lenta sustitución nucleofílica en el carbono (con pérdida irreversible de nitrógeno) será el último curso de reacción, como se describe en el apartado anterior. Por ejemplo, si se añade rápidamente bisufato de fenildiazonio a una solución fría de hidróxido de sodio, se obtiene una solución relativamente estable de fenildiazoato de sodio (la base conjugada del ácido diazoico inicialmente formado). Al disminuir el pH de esta solución se regenera el ácido fenildiazoico (pK a ca. 7), el cual se desasocia de nuevo al ion diazonio y eventualmente se somete a sustitución, generando fenol.
| C 6 H 5 N 2 (+) HSO 4 (—) + NaOH (solución fría) |  |
C 6 H 5 N 2 —OH + NaOH (frío) |  |
C 6 H 5 N 2 —O (—) Na (+) |
| bisulfato de fenildiazonio | ácido fenildiazoico | fenildiazoato de sodio |
Las sales de aril diazonio pueden reducirse a las hidrazinas correspondientes mediante agentes reductores suaves como bisulfito de sodio, cloruro estannoso o polvo de zinc. La reducción de bisulfito puede proceder mediante un acoplamiento inicial azufre-nitrógeno, como se muestra en la siguiente ecuación.
Ar-N 2 (+) X (—) |
NaHSO 3 |
Ar-N=n-SO 3 H |
NaHSO 3 |
Ar-NH-NH-So 3 H |
H 2 O |
Ar-NH-NH 2 + H 2 SO 4 |
Sales de diazonio: Las reacciones de Sandmeyer
Las sales de aril diazonio son intermedios importantes. Se preparan en solución acuosa fría (0 º a 10 ºC), y generalmente reaccionan con nucleófilos con pérdida de nitrógeno. Algunas de las reacciones de sustitución más utilizadas se muestran en el siguiente diagrama. Dado que el grupo saliente (N 2) es termodinámicamente muy estable, estas reacciones se ven favorecidas energéticamente. Aquellas reacciones de sustitución que son catalizadas por sales cuprosas se conocen como reacciones de Sandmeyer. La sustitución de flúor ocurre en el tratamiento con BF 4 (—), una reacción conocida como reacción de Schiemann. Se pueden aislar sales estables de tetrafluoroborato de diazonio, y al calentarlas pierden nitrógeno para dar un producto de fluoruro de arilo. La reacción superior con ácido hipofosforoso, H 3 PO 2, es notable porque logra la eliminación reductora de un grupo amino (o nitro). A diferencia de las reacciones de sustitución nucleofílica, esta reducción probablemente procede por un mecanismo radical.
Estas reacciones de sustitución de aril diazonio amplían significativamente las tácticas disponibles para la síntesis de derivados de benceno polisustituidos. Considere las siguientes opciones:
- El precursor habitual de una aril amina es el compuesto nitro correspondiente. Un sustituyente nitro desactiva un anillo aromático y dirige la sustitución electrófila a localizaciones meta.
- La reducción de un grupo nitro a una amina se puede lograr de varias maneras. El sustituyente amina resultante activa fuertemente un anillo aromático y dirige la sustitución electrófila a ubicaciones orto y para.
- El carácter activador de un sustituyente amina puede atenuarse mediante la formación de un derivado de amida (reversible), o incluso cambiarse a desactivación y meta-dirección mediante la formación de una sal de amonio cuaternario (irreversible).
- La conversión de una aril amina en un intermedio de ion diazonio permite que sea reemplazada por una variedad de grupos diferentes (incluyendo hidrógeno), que a su vez pueden usarse en reacciones posteriores.
Los siguientes ejemplos ilustran algunas aplicaciones combinadas de estas opciones a casos específicos. Se debe tratar de concebir una secuencia de reacción plausible para cada uno. Una vez que lo hayas hecho, puedes consultar las respuestas sugeridas a continuación.
- Respuesta 1:
-
Debe quedar claro que el sustituyente metilo eventualmente se oxidará a una función de ácido carboxílico. El tiempo es importante, ya que un sustituyente metilo es orto/para-dirigido y el sustituyente carboxilo es metadirigidor. El grupo ciano será introducido por un intermedio de diazonio, por lo que una nitración seguida de reducción a amina debe preceder a esta etapa.

- Respuesta 2:
-
El grupo hidroxilo es un sustituyente activante fuerte y dirigiría la cloración del anillo aromático a ubicaciones orto y para a sí mismo, lo que llevaría al producto equivocado. Como alternativa, el grupo nitro no solo es meta-direccionador, se puede convertir en un grupo hidroxilo por medio de un intermedio de diazonio. La estrategia resultante es evidente por sí misma.

- Respuesta 3:
-
La introducción selectiva de un flúor se logra mejor tratando un intermedio de diazonio con anión tetrafluoruro de boro. Para obtener el intermedio necesario necesitamos hacer p-nitroanilina. Dado que el sustituyente nitro en el material de partida dirigiría un nuevo sustituyente a una metalocalización, primero debemos reducirlo a un grupo amino orto/para-dirigido. Los grupos amino son poderosos sustituyentes activadores, por lo que los desactivamos por acetilación antes de la nitración. El sustituyente acetilo también protege la función amina inicial de la reacción con ácido nitroso posteriormente. Se elimina en el último paso.
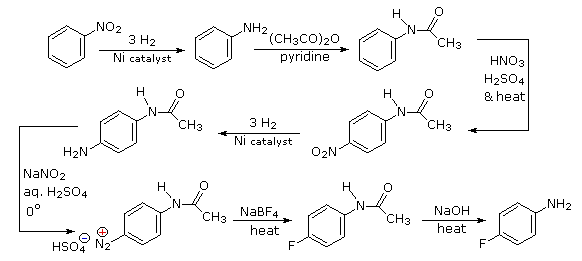
- Respuesta 4:
-
La polibromación del benceno conduciría a la sustitución orto/para. Para lograr la metarelación mutua de tres bromos, es necesario introducir un poderoso orto-para-direccionamiento previo a la bromación, y luego eliminarlo después de la tribromación. Un grupo amino es ideal para este propósito. La eliminación reductora del grupo diazonio se puede lograr de varias maneras (se muestran tres).
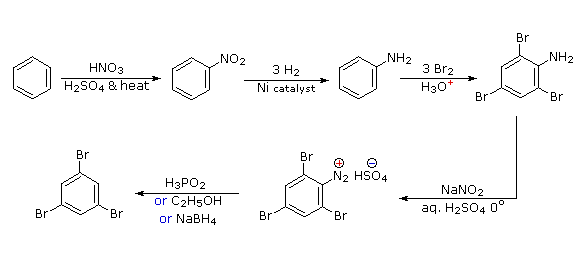
- Respuesta 5:
-
El sustituyente propilo se introduce mejor por acilación de Friedel-Crafts seguida de reducción, y esto no se puede llevar a cabo en presencia de un sustituyente nitro. Dado que un sustituyente acilo es un meta-director, es lógico usar esta propiedad para localizar los grupos nitro y cloro antes de reducir el resto carbonilo. Se puede usar el mismo método de reducción para reducir tanto el grupo nitro (a una amina) como el grupo carbonilo a propilo. Ya hemos visto el uso de intermedios de diazonio como precursores de fenoles.
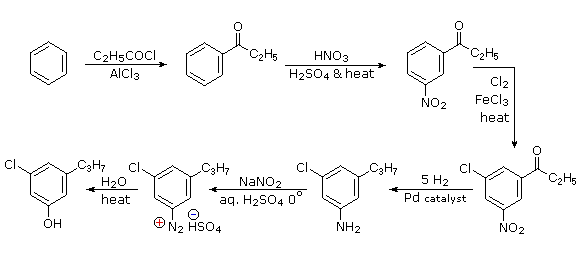
- Respuesta 6:
-
La yodación aromática solo se puede lograr directamente en compuestos de benceno altamente activados, como la anilina, o indirectamente por medio de un intermedio de diazonio. Una vez más, un grupo amino desactivado es el precursor de la p-nitroanilina (prb. #3). Este derivado de anilina requiere el cloruro de yodo más electrófilo (ICl) para la orto-yodación debido a la presencia de un sustituyente nitro desactivante. Finalmente, el tercer yodo se introduce mediante el procedimiento de iones diazonio.

Reacciones de sustitución de iones diazonio
Los iones diazonio están presentes en soluciones como la solución de cloruro de bencenodiazonio. Contienen un grupo -N 2 +. En el caso del cloruro de bencenodiazonio, éste está unido a un anillo de benceno. El cloruro de bencenodiazonio se ve así:

En este conjunto de reacciones del ion diazonio, el grupo -N 2 + es reemplazado por otra cosa. El nitrógeno se libera como gas nitrógeno.
Sustitución por un grupo -OH
Para obtener esta reacción, todo lo que necesitas hacer es calentar la solución de cloruro de bencenodiazonio. El ion diazonio reacciona con el agua en la solución y se forma fenol, ya sea en solución o como un líquido oleoso negro (dependiendo de cuánto se forme). El gas nitrógeno se evoluciona.
![]()

Esta es la misma reacción que obtienes si reaccionas fenilamina con ácido nitroso en el tibio. El ion diazonio se forma primero y luego reacciona inmediatamente con el agua en la solución para dar fenol.
Sustitución por un átomo de yodo
Este es un buen ejemplo del uso de sales de diazonio para sustituir cosas en un anillo de benceno que por lo demás son bastante difíciles de unir. (Eso es igualmente cierto de la reacción anterior, por cierto.) Si agrega solución de yoduro de potasio a la solución de cloruro de bencenodiazonio en frío, se desprende gas nitrógeno, y se forman gotitas oleosas de yodobenceno.
Existe una reacción simple entre los iones diazonio y los iones yoduro de la solución de yoduro de potasio.
![]()

Reacciones de acoplamiento de iones diazonio
En las reacciones de sustitución anteriores, se pierde el nitrógeno en el ion diazonio. En el resto de las reacciones de esta página, el nitrógeno se retiene y se utiliza para hacer un puente entre dos anillos de benceno.
La aplicación más importante de las reacciones de acoplamiento diazo es la sustitución aromática electrofílica de derivados de benceno activados por electrófilos de diazonio. Los productos de tales reacciones son compuestos azo aromáticos altamente coloreados que encuentran uso como colorantes sintéticos, comúnmente denominados colorantes azoicos. El azobenceno (Y=Z=H) es naranja claro; sin embargo, el color de otros compuestos azoicos puede variar de rojo a azul profundo dependiendo de la naturaleza de los anillos aromáticos y los sustituyentes que portan. Los compuestos azoicos pueden existir como pares de isómeros cis/trans, pero la mayoría de los compuestos bien caracterizados y estables son trans.

La reacción con fenol
El fenol se disuelve en solución de hidróxido de sodio para dar una solución de fenóxido de sodio.
![]()

La solución se enfría en hielo y se agrega una solución fría de cloruro de bencenodiazonio. Hay una reacción entre el ion diazonio y el ion fenóxido y se forma una solución o precipitado amarillo-naranja. El producto es uno de los más simples de lo que se conocen como compuestos azo, en el que dos anillos de benceno están unidos por un puente de nitrógeno.
![]()

La reacción con naftalen-2-ol
El naftalen-2-ol también se conoce como 2-naftol o beta-naftol. Contiene un grupo -OH unido a una molécula de naftaleno en lugar de a un simple anillo de benceno. La naftalina tiene dos anillos de benceno fusionados entre sí. La reacción se realiza exactamente en las mismas condiciones que con fenol. El naftalen-2-ol se disuelve en solución de hidróxido de sodio para producir un ion igual que el fenol. Esta solución se enfría y se mezcla con la solución de cloruro de bencenodiazonio.
Se forma un precipitado rojo anaranjado intenso, otro compuesto azo.
![]()

La reacción con fenilamina (anilina)
Se agrega algo de fenilamina líquida a una solución fría de cloruro de bencenodiazonio, y la mezcla se agita vigorosamente. Se produce un sólido amarillo.

Estos compuestos azoicos fuertemente coloreados se utilizan frecuentemente como tintes conocidos como tintes azoicos. El hecho de fenilamina (anilina) se conoce como “anilina amarilla” (entre muchas otras cosas - ver nota arriba). Los compuestos azoicos representan más de la mitad de los tintes modernos.
El uso de un colorante azo como indicador - naranja de metilo
Los compuestos azoicos contienen un sistema altamente deslocalizado de electrones que toma tanto los anillos de benceno como los dos átomos de nitrógeno que unen los anillos. La deslocalización también puede extenderse a cosas unidas a los anillos de benceno también. Si la luz blanca cae sobre una de estas moléculas, algunas longitudes de onda son absorbidas por estos electrones deslocalizados. El color que ves es el resultado de las longitudes de onda no absorbidas. Los grupos que contribuyen a la deslocalización (y así a la absorción de la luz) se conocen como cromóforos.
Modificar los grupos presentes en la molécula puede tener un efecto sobre la luz absorbida, y así sobre el color que se ve. Esto se puede aprovechar en indicadores. La naranja metílica es un colorante azo que existe en dos formas dependiendo del pH:

A medida que el ion hidrógeno se pierde o gana, hay un cambio en la naturaleza exacta de la deslocalización en la molécula, y eso provoca un desplazamiento en la longitud de onda de la luz absorbida. Obviamente eso significa que ves un color diferente. Cuando se agrega naranja de metilo, se une un ión de hidrógeno para dar la forma roja. El naranja metílico es rojo en soluciones ácidas (de hecho soluciones de pH inferior a 3.1). Si se agrega un álcali o se eliminan los iones hidrógeno, entonces la forma amarilla si se genera. El naranja metílico es amarillo a pH mayores a 4.4.
En el medio, en algún momento habrá cantidades iguales de las formas roja y amarilla y así el naranja metílico se ve anaranjado.
A continuación se muestran algunos ejemplos de reacciones de acoplamiento azo. Algunas reglas simples son útiles para predecir el curso de tales reacciones:
- A pH ácido (< 6) un grupo amino es un sustituyente activante más fuerte que un grupo hidroxilo (es decir, un fenol). A pH alcalino (> 7.5) las funciones fenólicas son activadores más fuertes, debido al aumento de la concentración de fenóxido base.
- El acoplamiento a un anillo de benceno activado ocurre preferentemente para con el grupo activador si esa ubicación es libre. De lo contrario ocurrirá el orto-acoplamiento.
- La naftalina normalmente se somete a sustitución electrófila en una ubicación alfa más rápidamente que en los sitios beta; sin embargo, se prefiere el orto-acoplamiento. Consulte el diagrama para ver ejemplos de notación α/β en naftalenos.
Debe intentar concebir una estructura de producto plausible para cada uno de los siguientes acoplamientos.
Ejercicio
14. Proponga una síntesis para el siguiente compuesto vía benceno y cualquier amina que pueda requerir.

15. Propone síntesis para cada uno de los siguientes compuestos vía benceno.
(a) N, N-dietilanilina
(b) p-Bromoanilina
(c) m-Bromoanilina
d) 2,4-Dietilanilina
16. Proponer una síntesis para cada una de las siguientes moléculas a partir del benceno vía el ion diazonio.
(a) ácido p-clorobencóico
(b) ácido m-clorobencóico
(c) m-Diclorobenceno
(d) ácido p-etilbenzoico
e) 1,2,4-triclorobenceno
Clasificar los siguientes alcoholes como primarios, secundarios o terciarios.
- Contestar
-
14.

15.
a) 1. HNO 3, H 2 SO 4; 2. Zn (Hg), HCl; 3. ETBr
b) 1. HNO 3, H 2 SO 4; 2. Zn (Hg), HCl; 3. (CH 3 CO) O 2; 4. Br 2, FeBr 3; 5. H 2 O, NaOH
c) 1. HNO 3, H 2 SO 4; 2. Br 2, FeBr 3; 3. Zn (Hg), HCl
d) 1. HNO 3, H 2 SO 4; 2. Zn (Hg), HCl; 3. (CH 3 CO) O 2; 4. EtCl, AlCl 3; 5. H 2 O, NaOH
16.
a) 1. CH 3 CH 2 Cl, AlCl 3; 2. HNO 3, H 2 SO 4; 3. SnCl 2; 4. NaNO 2, H 2 SO 4; 5. CuBr; 6. KmNo 4, H 2 O
b) 1. HNO 3, H 2 SO 4; 2. Cl 2, FeCl 3; 3. SnCl 2, H 3 O +; 4. NaNO 2, H 2 SO 4; 5. CuCn; 6. H 3 O +
c) 1. HNO 3, H 2 SO 4; 2. Cl 2, FeCl 3; 3. SnCl 2; 4. NaNO 2, H 2 SO 4; 5. CuCl
d) 1. CH 3 CH 2 Cl, AlCl 3: 2. HNO 3, H 2 SO 4; 3. SnCl 2; 4. NaNO 2, H 2 SO 4; 5. CuCn; 6. H 3 O +
e) 1. HNO 3, H 2 SO 4; 2. H 2 /PTO 2; 3. (CH 3 CO) 2 O; 4. 2 Cl 2; 5. H 2 O, NaOH; 6. NaNO 2, H 2 SO 4; 7. CuCl
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
Jim Clark (Chemguide.co.uk)





