7.1: Interconversión de ácidos y derivados - Predicción de resultados
( \newcommand{\kernel}{\mathrm{null}\,}\)
Como acabamos de ver, los ésteres pueden elaborarse a partir de ácidos carboxílicos y viceversa: podemos controlar el resultado de la reacción utilizando el principio de Le Chatelier. Esto se debe a que el intermedio tetraédrico contiene solo grupos salientes de oxígeno y los reactivos y productos son de estabilidad similar. Sin embargo, si reaccionamos un derivado como un cloruro de ácido con un nucleófilo de oxígeno, vemos que la reacción resultante tiende a no ser reversible. Es posible pasar del cloruro de ácido al ácido carboxílico (conH2O nucleófilo), al éster (con un nucleófilo alcohólico), o a la amida (con un nucleófilo de amina). La reacción inversa no es factible porque 1) el intermedio tetraédrico, ya sea para la reacción directa o inversa, ahora tiene diferentes grupos lábil como se muestra a continuación y 2) el cloruro de ácido es altamente reactivo (se desestabiliza por extracción inductiva) y es poco probable que la reacción se invierta bajo condiciones típicas de reacción.
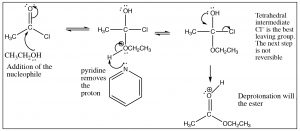
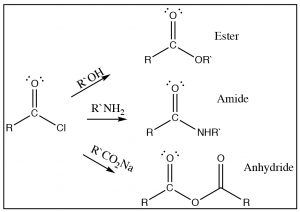
El intermedio tetraédrico reacciona para producir el carbonilo expulsando cloruro, que es el mejor grupo lábil. Por lo tanto, es difícil conseguir que esta reacción se revierta. De hecho, el cloruro de ácido se puede utilizar para producir todos los demás derivados ácidos, y ácidos carboxílicos. La reacción de cloruros de ácido con aminas producirá amidas y, con un anión carboxilato, producirá anhidridos de ácido como se muestra. En cada caso el cloruro es el mejor grupo de salida cuando el intermedio tetraédrico colapsa, y se forma el producto más estable.
Puede que ahora se esté preguntando si los cloruros de ácido son tan buenos reactivos, ¿cómo podemos hacerlos en primer lugar? No podemos usar ion cloruro para hacer una adición/eliminación nucleofílica de cualquier otro derivado ácido, entonces, ¿cómo podemos sortear ese problema? La respuesta es introducir un grupo de salida aún mejor en la molécula. Un ejemplo es la reacción de ácidos carboxílicos con cloruro de tionilo (SOCl2). El azufre en el cloruro de tionilo es altamente susceptible al ataque nucleofílico, mucho más que el carbonilo, debido a todos los grupos electronegativos unidos a él. El primer paso es el ataque por el oxígeno del ácido carboxílico sobre elSOCl2, como se muestra a continuación.
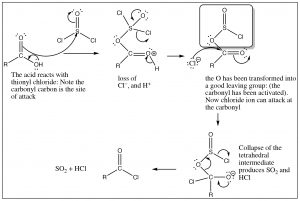
El intermedio que se forma tiene un excelente grupo de salida (en la caja sombreada). En efecto, hemos activado el carbonilo y lo hemos hecho más reactivo. Ahora puede continuar el ataque del ion cloruro y la reacción avanzará porque tenemos un mejor grupo de salida que el cloruro. El intermedio tetraédrico ahora colapsa y, al mismo tiempo, el grupo de salida se descompone para darSO2 y cloruro de hidrógeno [10], ambos gases que son expulsados de la mezcla de reacción que impulsa la reacción hacia los productos (principio de Le Chatelier).
En esta reacción, hemos visto una idea muy importante y poderosa: hemos sido capaces de impulsar una reacción para producir un producto termodinámicamente desfavorable produciendo un intermedio altamente reactivo. Anteriormente encontramos ejemplos más simples: por ejemplo, protonar un alcohol o preparar un derivado de tosil paraOH transformarlo en un buen grupo de salida. En este caso, la reacción es desordenada y tóxica (no es nada divertido hacer esta reacción en un laboratorio), pero los sistemas biológicos utilizan esta estrategia para provocar reacciones termodinámicamente desfavorables. Como discutiremos más adelante en el curso, los reactivos de sustrato pueden ser activados por esta misma estrategia deOH convertir un en un buen grupo de salida que luego conduzca a la formación de un producto que no podría producirse en circunstancias normales. Por ejemplo, la formación de sacarosa a partir de glucosa y fructosa procede utilizando dicha estrategia (catalizada por enzimas). En este caso, la activación implica la activación de unOH grupo por acoplamiento conATP.


