7.8: Reacciones de Aldehídos y Cetonas con Nucleófilos de Oxígeno
( \newcommand{\kernel}{\mathrm{null}\,}\)
En contraste con la adición de nucleófilos de hidrógeno o carbono, la adición de nucleófilos de oxígeno y nitrógeno es reversible bajo las condiciones en las que se produce la reacción. Esto se debe a que (como veremos) la adición de un nucleófilo de oxígeno o nitrógeno da como resultado un intermedio tetraédrico que puede regenerar el carbonilo expulsando un grupo saliente. A diferencia de los casos con nucleófilos de carbono o hidrógeno, los nucleófilos de oxígeno y nitrógeno pueden ser buenos grupos de salida. Típicamente, la reacción es catalizada por ácido o base como se discute más adelante. Por ejemplo: en solución acuosa, la mayoría de los aldehídos y cetonas reaccionarán con el agua para producir un hidrato.
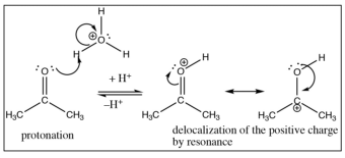
En ácido, el primer paso es la protonación del oxígeno carbonílico, la carga positiva resultante se deslocaliza parcialmente sobre el carbono→, lo que hace que el carbonilo sea más susceptible al ataque nucleófilo incluso por un nucleófilo relativamente pobre como el agua.
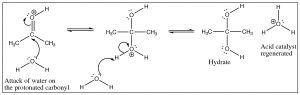
Esta reacción es completamente reversible en solución acuosa, y si algún aldehído o cetona se disuelve en agua siempre hay alguna concentración de equilibrio del hidrato. De hecho, el formaldehído (H2C=O) existe casi exclusivamente como hidrato en solución acuosa, mientras que la mayoría de los demás aldehídos y cetonas existen principalmente en forma carbonilo. Sin embargo, es importante tener en cuenta que ambas formas están típicamente presentes y, por lo tanto, pueden provenir reacciones adicionales tanto de la forma hidrato como de la forma carbonilo.
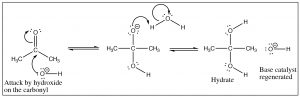
La catálisis base difiere en que el primer paso es el ataque por el hidróxido (en lugar de agua) sobre el carbonilo. Dado que el hidróxido es más reactivo que el agua, el carbonilo no necesita ser activado por protonación. Lo que los dos mecanismos tienen en común son las reacciones rápidas de protonación/desprotonación que tienen lugar en las etapas intermedias. Ya lo hemos visto muchas veces y con las reacciones de aldehídos y cetonas, se vuelve más importante apreciar cuán ubicuas son la protonación y la desprotonación. Al controlar el pH o las cantidades de reactivos o productos veremos que es posible dirigir tales reacciones para que se produzca el producto que deseamos.
El hidrato es un ejemplo de una estructura que jugará un papel importante en nuestra discusión de todos los compuestos carbonílicos, a los que nos referiremos como el “intermedio tetraédrico”. En esta forma tetraédrica, el carbono se encuentra en el mismo estado de oxidación que la cetona (dos enlaces al oxígeno) pero en un estado de hibridación diferente,sp3 a para el hidrato ysp2 para el carbonilo. En la mayoría de los casos, elC=O enlace (en la formasp2 hibridada) es más fuerte (745 kJ/molen una cetona típica) que dosC−O enlaces simples (2×358 kJ/mol) (en la formasp3 hibridada), lo que explica por qué (cuando hay un grupo saliente estable de baja energía) el intermedio tetraédrico que es formado por ataque alsp2 carbono suele colapsar de nuevo a unaC=O, expulsando a un grupo saliente al mismo tiempo. A medida que avancemos, veremos el paso de tetraédrico aC=O muchas veces, la diferencia en muchas de las reacciones es qué grupo saldrá durante este proceso.
Si cambiamos el solvente a un alcohol, vemos que ocurre el mismo tipo de reacción. El oxígeno del alcohol ataca al carbono carbonílico, pero encontramos que la reacción avanza más allá. El primer producto, formado por la adición de un alcohol al carbonilo se llama hemiacetal pero luego la reacción continúa. Cada paso es reversible (con baja energía de activación), cada protonación y desprotonación es reversible. Todos los oxígenos de la molécula pueden ser protonados y desprotonados. Cuando elOH grupo del hemiacetal está protonado, se convierte en un buen grupo saliente (H2O) y el carbono sufre otro ataque por parte de una molécula de alcohol. El resultado final es un acetal [4] y agua.
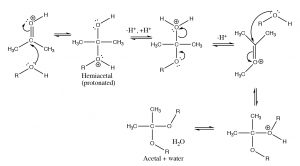
Dado que estas reacciones son reversibles, tal vez se esté preguntando cómo podemos controlar la reacción. En este caso podemos usar el principio de Le Chatelier: podemos agregar mucho material de partida o podemos eliminar uno de los productos a medida que se forma. En este caso, la formación de acetal generalmente se realiza utilizando el alcohol como disolvente, y se elimina el agua que se forma, de manera que la posición de equilibrio se desplaza para producir el acetal. Sin embargo, como veremos en breve, a veces queremos regenerar el compuesto carbonilo, y esto se puede hacer añadiendo agua (y catalizador ácido) para que el equilibrio retroceda.
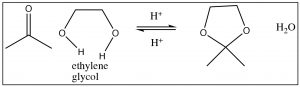
Si usamos un diol como el etilenglicol (OHCH2CH2OH), se forma el acetal cíclico resultante. Esto se usa frecuentemente para proteger grupos carbonilo en moléculas más complejas, por ejemplo, si quisiéramos hacer una reacción en otra parte de la molécula. Nuevamente, el grupo carbonilo se regenera fácilmente. El mecanismo de hidrólisis es simplemente el reverso de la formación de acetal, comenzando con la protonación, el ataque por el agua, y así sucesivamente como se muestra a continuación.
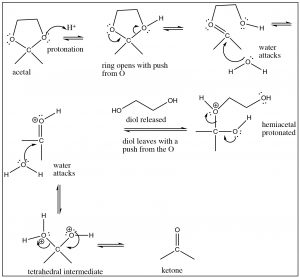
Si bien este mecanismo puede parecer (un poco) complicado, de hecho, cada paso es sencillo y hemos visto cosas similares muchas veces. El problema con este tipo de reacciones es que todos los oxígenos están siendo protonados y desprotonados todo el tiempo.
Obsérvese que las formas en que se comportan los intermedios tetraédricos dependen de qué oxígeno esté protonado, y qué nucleófilo (agua o alcohol) ataca al acetal o cetona protonada.
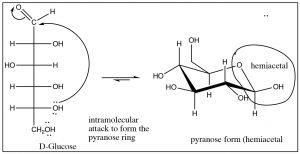
Un ejemplo común de formación de hemiacetales es la ciclación intramolecular de D-glucosa para formar un anillo de seis miembros que contiene un grupo hemiacetal (entre muchos otros). Este caso es en realidad un raro ejemplo de que la forma tetraédrica (hemiacetal) es más estable que la forma carbonilo.


