1.3: Grupos funcionales y nomenclatura orgánica
- Page ID
- 72411
Los grupos funcionales son unidades estructurales dentro de compuestos orgánicos que se definen por arreglos de unión específicos entre átomos específicos. La estructura de la capsaicina, el compuesto discutido al inicio de este capítulo, incorpora varios grupos funcionales, etiquetados en la figura a continuación y explicados a lo largo de esta sección.
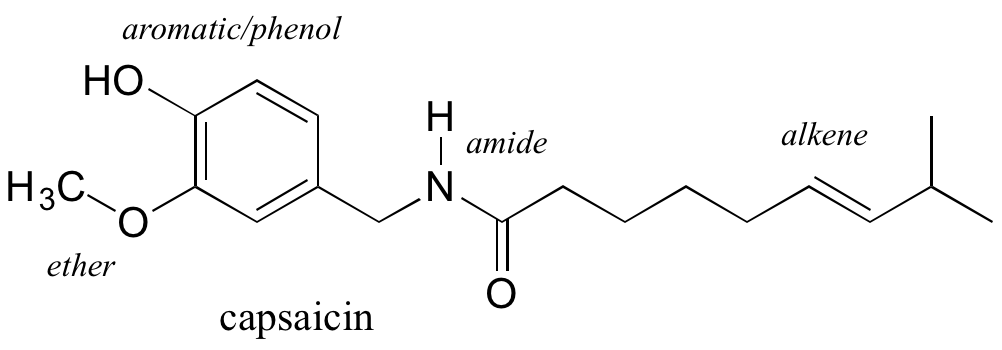
A medida que avancemos en nuestro estudio de la química orgánica, será sumamente importante poder reconocer rápidamente los grupos funcionales más comunes, ya que son los elementos estructurales clave que definen cómo reaccionan las moléculas orgánicas. Por ahora, solo nos preocuparemos por dibujar y reconocer cada grupo funcional, como lo representan Lewis y las estructuras lineales. Gran parte del resto de su estudio de química orgánica se retomará con el aprendizaje de cómo se comportan los diferentes grupos funcionales en las reacciones orgánicas.
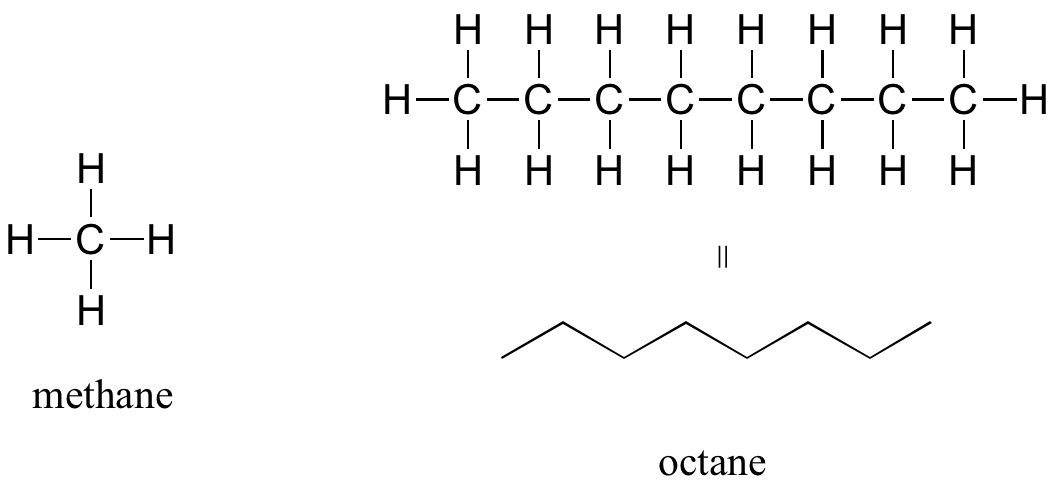
Al 'default' en la química orgánica (esencialmente, la falta de grupos funcionales) se le da el término alcano, caracterizado por enlaces simples entre carbono y carbono, o entre carbono e hidrógeno. El metano, CH 4, es el gas natural que puedes quemar en tu horno. El octano, C 8 H 18, es un componente de la gasolina.
Los alquenos (a veces llamados olefinas) tienen dobles enlaces carbono-carbono, y los alquinos tienen enlaces triples carbono-carbono. El eteno, el ejemplo de alqueno más simple, es un gas que sirve como señal celular en los frutos para estimular la maduración. (Si quieres que los plátanos maduren rápidamente, ponlos en una bolsa de papel junto con una manzana - la manzana emite gas eteno, desencadenando el proceso de maduración en los plátanos). El etino, comúnmente llamado acetileno, se utiliza como combustible en sopletes de soldadura.
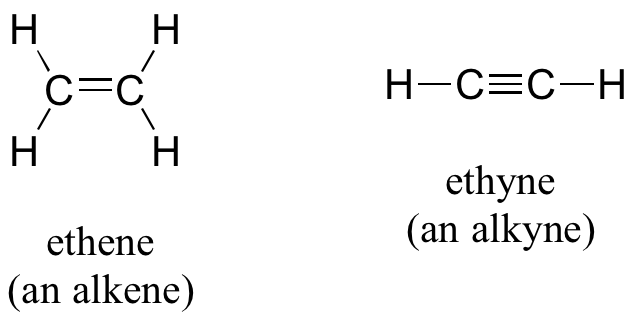
En el capítulo 2, estudiaremos la naturaleza de la unión en alquenos y alquinos, y aprenderemos que el enlace en alquenos es plano trigonal en en alquinos es lineal. Además, muchos alquenos pueden tomar dos formas geométricas: cis o trans. Las formas cis y trans de un alqueno dado son moléculas diferentes con diferentes propiedades físicas porque, como aprenderemos en el capítulo 2, existe una barrera energética muy alta a la rotación alrededor de un doble enlace. En el siguiente ejemplo, la diferencia entre alquenos cis y trans es fácilmente evidente.
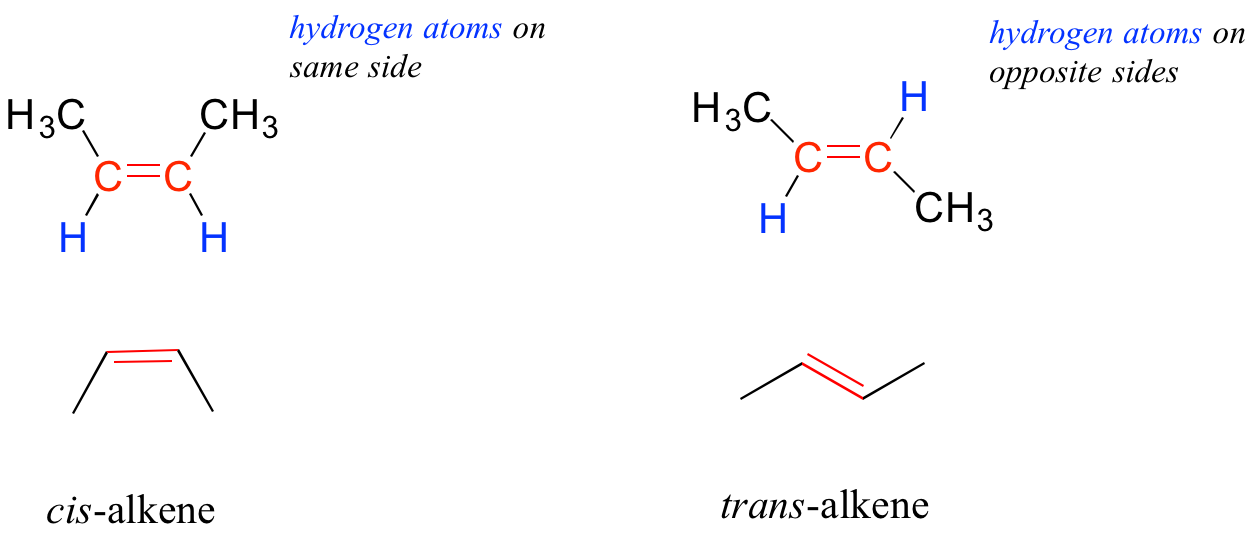
Tendremos más que decir sobre el tema de los alquenos cis y trans en el capítulo 3, y aprenderemos mucho más sobre la reactividad de los alquenos en el capítulo 14.
Los alcanos, alquenos y alquinos se clasifican como hidrocarburos, ya que están compuestos únicamente por átomos de carbono e hidrógeno. Se dice que los alcanos son hidrocarburos saturados, porque los carbonos están unidos al máximo número posible de hidrógenos, es decir, están saturados con átomos de hidrógeno. Los carbonos de doble y triple enlace en alquenos y alquinos tienen menos átomos de hidrógeno unidos a ellos, por lo que se les conoce como hidrocarburos insaturados. Como veremos en el capítulo 15, se puede agregar hidrógeno a dobles y triples enlaces, en un tipo de reacción llamada 'hidrogenación'.
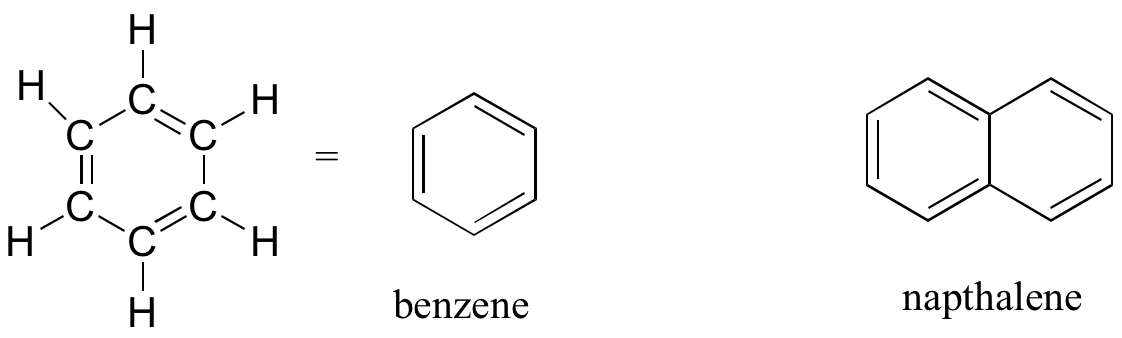
El grupo aromático está ejemplificado por el benceno (que solía ser un solvente de uso común en el laboratorio orgánico, pero que demostró ser cancerígeno), y el naftaleno, un compuesto con un distintivo olor a 'bola de naftalina'. Los grupos aromáticos son estructuras de anillo planas (planas), y están muy extendidos en la naturaleza. Aprenderemos más sobre la estructura y reacciones de los grupos aromáticos en los capítulos 2 y 14.
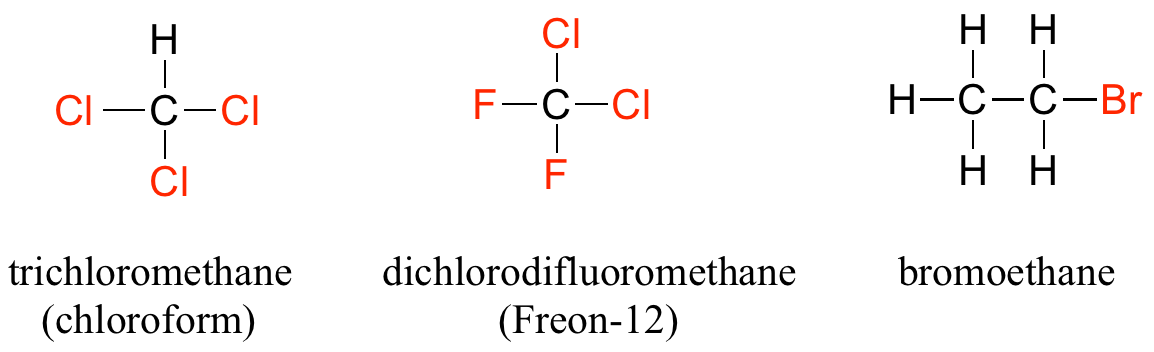
Cuando el carbono de un alcano está unido a uno o más halógenos, el grupo se denomina haluro de alquilo o haloalcano. El cloroformo es un solvente útil en el laboratorio, y fue uno de los fármacos anestésicos anteriores utilizados en cirugía. El clorodifluorometano se utilizó como refrigerante y en aerosoles hasta finales del siglo XX, pero su uso se interrumpió después de que se encontró que tenía efectos nocivos sobre la capa de ozono. El bromoetano es un haluro de alquilo simple que se usa a menudo en la síntesis orgánica. Los grupos haluros de alquilo son bastante raros en biomoléculas.
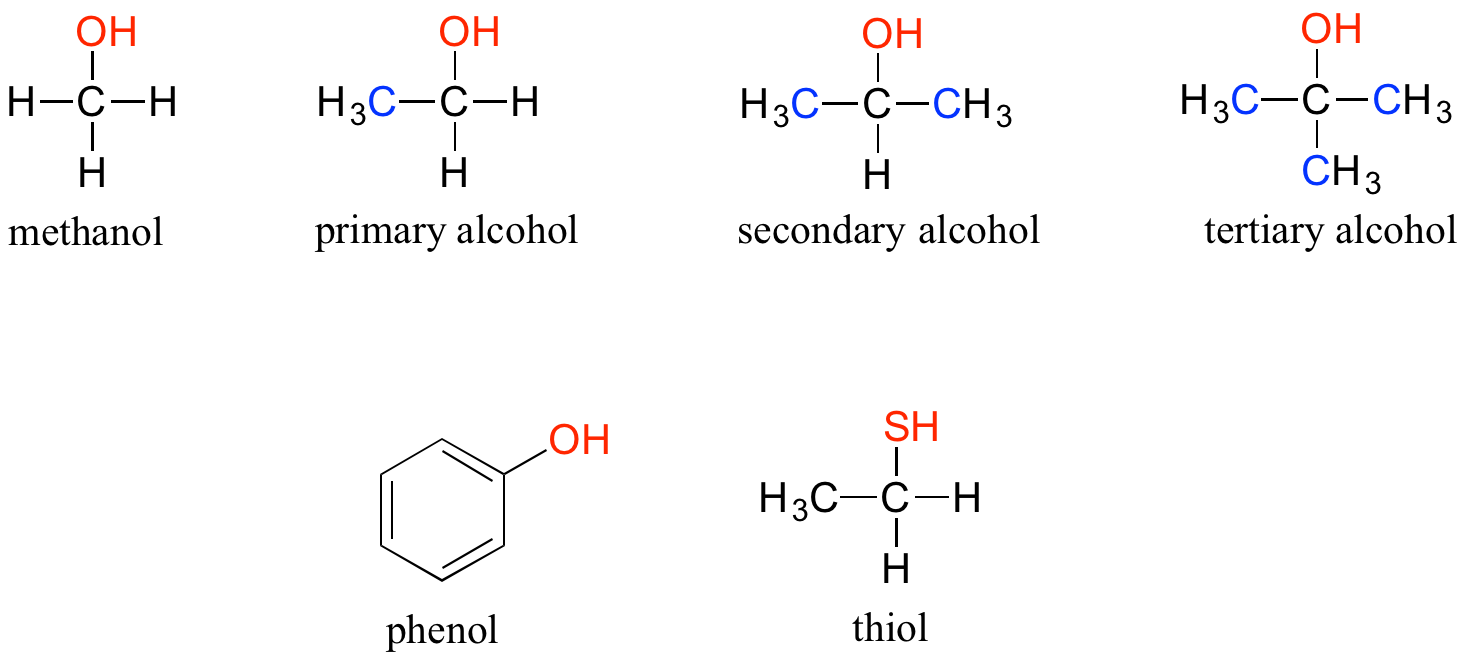
En el grupo funcional alcohol, un carbono está unido de manera simple a un grupo OH (el grupo OH, por sí mismo, se denomina hidroxilo). Excepto el metanol, todos los alcoholes pueden clasificarse como primarios, secundarios o terciarios. En un alcohol primario, el carbono unido al grupo OH también está unido a solo otro carbono. En un alcohol secundario y un alcohol terciario, el carbono está unido a otros dos o tres carbonos, respectivamente. Cuando el grupo hidroxilo se une directamente a un anillo aromático, el grupo resultante se llama fenol. El análogo de azufre de un alcohol se llama tiol (del griego tio, para azufre).
Obsérvese que la definición de fenol establece que el oxígeno hidroxílico debe estar unido directamente a uno de los carbonos del anillo aromático. El siguiente compuesto, por lo tanto, no es un fenol, es un alcohol primario.
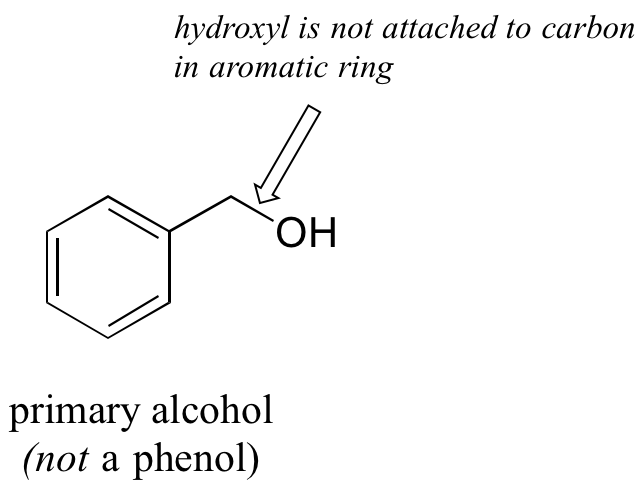
La distinción es importante, porque como veremos más adelante, existe una diferencia significativa en la reactividad de alcoholes y fenoles.
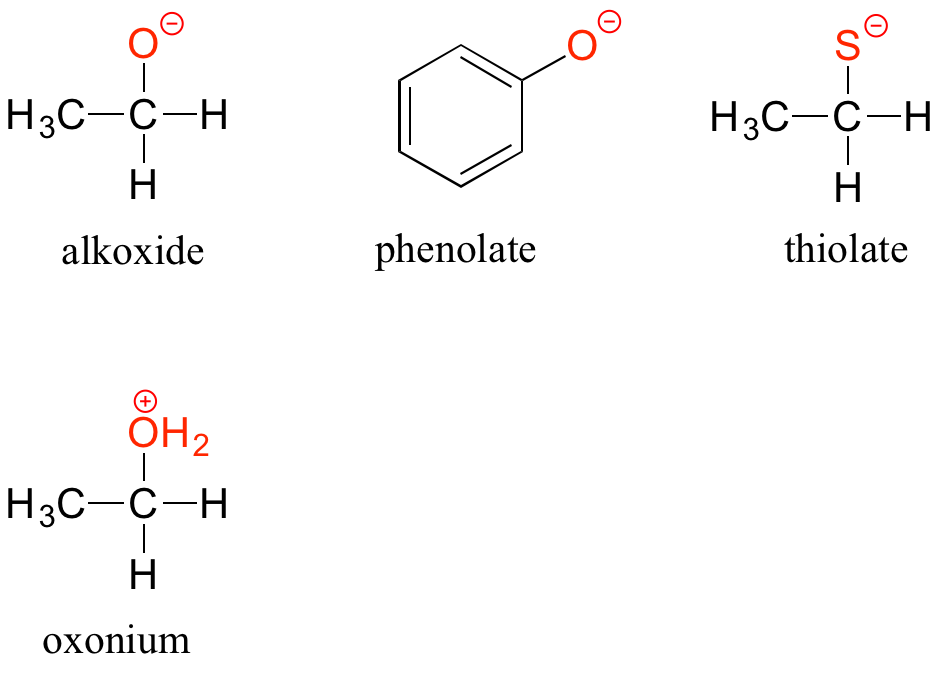
Las formas desprotonadas de alcoholes, fenoles y tioles se denominan alcóxidos, fenolatos y tiolatos, respectivamente. Un alcohol protonado es un ion oxonio.
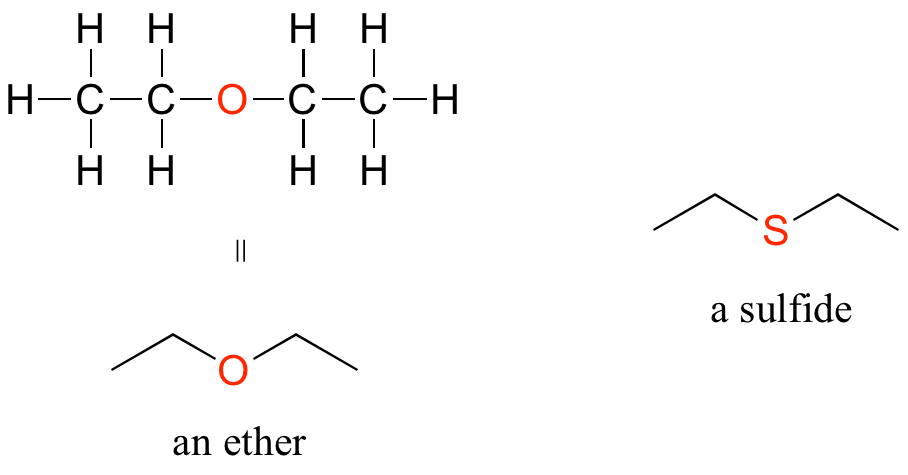
En un grupo funcional éter, un oxígeno central está unido a dos carbonos. A continuación se muestra la estructura del éter dietílico, un solvente común de laboratorio y también uno de los primeros compuestos que se utilizará como anestésico durante las operaciones. El análogo de azufre de un éter se llama tioéter o sulfuro.
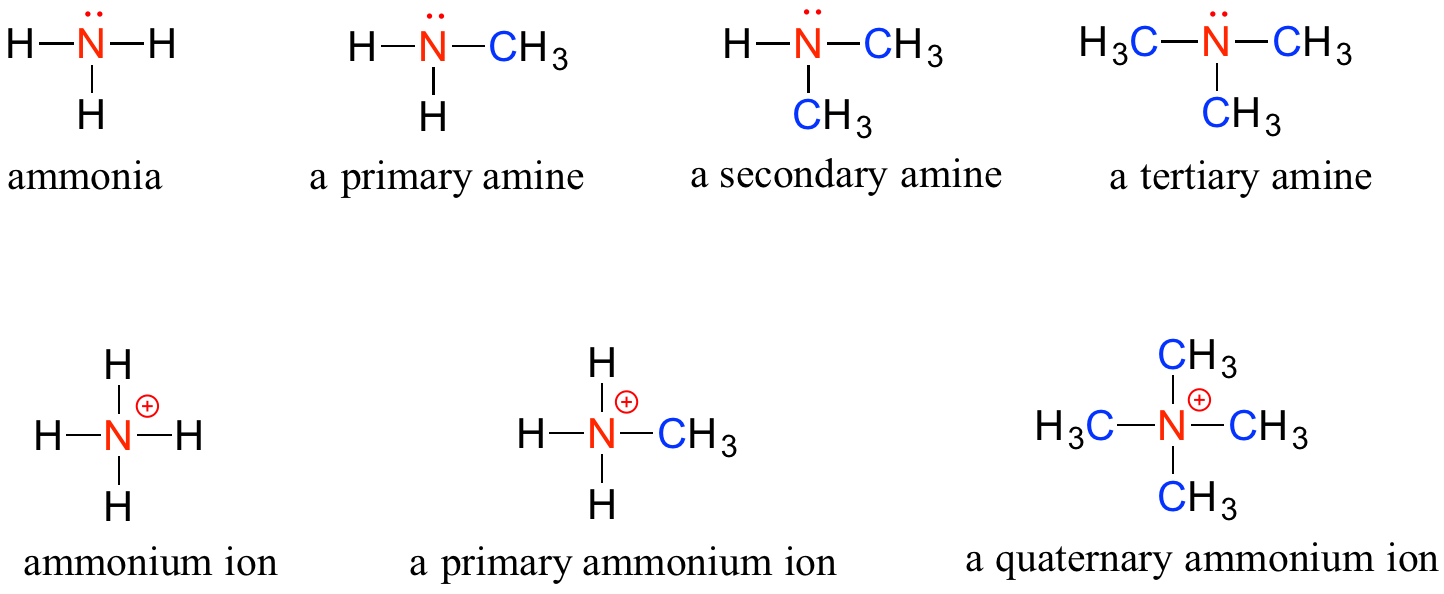
Las aminas se caracterizan por átomos de nitrógeno con enlaces simples a hidrógeno y carbono. Así como hay alcoholes primarios, secundarios y terciarios, hay aminas primarias, secundarias y terciarias. El amoníaco es un caso especial sin átomos de carbono.
Una de las propiedades más importantes de las aminas es que son básicas, y se protonan fácilmente para formar cationes amonio. En el caso de que un nitrógeno tenga cuatro enlaces al carbono (lo cual es algo inusual en biomoléculas), se le llama ion amonio cuaternario.
No se confunda por cómo se aplican los términos 'primario', 'secundario' y 'terciario' a los alcoholes frente a las aminas; las definiciones son diferentes. En los alcoholes, lo que importa es a cuántos otros carbonos está unido el carbono del alcohol, mientras que en las aminas, lo que importa es a cuántos carbonos está unido el nitrógeno.
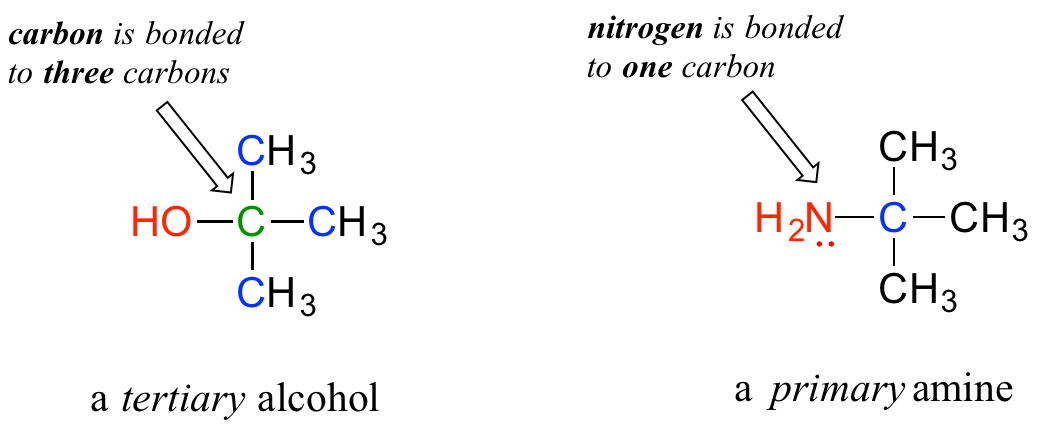
El fosfato y sus grupos funcionales derivados son ubicuos en biomoléculas. El fosfato unido a un solo grupo orgánico se llama éster de fosfato; cuando tiene dos enlaces a grupos orgánicos se llama diéster de fosfato. Un enlace entre dos fosfatos crea un anhídrido de fosfato.
Fosfatos orgánicos
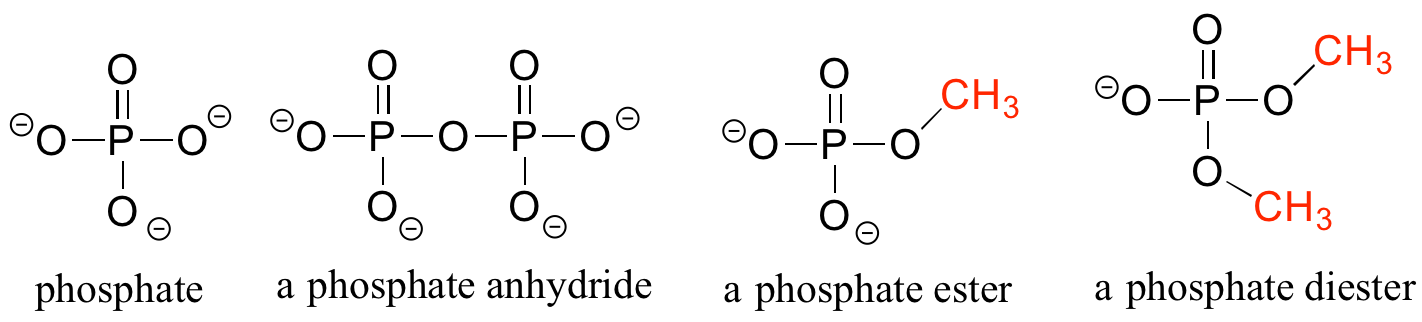
El capítulo 9 de este libro está dedicado a la estructura y reactividad del grupo fosfato.
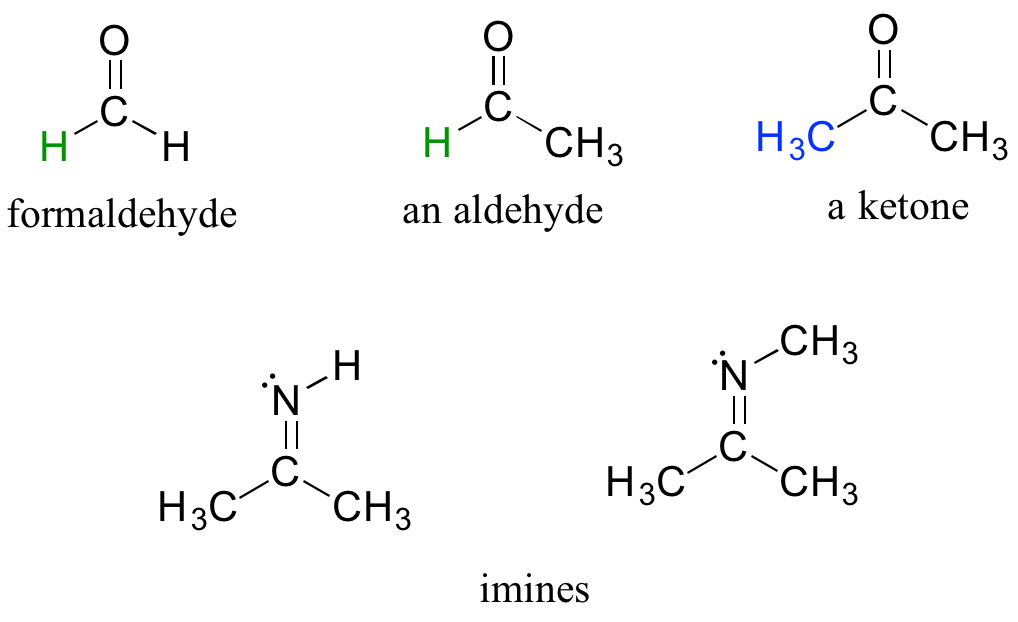
Hay una serie de grupos funcionales que contienen un doble enlace carbono-oxígeno, que comúnmente se conoce como carbonilo. Las cetonas y los aldehídos son dos grupos funcionales a base de carbonilo estrechamente relacionados que reaccionan de manera muy similar. En una cetona, el átomo de carbono de un carbonilo está unido a otros dos carbonos. En un aldehído, el carbono carbonilo está unido por un lado a un hidrógeno, y por el otro lado a un carbono. La excepción a esta definición es el formaldehído, en el que el carbono carbonílico tiene enlaces a dos hidrógenos.
Un grupo con un doble enlace carbono-nitrógeno se llama imina, o a veces base Schiff (en este libro usaremos el término 'imine'). La química de aldehídos, cetonas e iminas se tratará en el capítulo 10.
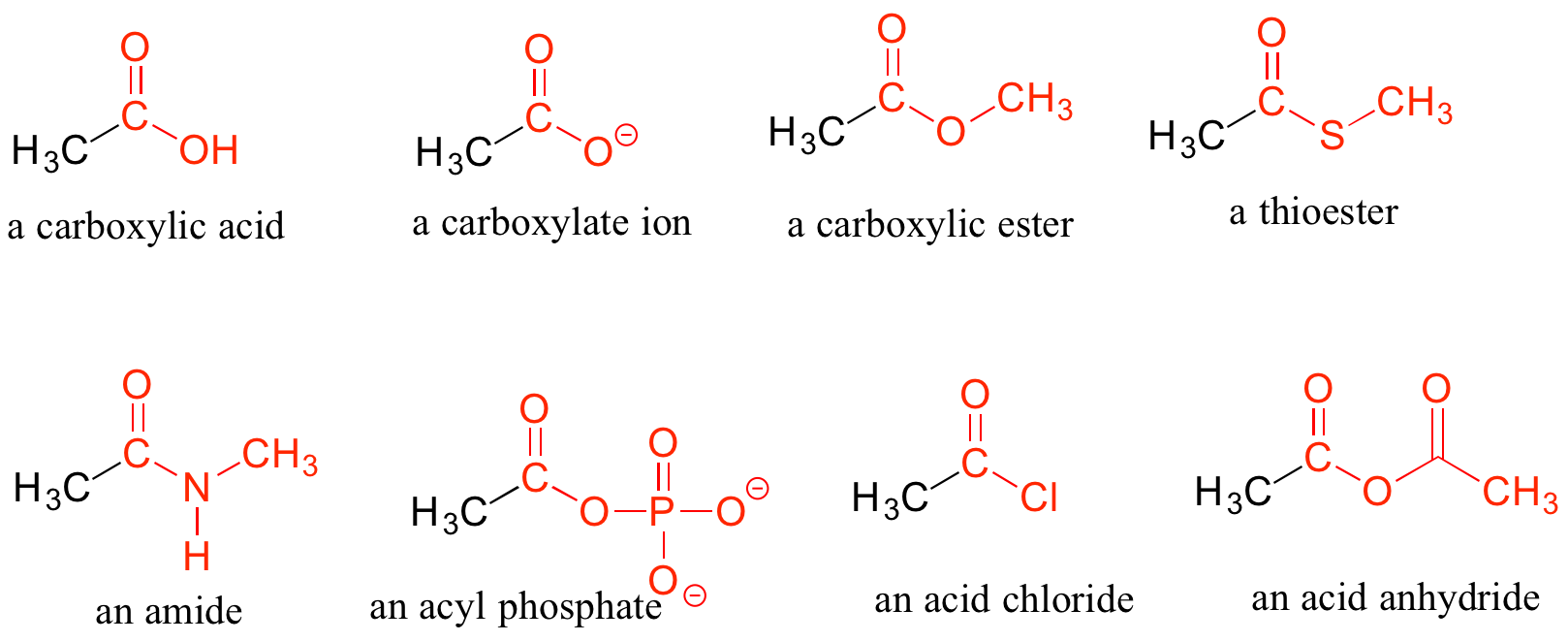
Cuando un carbono carbonilo está unido por un lado a un carbono (o hidrógeno) y por el otro lado a un oxígeno, nitrógeno o azufre, se considera que el grupo funcional es uno de los “derivados de ácido carboxílico”, designación que describe un conjunto de grupos funcionales relacionados. El miembro homónimo de esta familia es el grupo funcional ácido carboxílico, en el que el carbonilo está unido a un grupo hidroxilo. La base conjugada de un ácido carboxílico es un carboxilato. Otros derivados son ésteres carboxílicos (generalmente llamados simplemente 'ésteres'), tioésteres, amidas, fosfatos de acilo, cloruros de ácido y anhidridos de ácido. Con excepción de cloruros de ácido y anhidridos de ácido, los derivados de ácido carboxílico son muy comunes en moléculas biológicas y/o vías metabólicas, y su estructura y reactividad se discutirán en detalle en el capítulo 11.
Finalmente, un grupo nitrilo se caracteriza por un carbono triple-enlazado a un nitrógeno.

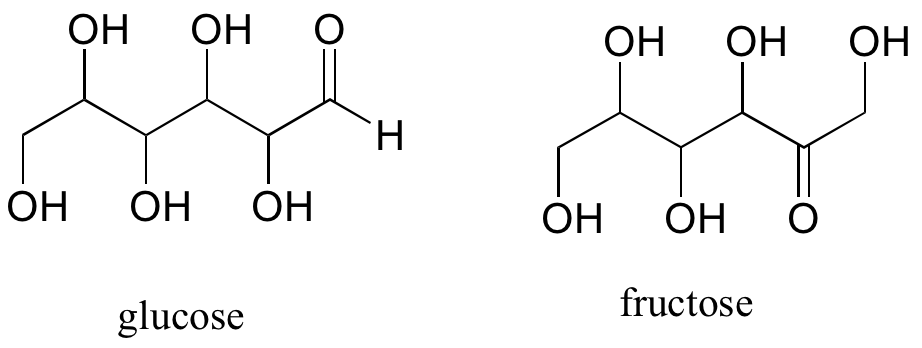
Un solo compuesto a menudo contiene varios grupos funcionales, particularmente en química orgánica biológica. Las moléculas de azúcar de seis carbonos glucosa y fructosa, por ejemplo, contienen grupos aldehído y cetona, respectivamente, y ambas contienen cinco grupos alcohol (un compuesto con varios grupos alcohol a menudo se conoce como un 'poliol').
La hormona testosterona, el aminoácido fenilalanina y el metabolito de la glucólisis dihidroxiacetona fosfato contienen múltiples grupos funcionales, como se indica a continuación.
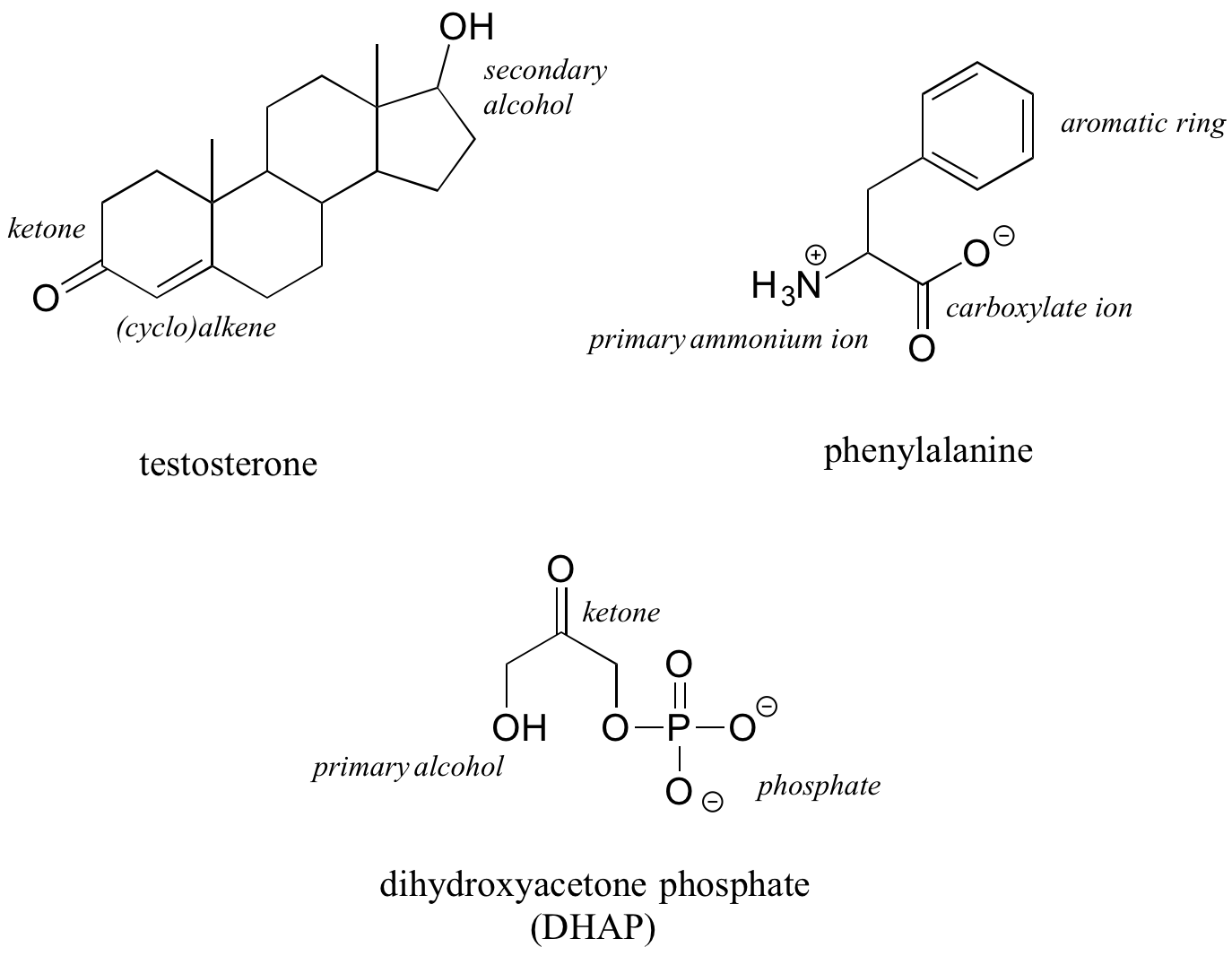
Si bien no es de ninguna manera una lista completa, esta sección ha cubierto la mayoría de los grupos funcionales importantes que encontraremos en la química orgánica biológica. El cuadro 9 en la sección de tablas al dorso de este libro proporciona un resumen de todos los grupos enumerados en esta sección, además de algunos más que se introducirán más adelante en el texto.
Ejercicio 1.12
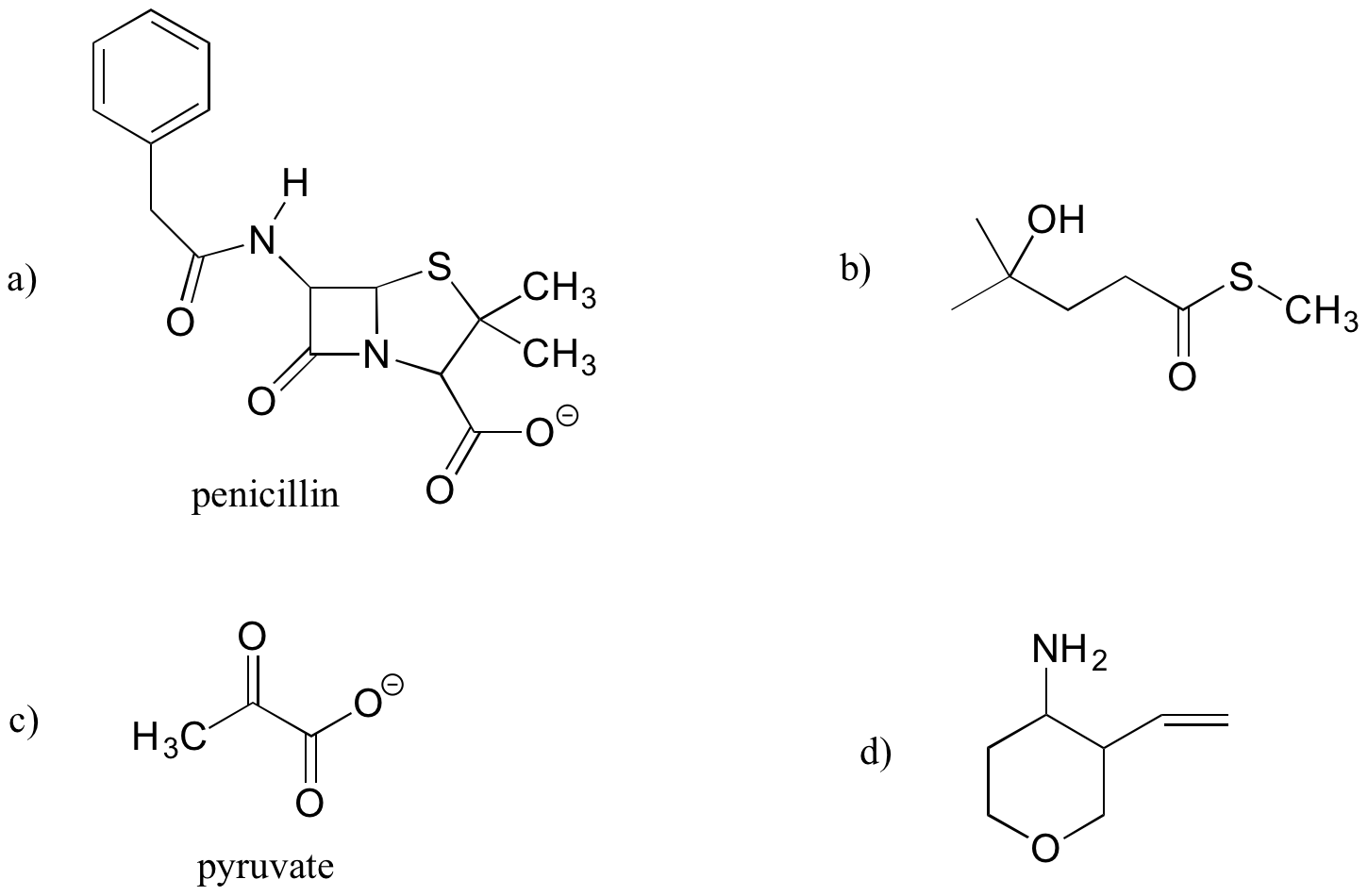
Identificar los grupos funcionales (distintos de los alcanos) en los siguientes compuestos orgánicos. Afirma si los alcoholes y las aminas son primarios, secundarios o terciarios.
Soluciones a ejercicios
Ejercicio 1.13
Dibuje un ejemplo de cada uno de los compuestos que se ajusten a las descripciones a continuación, utilizando estructuras Asegúrese de designar la ubicación de todos los cargos formales distintos de cero. Todos los átomos deben tener octetos completos (el fósforo puede exceder la regla del octeto). Hay muchas posibles respuestas correctas para estas, así que asegúrate de revisar tus estructuras con tu instructor o tutor.
a) un compuesto con fórmula molecular C 6 H 11 NO que incluye grupos funcionales alqueno, amina secundaria y alcohol primario
b) un ion con fórmula molecular C 3 H 5 O 6 P 2- que incluye grupos funcionales aldehído, alcohol secundario y fosfato.
c) Un compuesto con fórmula molecular C 6 H 9 NO que tiene un grupo funcional amida, y no tiene un grupo alqueno.
Nombrar compuestos orgánicos
Un sistema ha sido ideado por la Unión Internacional de Química Pura y Aplicada (IUPAC, generalmente pronunciado eye -you-pack) para nombrar compuestos orgánicos. Si bien el sistema IUPAC es conveniente para nombrar compuestos orgánicos simples y relativamente pequeños, generalmente no se usa en la nomenclatura de biomoléculas, que tienden a ser bastante grandes y complejas. Sin embargo, es una buena idea (incluso para los biólogos) familiarizarse con la estructura básica del sistema IUPAC, y poder dibujar estructuras simples basadas en nombres de la IUPAC.
Nombrar un compuesto orgánico generalmente comienza con identificar lo que se conoce como la 'cadena parental', que es la cadena lineal más larga de átomos de carbono. Comenzaremos con las estructuras de alcanos de cadena recta más simples. CH 4 se llama metano, y C 2 H 6 etano. La siguiente tabla continúa con los nombres de alcanos de cadena lineal más largos: asegúrese de comprometerlos a la memoria, ya que son la base para el resto del sistema de nomenclatura de la IUPAC (y también son ampliamente utilizados para nombrar biomoléculas).
1 carbono: metano
2 carbonos: etano
3 carbonos: propano
4 carbonos: butano
5 carbonos: pentano
6 carbonos: hexano
7 carbonos: heptano
8 carbonos: octano
9 carbonos: nonano
10 carbonos: decano
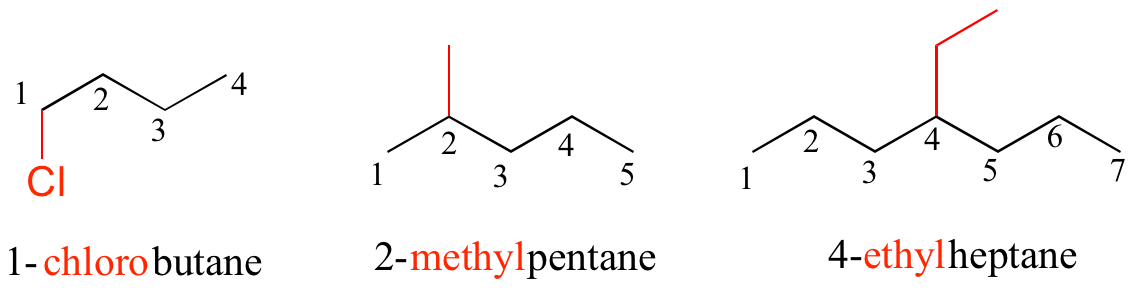
Los sustituyentes que se ramifican de la cadena parental principal se localizan por un número de carbonos, utilizándose los números más bajos posibles (por ejemplo, observe en el ejemplo siguiente que el compuesto de la izquierda se denomina 1-clorobutano, no 4-clorobutano). Cuando los sustituyentes son grupos alquilo pequeños, se usan los términos metilo, etilo y propilo.
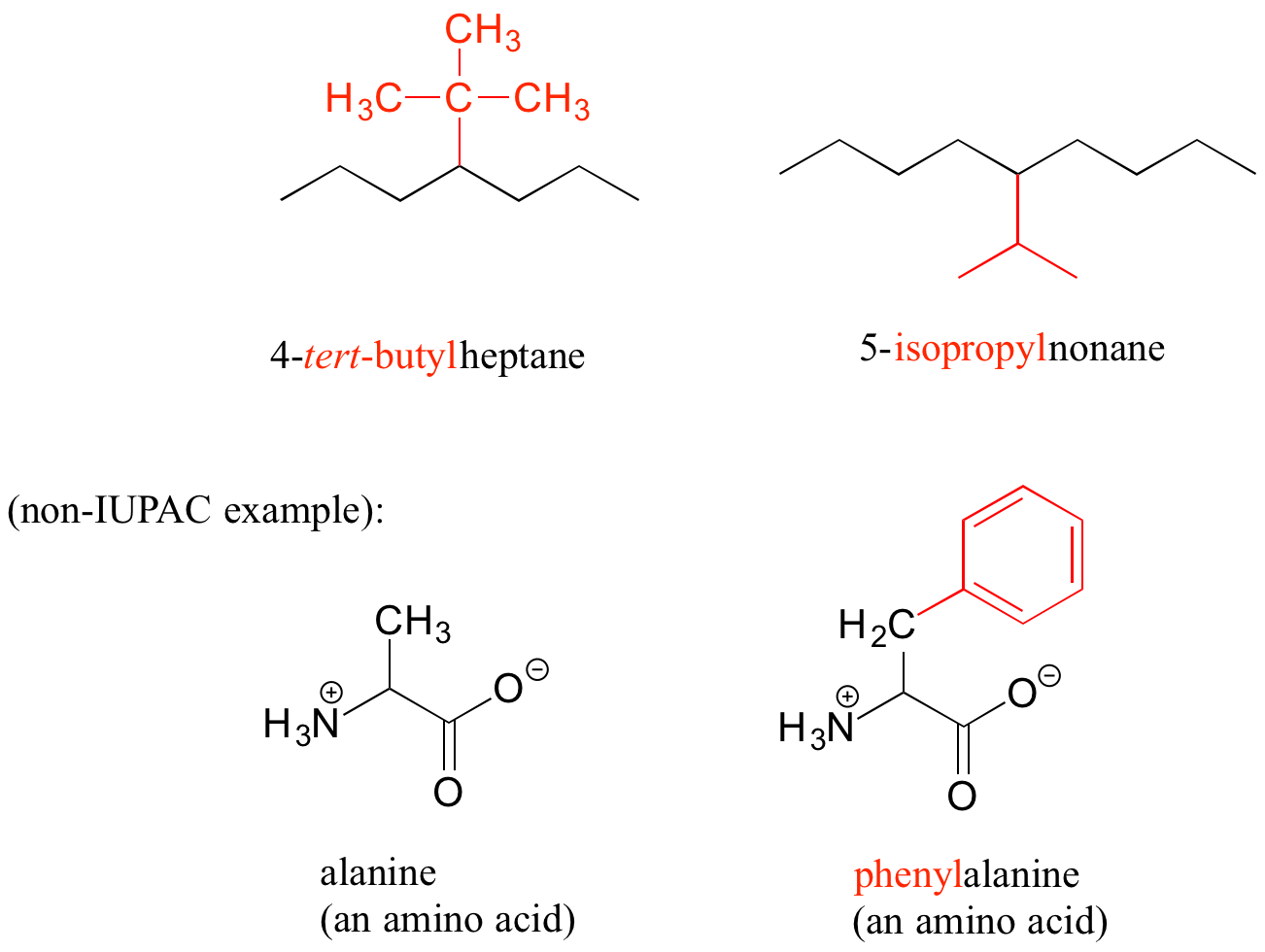
Otros nombres comunes para los grupos sustituyentes hidrocarbonados son isopropilo, terc-butilo y fenilo.
Observe en el siguiente ejemplo, un 'grupo etilo' (en azul) no se trata como sustituyente, más bien se incluye como parte de la cadena parental, y el grupo metilo se trata como sustituyente. El nombre de la IUPAC para los hidrocarburos de cadena lineal siempre se basa en la cadena parental más larga posible, que en este caso es de cuatro carbonos, no tres.

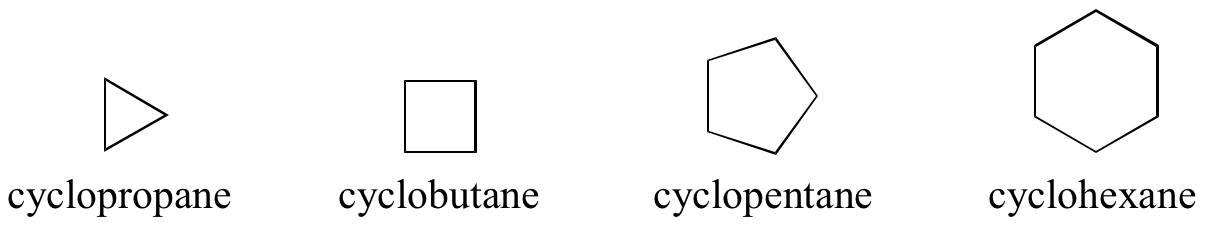
Los alcanos cíclicos se llaman ciclopropano, ciclobutano, ciclopentano, ciclohexano, y así sucesivamente:
En el caso de múltiples sustituyentes, se utilizan los prefijos di, tri y tetra.
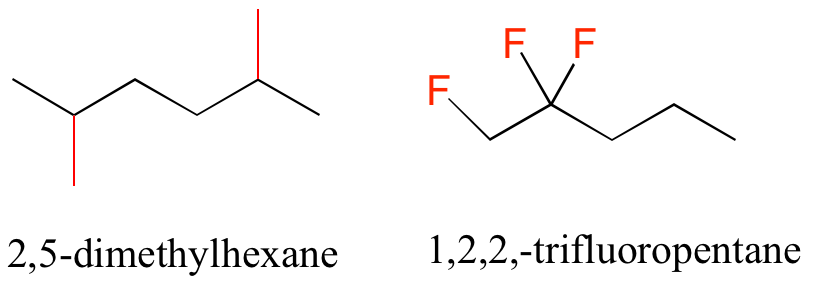
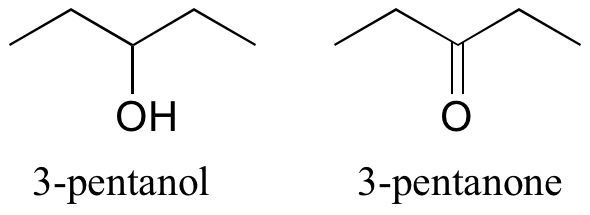
Los grupos funcionales tienen sufijos característicos. Los alcoholes, por ejemplo, tienen 'ol' anexado al nombre de la cadena parental, junto con un número que designa la ubicación del grupo hidroxilo. Las cetonas son designadas por 'uno'.
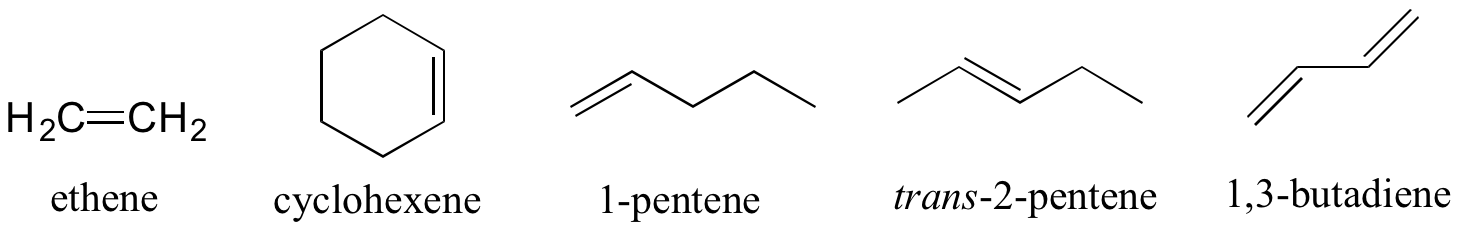
Los alquenos se designan con una terminación 'ene', y cuando sea necesario se indica la ubicación y geometría del doble enlace. Los compuestos con múltiples dobles enlaces se denominan dienos, trienos, etc.
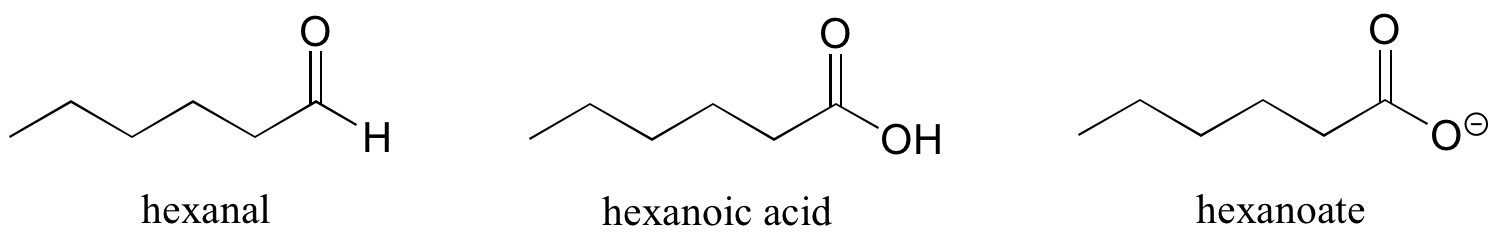
Algunos grupos solo pueden estar presentes en un carbono terminal, y por lo tanto no es necesario un número de localización: los aldehídos terminan en 'al', los ácidos carboxílicos en 'ácido oico' y los carboxilatos en 'oato'.
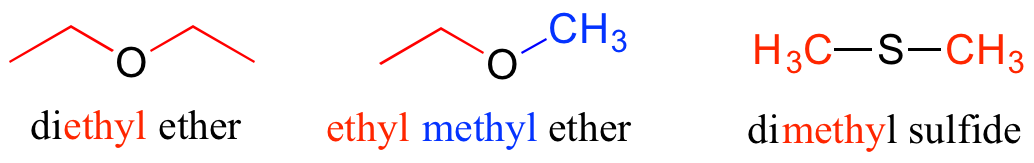
Los éteres y sulfuros se designan nombrando los dos grupos a cada lado del oxígeno o azufre.
Si una amida tiene un grupo -NH 2 no sustituido, el sufijo es simplemente 'amida'. En el caso de una amida sustituida, el grupo unido al nitrógeno de la amida se nombra primero, junto con la letra 'N' para aclarar dónde se encuentra este grupo. Tenga en cuenta que las siguientes estructuras están basadas en una cadena parental de tres carbonos (propan).

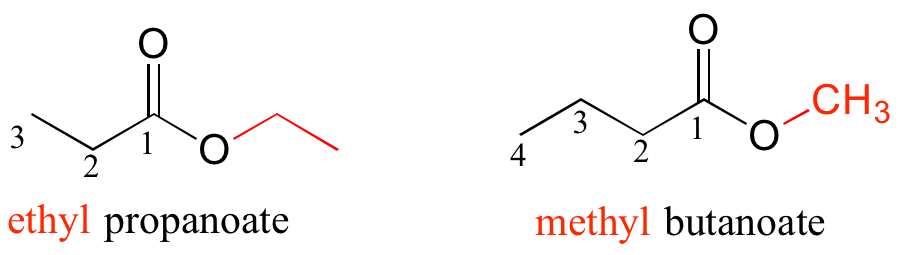
Para los ésteres, el sufijo es 'oate'. El grupo unido al oxígeno se nombra primero.
Todos los ejemplos que hemos visto hasta ahora han sido simples en el sentido de que solo un grupo funcional estaba presente en cada molécula. Por supuesto, hay muchas más reglas en el sistema de la IUPAC, y como se puede imaginar, la denominación IUPAC de moléculas más grandes con múltiples grupos funcionales, estructuras de anillo y sustituyentes puede volverse muy difícil de manejar muy rápidamente. La droga ilícita cocaína, por ejemplo, tiene el nombre de la IUPAC 'metil (1 R ,2 R ,3 S ,5 S) -3- (benzoiloxi) -8-metil-8-azabiciclo [3.2.1] octano-2-carboxilato' (este nombre incluye designaciones para estereoquímica, que es un tema estructural que no abordaremos hasta capítulo 3).

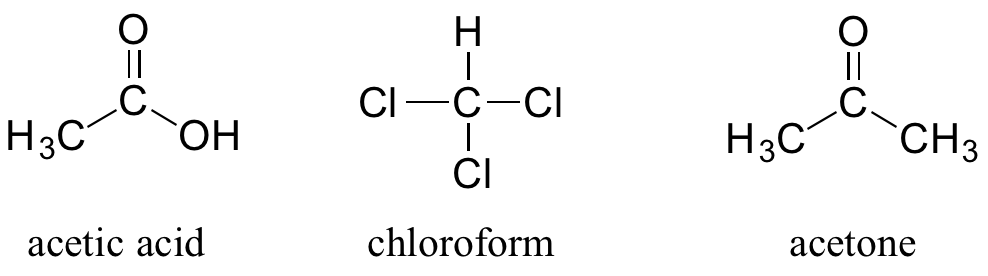
Se puede ver por qué el sistema IUPAC no se usa mucho en la química orgánica biológica - las moléculas son simplemente demasiado grandes y complejas. Otra complicación es que, incluso fuera de un contexto biológico, muchas moléculas orgánicas simples son conocidas casi universalmente por sus nombres “comunes”, en lugar de los nombres de la IUPAC. Los compuestos ácido acético, cloroformo y acetona son solo algunos ejemplos.
En bioquímica se suelen utilizar nombres no sistemáticos (como 'cocaína', 'capsaicina', 'piruvato' o 'ácido ascórbico'), y cuando se emplea la nomenclatura sistemática suele ser específica de la clase de molécula en cuestión: han evolucionado diferentes sistemas, por ejemplo, para las grasas y para los carbohidratos. No nos centraremos muy intensamente en este texto sobre la nomenclatura de la IUPAC o cualquier otro sistema de nomenclatura, pero si emprendes un estudio más avanzado en química orgánica o biológica es de esperar que aprendas uno o más sistemas de nomenclatura con algún detalle.
Ejercicio 1.14
Dé nombres de IUPAC para ácido acético, cloroformo y acetona.
Ejercicio 1.15
Dibuje estructuras lineales de los siguientes compuestos, con base en lo que ha aprendido sobre el sistema de nomenclatura de la IUPAC:
- metilciclohexano
- 5-metil-1-hexanol
- 2-metil-2-buteno
- 5-cloropentanal
- 2,2-dimetilciclohexanona
- Ácido 4-penteneoico
- N-etil-N-ciclopentilbutanamida
Soluciones a ejercicios
Dibujo de estructuras orgánicas abreviadas
A menudo, al dibujar estructuras orgánicas, a los químicos les resulta conveniente usar la letra 'R' para designar parte de una molécula fuera de la región de interés. Si solo queremos referirnos en general a un grupo funcional sin dibujar una molécula específica, por ejemplo, podemos usar 'grupos R' para centrar la atención en el grupo de interés:
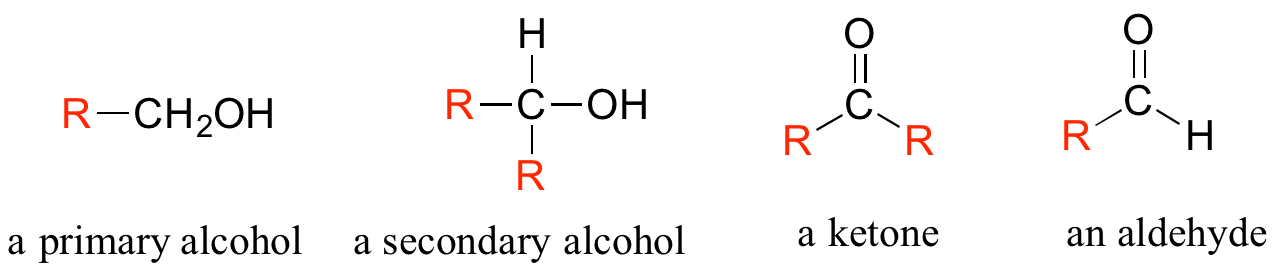
El grupo 'R' es una manera conveniente de abreviar las estructuras de grandes moléculas biológicas, especialmente cuando estamos interesados en algo que está ocurriendo específicamente en un lugar de la molécula. Por ejemplo, en el capítulo 15 cuando observamos las reacciones bioquímicas de oxidación-reducción que involucran a la molécula de flavina, abreviaremos una gran parte de la estructura de flavina que no cambia en absoluto en las reacciones de interés:
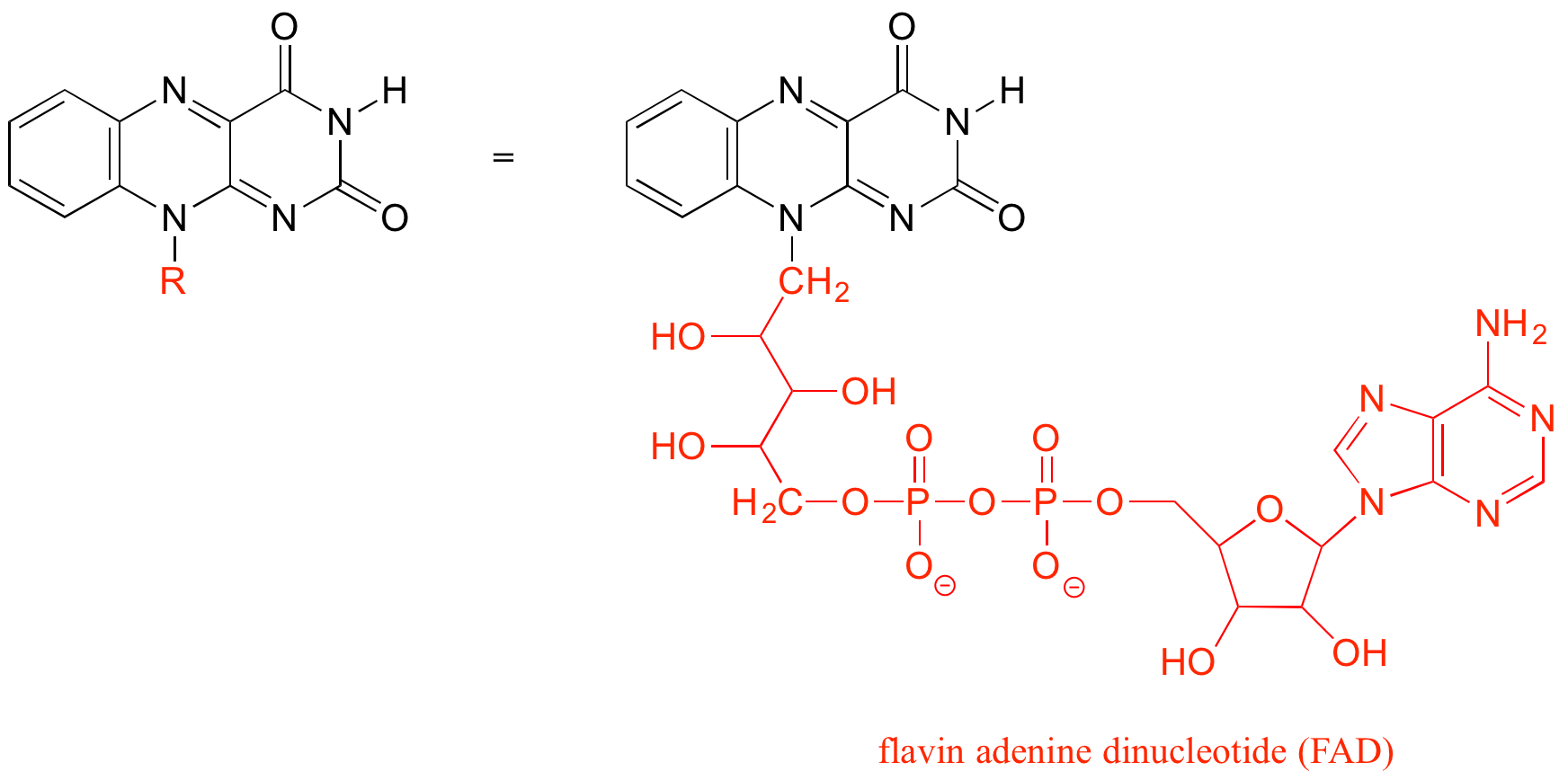
Como alternativa, podemos usar un símbolo de 'break' para indicar que estamos viendo una pequeña pieza o sección de una molécula más grande. Esto se usa comúnmente en el contexto de dibujar grupos sobre polímeros grandes como proteínas o ADN.

Finalmente, los grupos 'R' pueden ser utilizados para ilustrar de manera concisa una serie de compuestos relacionados, como la familia de antibióticos a base de penicilina.
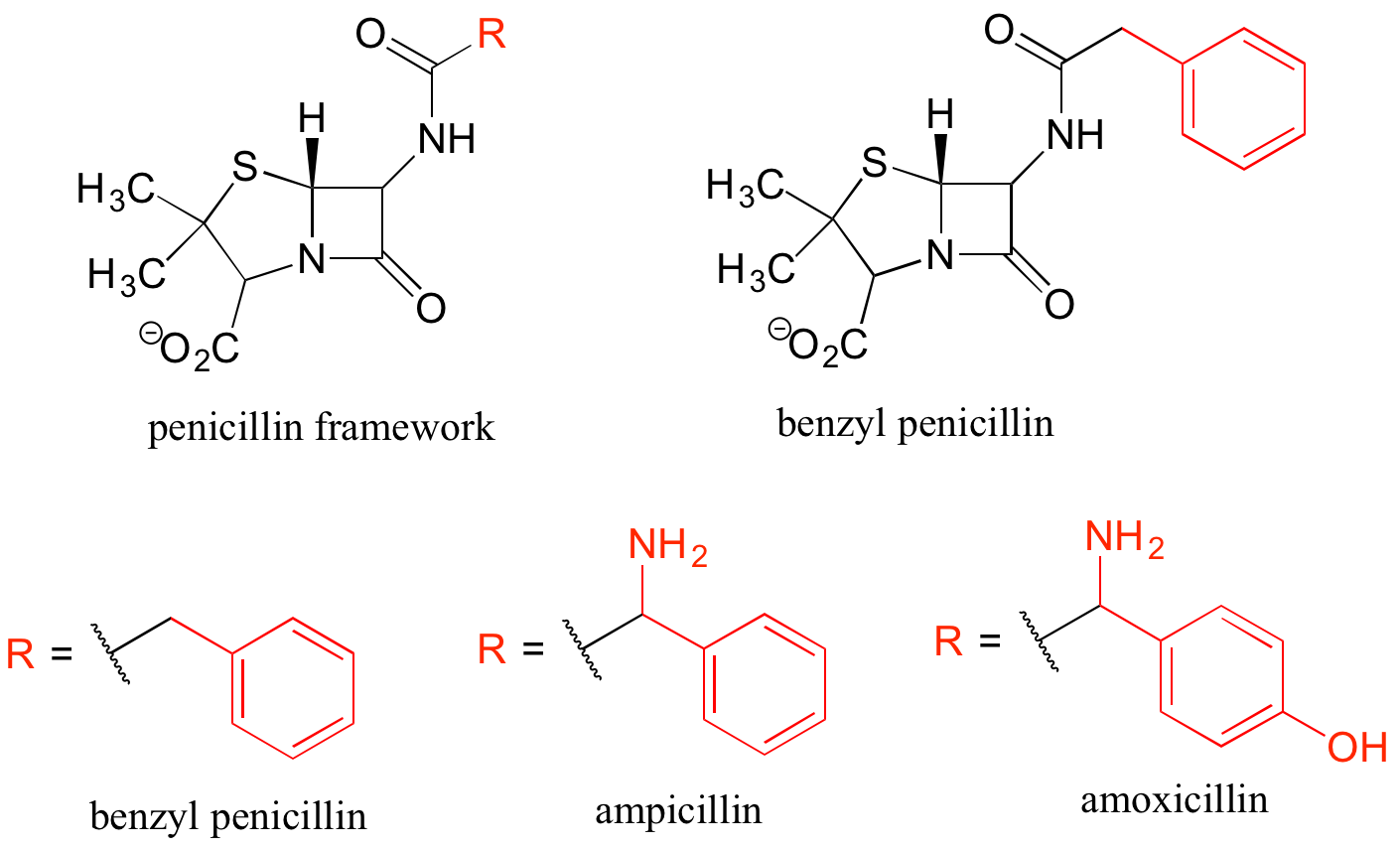
Usar abreviaturas apropiadamente es una habilidad muy importante a desarrollar al estudiar química orgánica en un contexto biológico, porque aunque muchas biomoléculas son muy grandes y complejas (¡y tardan una eternidad en dibujar!) , generalmente nos estamos enfocando en solo una pequeña parte de la molécula donde se está produciendo un cambio.
Por regla general, nunca se debe abreviar ningún átomo involucrado en un evento de ruptura o formación de enlaces que se esté ilustrando: solo abreviar aquella parte de la molécula que no está involucrada en la reacción de interés.
Por ejemplo, el carbono #2 en el reactante/producto de abajo definitivamente está involucrado en los cambios de unión, y por lo tanto no debe incluirse en el grupo 'R'.
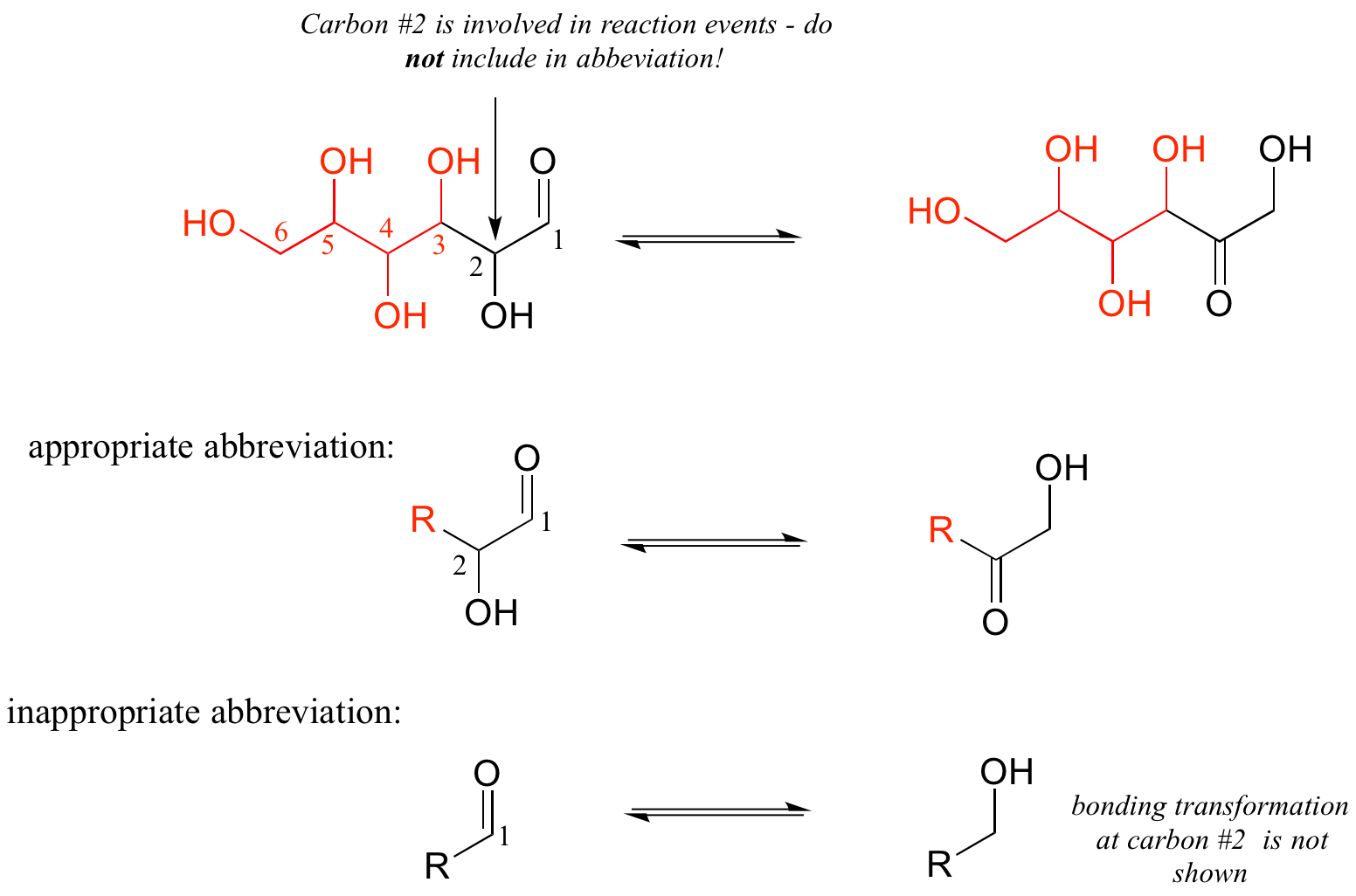
Si no estás seguro de si dibujar parte de una estructura o abreviarla, lo más seguro es sacarla.
a) Si se pretende extraer los detalles químicos de una reacción en la que el grupo funcional éster metílico de la cocaína (ver figura anterior) se convirtió en un carboxilato más metanol, lo que sería una abreviatura apropiada para usar para la estructura de la cocaína (suponiendo que solo quisieras discutir la química que ocurre específicamente en el grupo éster)?
b) A continuación se muestra la reacción (algo complicada) catalizada por una enzima conocida como 'Rubisco', mediante la cual las plantas 'fijan' el dióxido de carbono. El dióxido de carbono y el oxígeno del agua son de color rojo y azul respectivamente para ayudarte a ver dónde se incorporan esos átomos a los productos. Proponer una abreviatura apropiada para el compuesto de partida (ribulosa 1,5-bisfosfato), utilizando dos grupos 'R' diferentes, R 1 y R2.
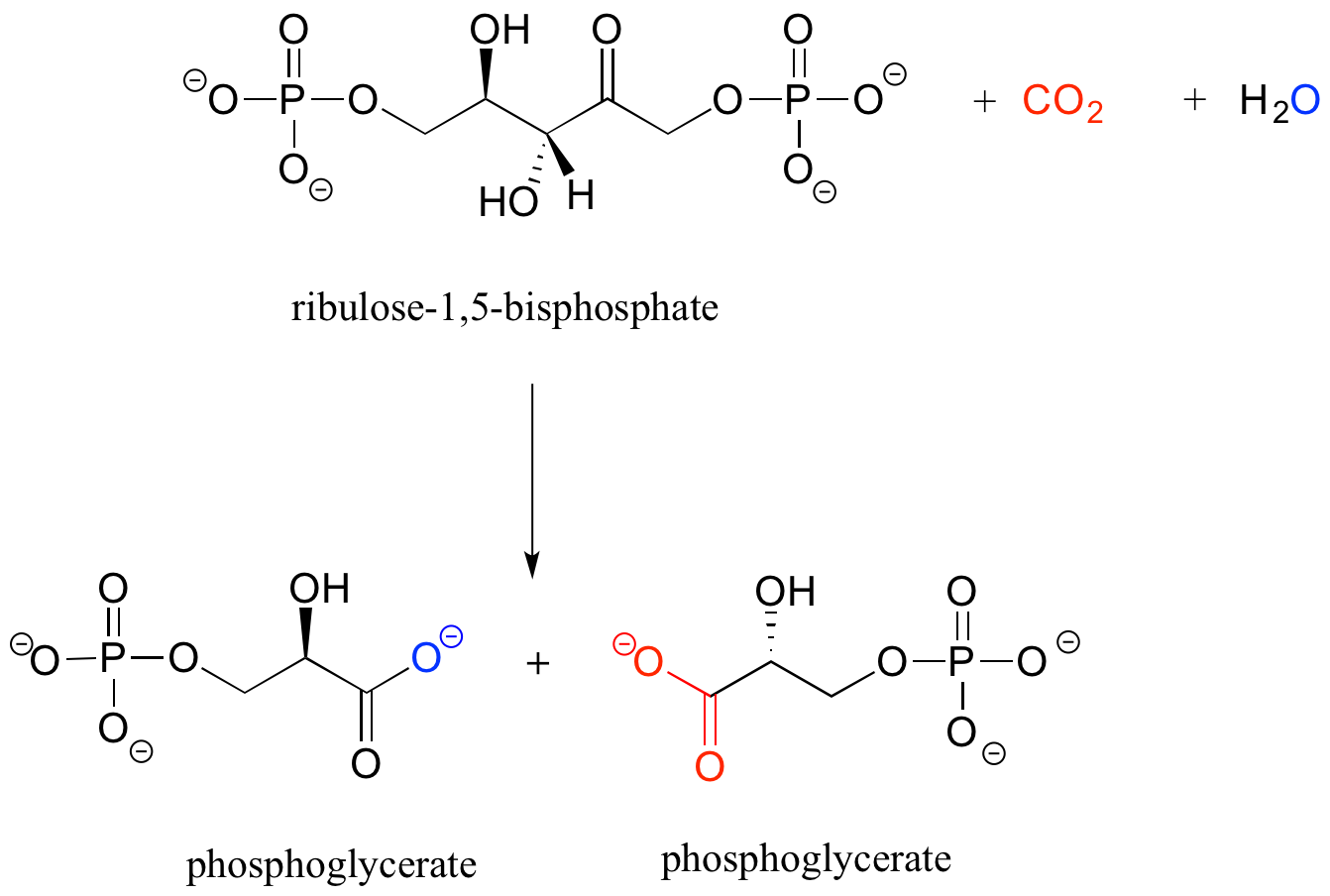
Soluciones a ejercicios


