2.3: Teoría orbital molecular- conjugación y aromaticidad
- Page ID
- 72328
La teoría de los enlaces de valencia hace un trabajo notablemente bueno al explicar la geometría de unión de muchos de los grupos funcionales en compuestos orgánicos. Hay algunas áreas, sin embargo, donde la teoría del vínculo de valencia se queda corta. No da cuenta adecuadamente, por ejemplo, de algunas propiedades interesantes de compuestos que contienen enlaces dobles y simples alternantes. Para entender estas propiedades, necesitamos pensar en la unión química de una manera nueva, utilizando las ideas de la teoría de orbitales moleculares (MO).
Volvamos y consideremos de nuevo el enlace covalente más simple posible: el del hidrógeno molecular (H 2). Cuando describimos la molécula de hidrógeno usando la teoría de enlaces de valencia, dijimos que los dos orbitales de 1 s de cada átomo se superponen, permitiendo que los dos electrones sean compartidos y formando así un enlace covalente. En la teoría orbital molecular, hacemos una declaración adicional: decimos que los dos orbitales atómicos de 1 s se combinan matemáticamente para formar dos nuevos orbitales. Recordemos que un orbital atómico (como el orbital 1s de un átomo de hidrógeno) describe una región del espacio alrededor de un solo átomo dentro del cual es probable que se encuentren electrones. Un orbital molecular describe una región del espacio alrededor de dos o más átomos dentro de los cuales es probable que se encuentren electrones.
Los principios matemáticos nos dicen que cuando los orbitales se combinan, el número de orbitales antes de que se lleve a cabo la combinación debe ser igual al número de nuevos orbitales que resultan de la combinación — ¡los orbitales no desaparecen simplemente! Esto lo vimos anteriormente cuando discutimos orbitales híbridos: uno s y tres p orbitales forman cuatro híbridos sp 3. Cuando dos orbitales atómicos de 1 s se combinan en la formación de H 2, el resultado son dos orbitales sigma (σ).

Orbitales moleculares para H 2
Según la teoría MO, un orbital sigma es menor en energía que cualquiera de los dos orbitales atómicos aislados de 1 s, este orbital sigma inferior se conoce como orbital molecular de enlace. El segundo orbital, 's igma star' (sigma*, σ*) es mayor en energía que los dos orbitales atómicos de 1 s, y se conoce como orbital molecular antienlace.
El orbital sigma de unión, que mantiene ambos electrones en el estado fundamental de la molécula, tiene forma de huevo, abarcando los dos núcleos, y con la mayor probabilidad de que los electrones estén en el área entre los dos núcleos. El orbital sigma* antiadherentes de alta energía se puede visualizar como un par de gotitas, con áreas de mayor densidad de electrones cerca de cada núcleo y un 'nodo', (área de densidad electrónica cero) a medio camino entre los dos núcleos.
Recuerda que aquí estamos pensando en el comportamiento de los electrones como comportamiento de onda. Cuando dos ondas separadas se combinan, pueden hacerlo con interferencia constructiva, donde las dos amplitudes se acumulan y refuerzan entre sí, o interferencia destructiva, donde las dos amplitudes se cancelan entre sí. Los MO de unión son consecuencia de la interferencia constructiva entre dos orbitales atómicos, lo que resulta en una interacción atractiva y un aumento de la densidad de electrones entre los núcleos. Los MO antiadherentes son consecuencia de la interferencia destructiva que resulta en una interacción repulsiva y una región de densidad electrónica cero entre los núcleos (es decir, un nodo).
Siguiendo el mismo principio aufbau ('building up') que aprendiste en Química General para escribir configuraciones de electrones, colocamos los dos electrones en la molécula H 2 en el orbital molecular de menor energía, que es el orbital sigma (de unión). El MO de unión (atrayente) está lleno, y el MO antiadhesión (repulsado) está vacío.
Teoría MO y enlaces pi conjugados
La ventaja de usar la teoría MO para entender la unión en moléculas orgánicas se hace más evidente cuando pensamos en enlaces pi. Consideremos primero el enlace pi en eteno desde el punto de vista de la teoría MO (en este ejemplo vamos a estar haciendo caso omiso de los enlaces sigma en la molécula, y pensando sólo en el enlace pi). Comenzamos con dos orbitales atómicos: uno orbital 2p no hibridado de cada carbono. Cada uno contiene un solo electrón. En la teoría MO, los dos atómicos se combinan matemáticamente para formar dos orbitales moleculares pi (π), uno orbital de enlace pi de baja energía y otro orbital antienlace pi* (π*) de alta energía.

Orbitales moleculares para eteno (etileno)
En el orbital pi de unión, los dos lóbulos sombreados de los orbitales p interactúan constructivamente entre sí, al igual que los dos lóbulos no sombreados (recuerde, la elección de sombreado arbitraria representa signos matemáticos (+) y (-) para la función de onda matemática que describe la órbita). Hay una mayor densidad de electrones entre los dos núcleos de carbono en el orbital molecular, es una interacción de unión.
En el orbital pi* antiadhesión de mayor energía, el lóbulo sombreado de un orbital p interactúa destructivamente con el lóbulo no sombreado del segundo orbital p, conduciendo a un nodo entre los dos núcleos y repulsión general entre los núcleos de carbono.
Nuevamente usando el principio de 'construcción', colocamos los dos electrones en el orbital molecular pi de unión de menor energía. El orbital pi* antiadhesión permanece vacío.
A continuación, consideraremos la molécula de 1,3-butadieno. Solo de la teoría orbital de valencia podríamos esperar que el enlace C 2-C3 en esta molécula, por tratarse de un enlace sigma, pudiera rotar libremente.

Experimentalmente, sin embargo, se observa que existe una barrera significativa a la rotación alrededor del enlace C2-C3, y que toda la molécula es plana. Además, el enlace C2-C3 tiene 148pm de largo, más corto que un enlace sencillo carbono-carbono típico (aproximadamente 154pm), aunque más largo que un doble enlace típico (aproximadamente 134pm).
La teoría orbital molecular da cuenta de estas observaciones con el concepto de enlaces pi deslocalizados. En esta imagen, los cuatro orbitales atómicos 2p se combinan matemáticamente para formar cuatro orbitales moleculares pi de energía creciente. Dos de estos -los orbitales pi de unión- son de menor energía que los orbitales p atómicos a partir de los cuales se forman, mientras que dos -los orbitales pi* antiadherentes- son más altos en energía.

El orbital molecular de menor energía, pi 1, solo tiene interacción constructiva y nodos cero. Mayor en energía, pero aún más baja que los orbitales p aislados, el orbital pi 2 tiene un nodo pero dos interacciones constructivas, por lo que sigue siendo un orbital de unión en general. Al observar los dos orbitales antiadherentes, pi 3 * tiene dos nodos y una interacción constructiva, mientras que pi 4 * tiene tres nodos y cero interacciones constructivas.
Por el principio aufbau, los cuatro electrones de los orbitales atómicos aislados de 2 p z se colocan en los MO de unión pi 1 y pi 2. Debido a que pi 1 incluye interacción constructiva entre C 2 y C 3, hay un grado, en la molécula de 1,3-butadieno, de interacción de unión pi entre estos dos carbonos, lo que explica su longitud más corta y la barrera a la rotación. La imagen de enlace de valencia de 1,3-butadieno muestra que los dos enlaces pi están aislados entre sí, con cada par de electrones pi 'pegados' en su propio enlace pi. Sin embargo, la teoría orbital molecular predice (con precisión) que los cuatro electrones pi están en cierta medida deslocalizados, o 'dispersados', sobre todo el sistema pi.

El 1,3-butadieno es el ejemplo más simple de un sistema de enlaces pi conjugados. Para ser considerados conjugados, dos o más enlaces pi deben estar separados por un solo enlace sencillo, es decir, no puede haber un carbono hibridado sp 3 intermedio, porque esto rompería el sistema de superposición de orbitales p paralelos. En el siguiente compuesto, por ejemplo, se conjugan los dobles enlaces C1-C2 y C3-C4, mientras que el doble enlace C 6-C7 se aísla de los otros dos enlaces pi mediante C hibridado sp 3 5.

Un concepto muy importante a tener en cuenta es que existe una estabilidad termodinámica inherente asociada a la conjugación. Esta estabilidad se puede medir experimentalmente comparando el calor de hidrogenación de dos dienos diferentes. (La hidrogenación es un tipo de reacción del que aprenderemos mucho más en el capítulo 15: esencialmente, es el proceso de agregar una molécula de hidrógeno -dos protones y dos electrones- a un enlace pi). Cuando los dos dobles enlaces conjugados de 1,3-pentadieno se 'hidrogenan' para producir pentano, se liberan aproximadamente 225 kJ por mol de pentano formado. Compare eso con los aproximadamente 250 kJ/mol liberados cuando se hidrogenan los dos dobles enlaces aislados en 1,4-pentadieno, formando también pentano.

El dieno conjugado es menor en energía: en otras palabras, es más estable. En general, los enlaces pi conjugados son más estables que los enlaces pi aislados.
Los sistemas pi conjugados pueden involucrar átomos de oxígeno y nitrógeno, así como carbono. En el metabolismo de las moléculas de grasa, algunas de las reacciones clave involucran alquenos que se conjugan con grupos carbonilo.

En el capítulo 4, veremos que la teoría MO es muy útil para explicar por qué las moléculas orgánicas que contienen sistemas extendidos de enlaces pi conjugados a menudo tienen colores distintivos. El betacaroteno, el compuesto responsable del color naranja de las zanahorias, tiene un sistema extendido de 11 enlaces pi conjugados.
Ejercicio 2.9
Identificar todos los dobles enlaces conjugados y aislados en las estructuras siguientes. Para cada sistema pi conjugado, especifique el número de orbitales p superpuestos y cuántos electrones pi se comparten entre ellos.
Ejercicio 2.10
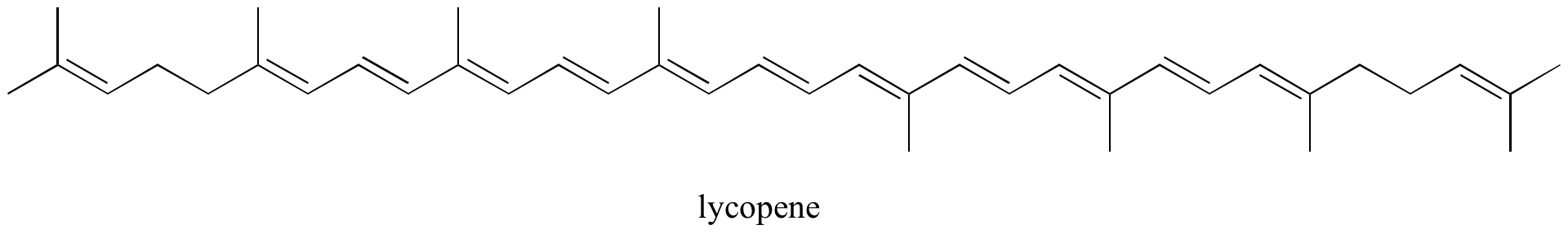
Identificar todos los dobles enlaces aislados y conjugados en licopeno, el compuesto de color rojo en tomates. ¿Cuántos electrones pi están contenidos en el sistema pi conjugado?
Soluciones a los ejercicios
Aromaticidad
La teoría orbital molecular es especialmente útil para explicar las propiedades únicas de los compuestos aromáticos como el benceno:

Modelo 3D interactivo de benceno
Aunque el benceno se dibuja con mayor frecuencia con tres dobles enlaces y tres enlaces simples, de hecho todos los enlaces carbono-carbono tienen exactamente la misma longitud (138pm). Además, los enlaces pi en benceno son significativamente menos reactivos que los enlaces pi 'normales', ya sea aislados o conjugados. Algo sobre la estructura del benceno hace que su disposición de unión pi sea especialmente estable. Este 'algo' tiene un nombre: se llama 'aromaticidad'.
¿Qué es exactamente esta propiedad 'aromática' que hace que los enlaces pi en el benceno sean tan estables? En gran parte, la respuesta a esta pregunta radica en el hecho de que el benceno es una molécula cíclica en la que todos los átomos del anillo están hibridados sp 2. Esto permite que los electrones pi se deslocalicen en orbitales moleculares que se extienden alrededor del anillo, por encima y por debajo del plano. Para que esto suceda, por supuesto, el anillo debe ser plano —de lo contrario los orbitales p no podrían superponerse adecuadamente. De hecho, se sabe que el benceno es una molécula plana.
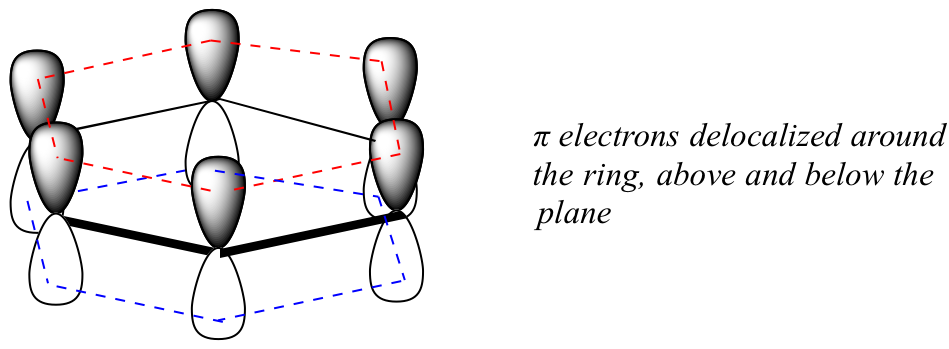
¿Todas las moléculas cíclicas con enlaces simples y dobles alternantes tienen esta misma estabilidad aromática? La respuesta, de hecho, es 'no'. El anillo de ciclooctatetraeno de ocho miembros que se muestra a continuación no es plano, y sus enlaces pi reaccionan como alquenos 'normales'. π
Claramente se necesita algo más para ser aromático, y esto se puede explicar mejor con la teoría orbital molecular. Veamos un diagrama de energía de los orbitales moleculares pi en benceno.
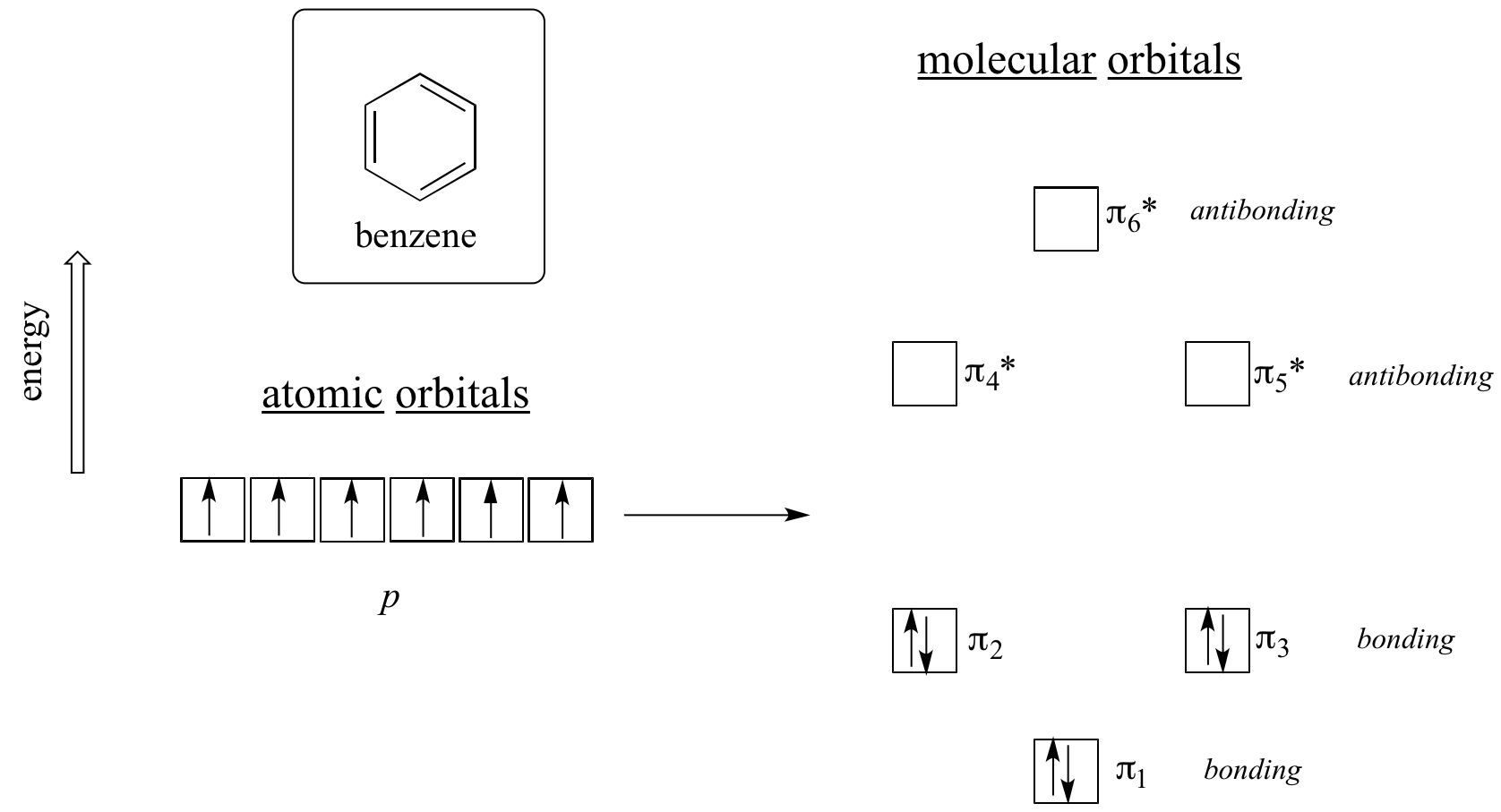
Los cálculos mecánicos cuánticos nos dicen que los seis orbitales moleculares pi en benceno, formados a partir de seis orbitales p atómicos, ocupan cuatro niveles de energía separados. pi 1 y pi 6 * tienen niveles de energía únicos, mientras que los pi 2 - pi 3 y pi 4 *- pi 5 * los pares son degenerados, es decir, están en el mismo nivel de energía. Cuando utilizamos el principio aufbau para llenar estos orbitales con los seis electrones pi en benceno, vemos que los orbitales de unión están completamente llenos, y los orbitales antiadherentes están vacíos. Esto nos da una buena pista sobre la fuente de la estabilidad especial del benceno: un conjunto completo de MO de unión es similar en muchos aspectos a la 'capa completa' de electrones en los orbitales atómicos de los gases nobles estables helio, neón y argón.
Ahora, hagamos lo mismo con el ciclooctatetraeno, que ya aprendimos no es aromático.
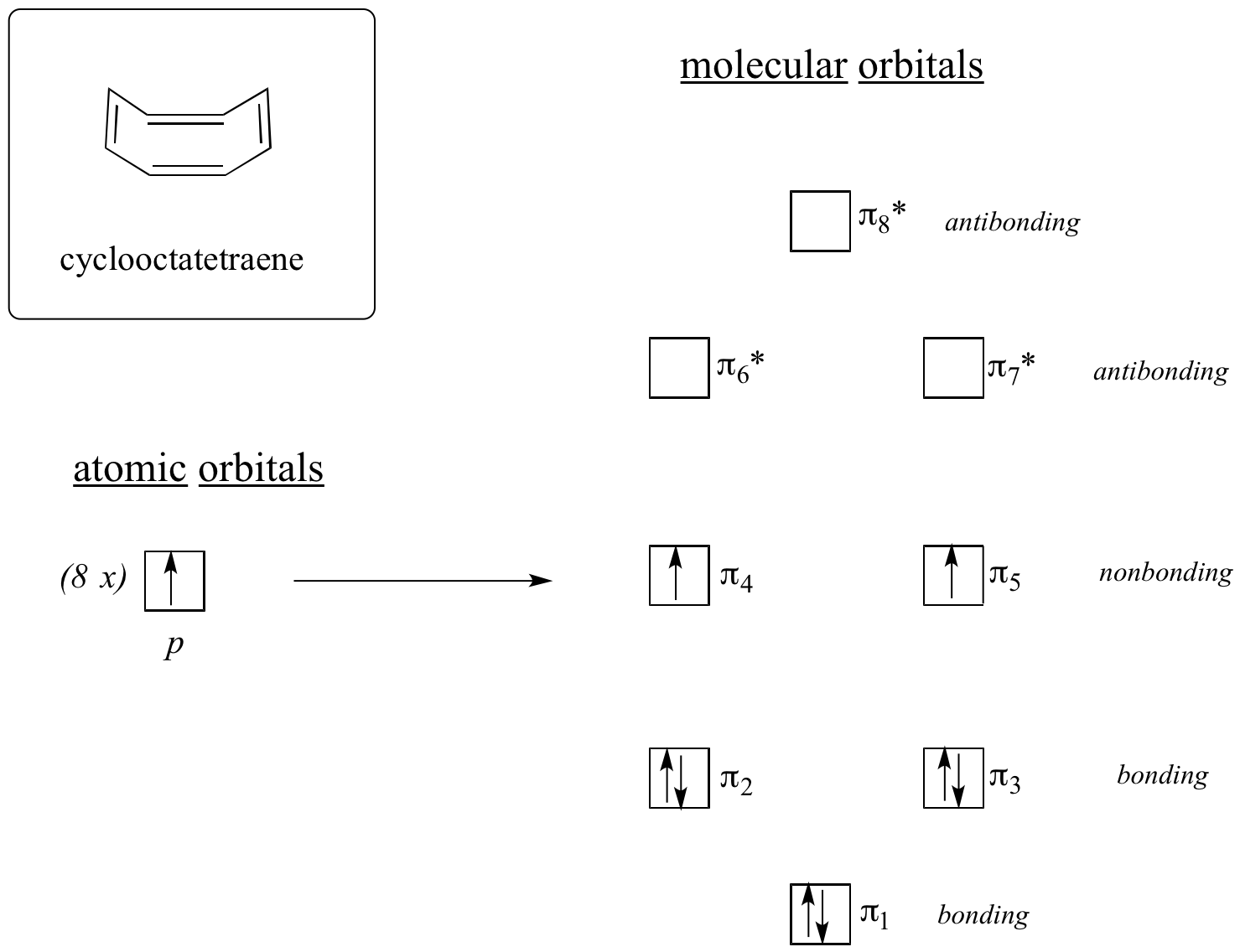
El resultado de los cálculos orbitales moleculares nos dice que los MOS de menor y mayor energía (pi 1 y pi 8 *) tienen niveles de energía únicos, mientras que los otros seis forman pares degenerados. Observe que pi 4 y pi 5 están en el mismo nivel de energía que los orbitales atómicos aislados de 2 p z: por lo tanto, estos no son ni enlazantes ni antiadherentes, más bien se les conoce como MO no enlazantes. Al llenar los MO con los ocho electrones pi en la molécula, encontramos que los dos últimos electrones están desapareados y caen en los dos orbitales degenerados no enlazantes. Debido a que no tenemos una capa llena perfecta de MO de unión, nuestra molécula no es aromática. Como consecuencia, cada uno de los dobles enlaces en el ciclooctatetraeno actúa más como un doble enlace aislado.
Aquí, entonces, están las condiciones que deben cumplirse para que una molécula o grupo sea considerado aromático:
La molécula o grupo debe ser cíclico.
El anillo debe ser plano.
Cada átomo en el anillo debe ser sp 2 -hibridado.
El número de electrones pi en el anillo debe ser igual a 4 n +2, donde n es cualquier número entero positivo incluyendo cero.
La regla #4 es conocida como la regla Hückel, llamada así por Erich Hückel, un científico alemán que estudió compuestos aromáticos en la década de 1930. Si n = 0, el número de Hückel es 2. Si n = 1, el número de Hückel es 6 (el número de Hückel para benceno). La serie continúa con 10, 14, 18, 22, y así sucesivamente. El ciclooctatetraeno tiene ocho electrones pi, que no es un número de Hückel. Debido a que seis es un número de Hückel tan común, los químicos suelen utilizar el término 'sexteto aromático'.
Los anillos de benceno son ubicuos en biomoléculas y fármacos; a continuación se muestran solo algunos ejemplos.
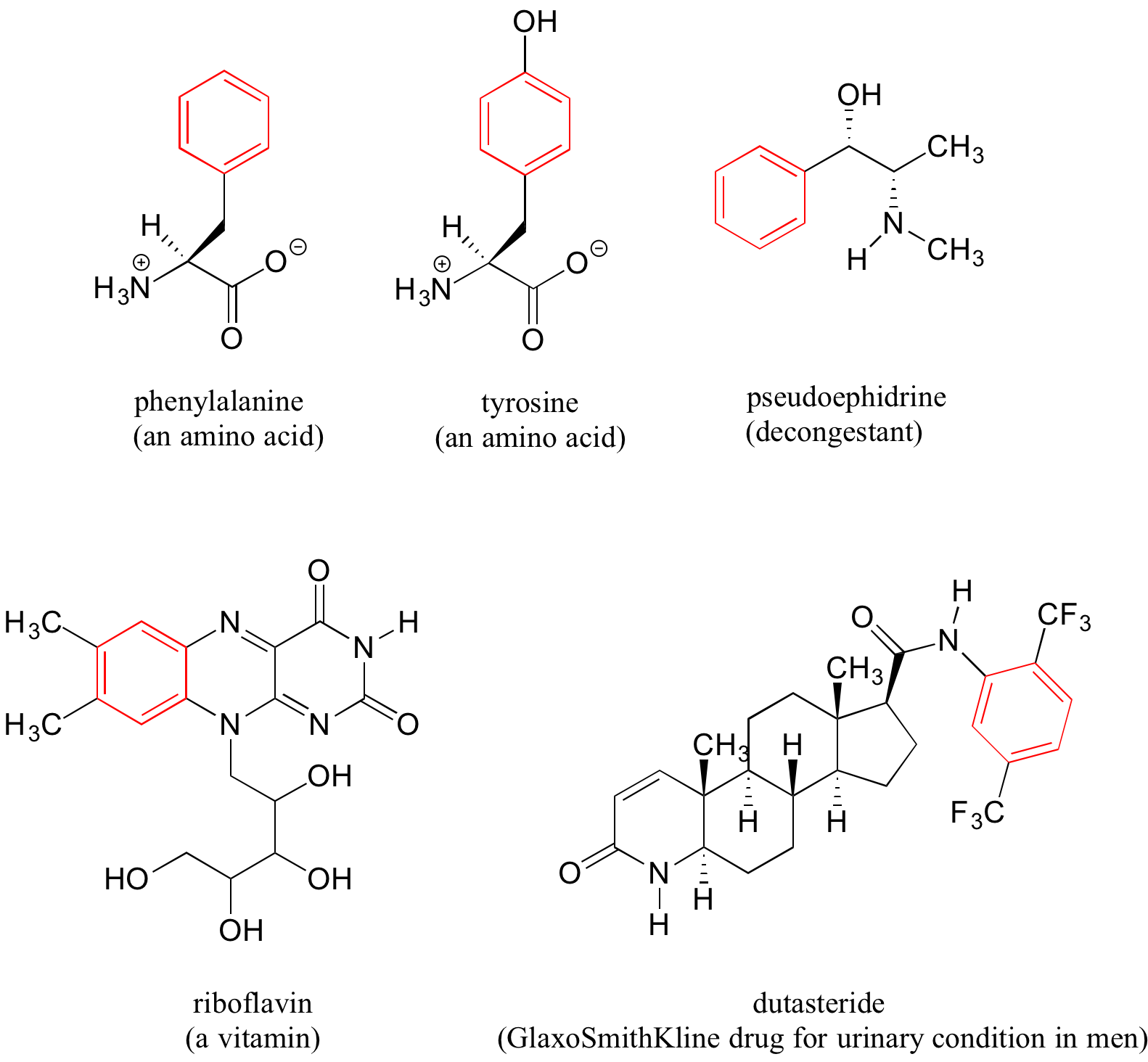
Recordemos que un anillo de benceno con un sustituyente hidoxilo -tal como se ve en la estructura tirosina anterior- se llama fenol.
Los heterociclos -estructuras cíclicas en las que los átomos del anillo pueden incluir oxígeno o nitrógeno- también pueden ser aromáticos. La piridina, por ejemplo, es un heterociclo aromático. En el cuadro de unión para piridina, el nitrógeno se hibrida con sp 2, con dos de los tres orbitales sp 2 formando solapamientos sigma con los orbitales sp 2 de átomos de carbono vecinos, y el tercer nitrógeno sp 2 orbital que contiene el par solitario. El orbital p no hibridado contiene un solo electrón, que es parte del sistema de 6 electrones pi deslocalizado alrededor del anillo.
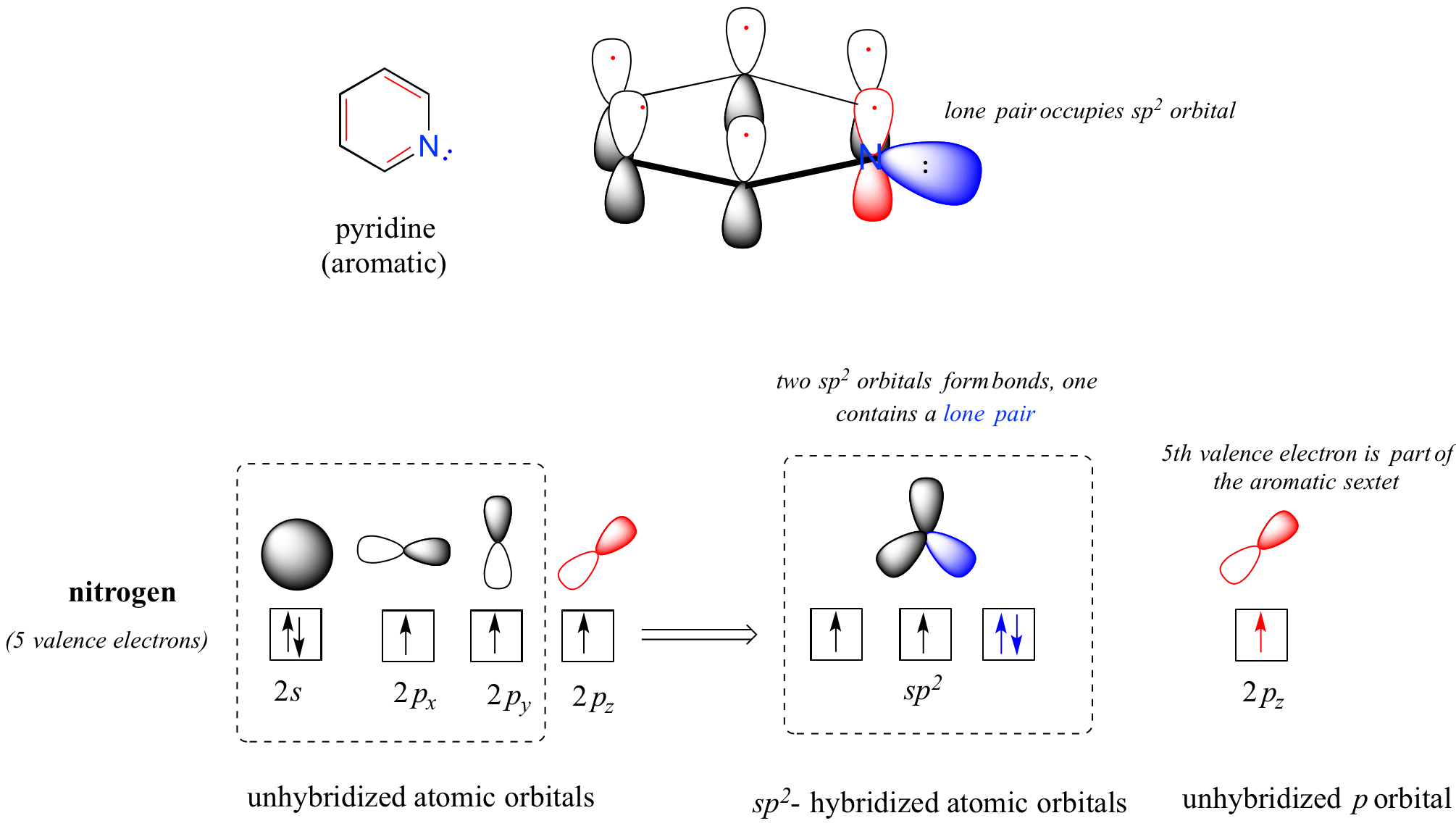
otra imagen de orbitales en piridina
La piridoxina, comúnmente conocida como vitamina B 6, y la nicotina son piridinas sustituidas.

El pirrol es un heterociclo aromático de cinco miembros. En pirrol, los electrones del par solitario en el nitrógeno hibridado sp 2 son parte del sexteto aromático (contrasta esto con la piridina, donde el par solitario ocupa uno de los orbitales híbridos sp 2).
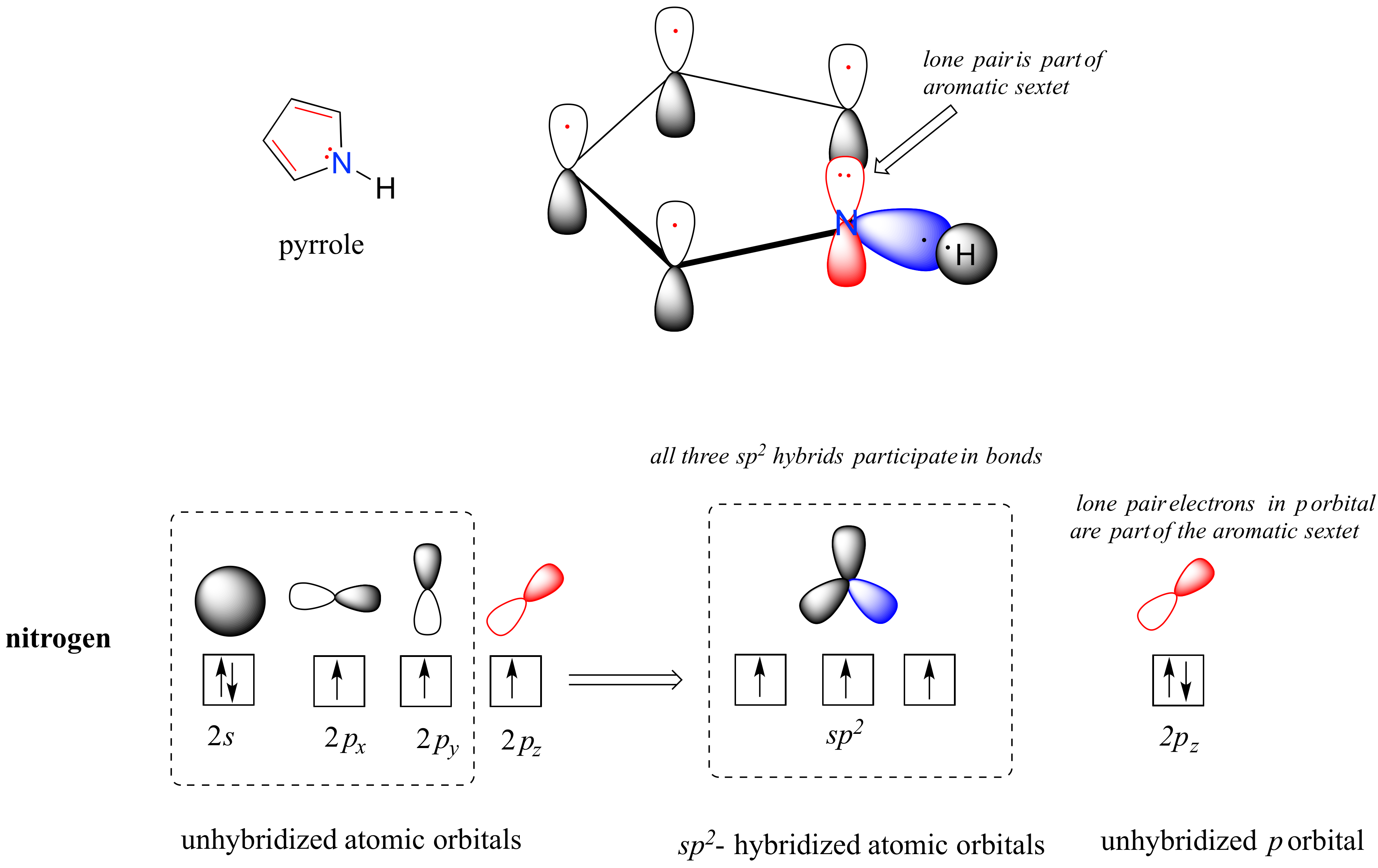
¿Por qué no asumimos que el nitrógeno en el pirrol está hibridado en s p 3, como una amina secundaria normal? La respuesta es simple: si así fuera, entonces el pirrol no podría ser aromático, y así no tendría la estabilidad asociada a la aromaticidad. En general, si una molécula o grupo puede ser aromático, lo será, así como el agua siempre fluirá cuesta abajo si hay una vía de descenso disponible.
El imidazol es otro ejemplo importante de un heterociclo aromático que se encuentra en las biomoléculas: la cadena lateral del aminoácido histidina contiene un anillo de imidazol.
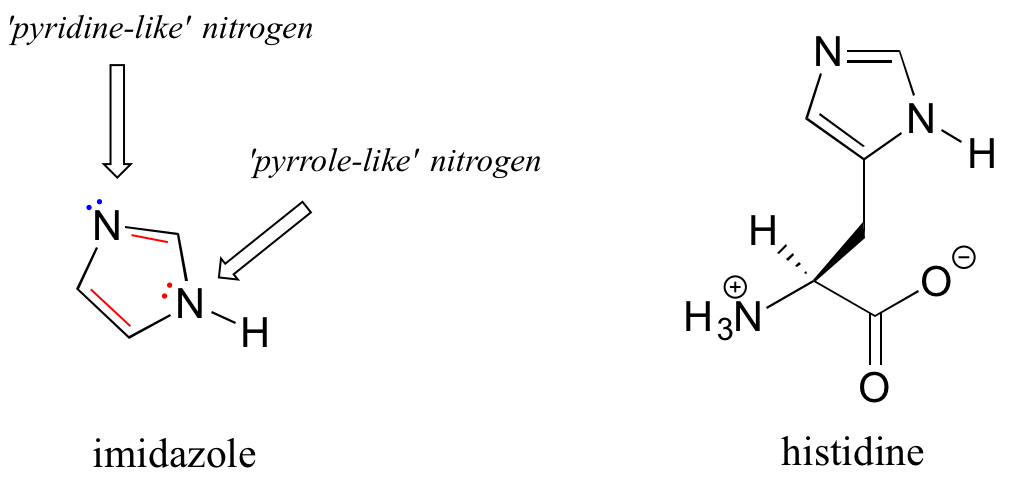
En imidazol, un nitrógeno es 'pirrol' (el par solitario contribuye al sexteto aromático) y otro es 'similar a piridina' (el par solitario se localiza en un orbital sp 2, y no es parte del sexteto aromático).
Las estructuras de anillos fusionados también pueden cumplir los criterios de Hückel, y a menudo tienen muchas de las mismas propiedades que los compuestos aromáticos monocíclicos, incluida una estructura plana. El indol (un grupo funcional en la cadena lateral del aminoácido triptófano) y la purina (que se encuentra en las bases nucleotídicas de guanina y adenina) tienen un total de diez electrones pi deslocalizados alrededor de dos anillos.
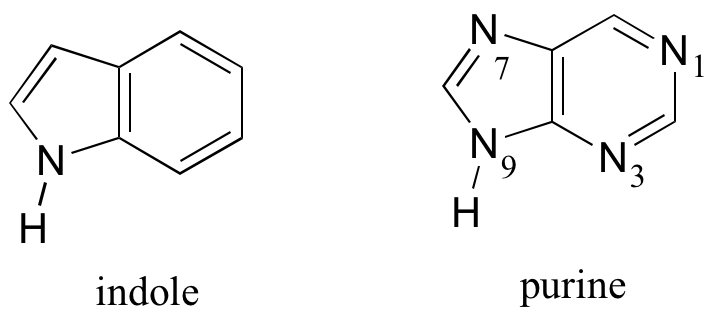
Las bases de ácido nucleico del ADN y ARN -guanina, adenina, citosina, timina y uracilo- son todos sistemas aromáticos, con las propiedades aromáticas características de planaridad y densidad de electrones pi deslocalizados. Cuando estudias la estructura y función del ADN y ARN en un curso de bioquímica o biología molecular, verás que la forma plana de las bases juega un papel críticamente importante.

Ejercicio 2.11
Clasificar los átomos de nitrógeno del indol y la purina como 'pirrole-like' o 'pyridine-like', en términos de dónde se encuentran los electrones del par solitario.
Ejercicio 2.12
¿Las siguientes moléculas/iones son aromáticas? Explique, utilizando criterios que aprendió en esta sección.
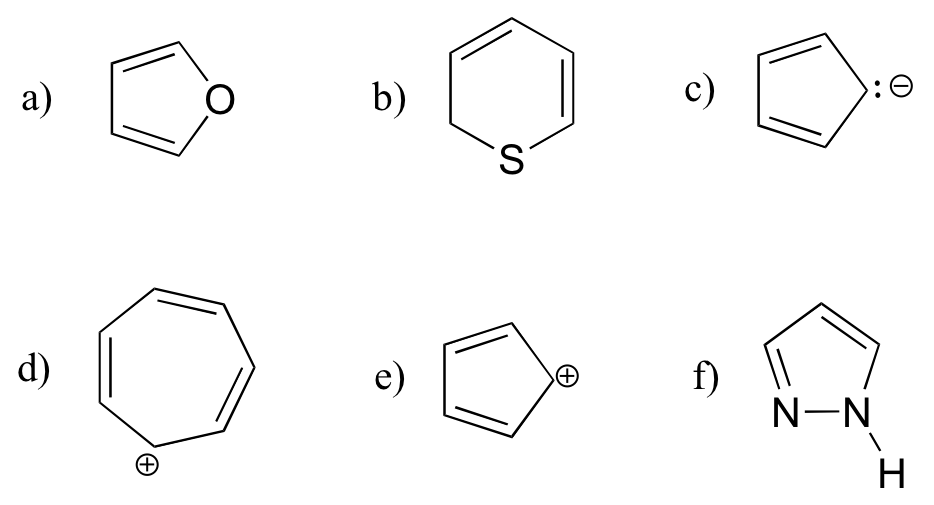
Soluciones a los ejercicios


