2.4: Resonancia
- Page ID
- 72317
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)¿Qué es la resonancia?
Si tuviéramos que dibujar la estructura de una molécula aromática como el 1,2-dimetilbenceno, hay dos formas en las que podríamos dibujar los dobles enlaces:

¿Cuál es el camino correcto? Hay dos respuestas simples a esta pregunta: 'ambas' y 'ninguna de las'. Ambas formas de dibujar la molécula son aproximaciones igualmente aceptables de la imagen de unión para la molécula, pero ninguna, por sí misma, es una imagen precisa de los enlaces pi deslocalizados. Los dos dibujos alternativos, sin embargo, cuando se consideran juntos, dan una imagen mucho más precisa que cualquiera de los dos por sí solo. Esto se debe a que implican, en conjunto, que los enlaces carbono-carbono no son dobles enlaces, no enlaces simples, sino aproximadamente a mitad de camino entre ellos.
Estos dos dibujos son un ejemplo de lo que se conoce en la química orgánica como contribuyentes de resonancia: dos o más estructuras de Lewis diferentes que representan la misma molécula o ion que, cuando se consideran juntas, hacen un mejor trabajo de aproximación de enlaces pi deslocalizados que cualquier estructura única. Por convención, los contribuyentes de resonancia están vinculados por una flecha de dos puntas, y a veces están encerrados entre paréntesis:

Para facilitar la visualización de la diferencia entre dos contribuyentes de resonancia, a menudo se utilizan flechas pequeñas y curvas. Cada una de estas flechas representa el 'movimiento' de dos electrones pi. A partir de ahora en algunos capítulos, cuando comencemos a estudiar las reacciones orgánicas -un proceso en el que los desplazamientos de densidad de electrones y los enlaces covalentes entre los átomos se rompen y forman- esta 'notación de flecha curva' se volverá extremadamente importante para representar el movimiento de los electrones. En el dibujo de los contribuyentes de resonancia, sin embargo, este 'movimiento' de electrones ocurre solo en nuestras mentes, ya que tratamos de visualizar enlaces pi deslocalizados. Sin embargo, el uso de la notación de flecha curva es una habilidad esencial que necesitará desarrollar en el dibujo de contribuyentes de resonancia.
La representación del benceno usando los dos contribuyentes de resonancia A y B en la figura anterior no implica que la molécula en un momento se vea como la estructura A, luego en el momento siguiente se desplaza para parecerse a la estructura B. Más bien, en todos los momentos, la molécula es una combinación, o resonancia híbrido tanto de A como de B.
Por lo general, los derivados del benceno (y los grupos fenilo, cuando el anillo de benceno se incorpora a una estructura orgánica más grande) se representan con un solo contribuyente de resonancia, y se supone que el lector entiende que la hibridación por resonancia está implícita. Esta es la convención que se utilizará en su mayor parte en este libro. En otros libros o artículos, a veces puede verse benceno o un grupo fenilo dibujado con un círculo dentro del hexágono, ya sea sólido o discontinuo, como una forma de dibujar un híbrido de resonancia.

Contribuyentes de resonancia para el grupo carboxilato
La convención de dibujar dos o más contribuyentes de resonancia para aproximarse a una sola estructura puede parecerle un poco torpe en este punto, pero a medida que adquiera experiencia verá que la práctica es realmente muy útil a la hora de discutir la manera en que reaccionan muchos grupos funcionales. Consideremos a continuación el ion carboxilato (la base conjugada de un ácido carboxílico). Como nuestro ejemplo, usaremos formiato, la molécula que contiene carboxilato más simple posible. El ácido conjugado del formiato es el ácido fórmico, lo que provoca la dolorosa picadura que sentiste si alguna vez te ha mordido una hormiga.

Por lo general, verá grupos carboxilato dibujados con un doble enlace carbono-oxígeno y un enlace sencillo carbono-oxígeno, con una carga formal negativa ubicada en el oxígeno de enlace simple. En la actualidad, sin embargo, los dos enlaces carbono-oxígeno tienen la misma longitud, y aunque efectivamente existe una carga formal negativa general en el grupo, se comparte equitativamente entre los dos oxígenos. Por lo tanto, el carboxilato se puede representar con mayor precisión mediante un par de contribuyentes de resonancia. Alternativamente, se puede usar una sola estructura, con una línea discontinua que representa el enlace pi deslocalizado de resonancia y la carga negativa ubicada entre los dos oxígenos.

Veamos si podemos correlacionar estas convenciones de dibujo con una imagen de la teoría del enlace de valencia de la unión en un grupo carboxilato. Sabemos que el carbono debe ser sp 2 -hibridado, (los ángulos de enlace son cercanos a 120˚, y la molécula es plana), y trataremos ambos oxígenos como sp 2 -hibridados también. Ambos enlaces sigma carbono-oxígeno, entonces, se forman a partir del solapamiento de orbitales de carbono sp 2 y orbitales de oxígeno sp 2.

Además, el carbono y ambos oxígenos tienen cada uno un orbital 2 p z no hibridado situado perpendicular al plano de los enlaces sigma. Estos tres orbitales de 2 p z son paralelos entre sí, y pueden superponerse de manera lado a lado para formar un enlace pi deslocalizado.

El contribuyente de resonancia A muestra oxígeno #1 compartiendo un par de electrones con carbono en un enlace pi, y oxígeno #2 sosteniendo un par solitario de electrones en su orbital de 2 p z. El contribuyente de resonancia B, por otro lado, muestra oxígeno #2 participando en el enlace pi con carbono, y oxígeno #1 sosteniendo un par solitario en su orbital de 2 p z. En general, la situación es uno de tres orbitales paralelos superpuestos de 2p z que comparten cuatro electrones pi deslocalizados. Debido a que hay un electrón más que los orbitales 2 p z, el sistema tiene una carga general de —1. Este es el tipo de imagen 3D que los contribuyentes de resonancia se utilizan para aproximar, y una vez que obtengas algo de práctica deberías poder visualizar rápidamente orbitales superpuestos de 2 p z y electrones pi deslocalizados cada vez que veas que se utilizan estructuras de resonancia. En este texto, los grupos carboxilato generalmente se dibujarán mostrando solo un contribuyente de resonancia en aras de la simplicidad, pero siempre debes tener en cuenta que los dos enlaces C-O son iguales, y que la carga negativa se deslocaliza a ambos oxígenos.
Hay un tercer contribuyente de resonancia para formato (que pronto aprenderemos se considera un colaborador 'menor'). Dibuja este contribuyente de resonancia.
Aquí hay otro ejemplo, esta vez con un carbocation. Recordemos de la sección 2.1 que los carbocationes están hibridados sp 2, con un orbital 2p vacío orientado perpendicular al plano formado por tres enlaces sigma. Si un carbocatión es adyacente a un doble enlace, entonces tres orbitales 2p pueden superponerse y compartir los dos electrones pi, otro tipo de sistema pi conjugado en el que la carga positiva se comparte en dos carbonos.

Dibuja los contribuyentes de resonancia que corresponden a las flechas curvadas de movimiento de dos electrones en las expresiones de resonancia a continuación.

Ejercicio 2.15
En cada expresión de resonancia, dibuje flechas curvas de movimiento de dos electrones en el colaborador del lado izquierdo que muestre cómo llegamos al colaborador del lado derecho. Asegúrese de incluir cargos formales.

Soluciones a ejercicios
Reglas para dibujar estructuras de resonancia
A medida que trabajas en aprender a dibujar e interpretar estructuras de resonancia, hay algunas reglas básicas que debes tener en cuenta para evitar dibujar estructuras sin sentido. Todas estas reglas tienen perfecto sentido siempre y cuando se tenga en cuenta que los contribuyentes de resonancia son simplemente una convención inventada por humanos para representar la deslocalización de electrones pi en sistemas conjugados.
Reglas para dibujar estructuras de resonancia:
1) Cuando ves dos contribuyentes de resonancia diferentes, ¡no estás viendo una reacción química! Más bien, estás viendo exactamente la misma molécula o ion representado de dos maneras diferentes.
2) Los contribuyentes de resonancia implican el 'movimiento imaginario' de electrones unidos a pi o de electrones de pares solidos que están adyacentes a (es decir, conjugados con) enlaces pi. Nunca se puede desplazar la ubicación de los electrones en los enlaces sigma — si muestra que un enlace sigma se forma o se rompe, está mostrando una reacción química teniendo lugar (ver regla #1). Asimismo, las posiciones de los átomos en la molécula no pueden cambiar entre dos contribuyentes de resonancia.
3) Todos los contribuyentes de resonancia para una molécula o ion deben tener la misma carga neta.
4) Todos los contribuyentes de resonancia deben ser dibujados como estructuras de Lewis adecuadas, con cargos formales correctos. Nunca mostrar flechas curvadas de 'movimiento electrónico' que conduzcan a una situación en la que un elemento de la segunda fila (es decir, carbono, nitrógeno u oxígeno) tenga más de ocho electrones: esto rompería la 'regla del octeto'. A veces, sin embargo, dibujaremos contribuyentes de resonancia en los que un átomo de carbono tiene sólo seis electrones (es decir, un carbocatión). En general, todos los átomos de oxígeno y nitrógeno deben tener un octeto completo de electrones de valencia.
Para ampliar un poco sobre la regla #4, en realidad solo hay tres cosas que podemos hacer con flechas curvas al dibujar estructuras de resonancia:
Primero, podemos tomar los dos electrones en un enlace pi y desplazarlos para que se conviertan en un par solitario en un átomo adyacente (flecha 'a' abajo).
Segundo, podemos tomar un par solitario en un átomo y poner esos dos electrones en un enlace pi en el mismo átomo (flecha 'b').
Tercero, podemos desplazar un enlace pi sobre una posición (flecha c).

Las flechas de resonancia también se pueden combinar; a continuación, mostramos las flechas a y b juntas:

Observe que no excedemos la regla del octeto en ningún átomo cuando movemos electrones con las flechas a, b y c. La imagen de resonancia a continuación muestra un movimiento 'ilegal' de electrones, porque resultaría en un carbono con cinco enlaces, o 10 electrones de valencia (esto rompería la regla del octeto):

Siempre tenga mucho cuidado al dibujar estructuras de resonancia que sus flechas hagan solo los tres tipos de movimiento de electrones descritos anteriormente, y que nunca supere la regla del octeto en un elemento de segunda fila. A menudo es útil (pero opcional), incluir todos los electrones de pares solidos en el oxígeno y el nitrógeno en el dibujo con el fin de realizar un seguimiento de los electrones de valencia, evitar romper la regla del octeto y reconocer cuando los átomos tienen una carga formal negativa o positiva. Obtener la 'contabilidad electrónica' correcta es una gran parte de trabajar con contribuyentes de resonancia.
A continuación se presentan algunos ejemplos más de expresiones de resonancia 'legales'. Confirma por ti mismo que la regla del octeto no se excede para ningún átomo, y que los cargos formales son correctos.

Cada una de las expresiones de resonancia 'ilegales' que aparecen a continuación contiene uno o más errores. Explique qué es incorrecto en cada uno.

Soluciones a ejercicios
Colaboradores de resonancia mayor vs menor
Los diferentes contribuyentes de resonancia no siempre hacen la misma contribución a la estructura general del híbrido; más bien, en muchos casos un contribuyente se acerca más a representar la imagen de unión real que otro. En el caso de los carboxilatos, los contribuyentes A y B siguientes son equivalentes en términos de su contribución relativa a la estructura híbrida. Sin embargo, también hay un tercer contribuyente de resonancia 'C, en el que el carbono lleva una carga formal positiva y ambos oxígenos son de enlace simple y llevan cargas negativas.

La Estructura C hace una contribución menos importante a la imagen general de vinculación del grupo en relación con A y B. ¿Cómo sabemos que la estructura C es el contribuyente 'menor'? Hay cuatro reglas básicas que debes aprender para evaluar la importancia relativa de los diferentes contribuyentes de resonancia. Los numeraremos 5-8 para que puedan agregarse en la lista de 'reglas para la resonancia' anterior en esta página.
Reglas para determinar los contribuyentes mayores y menores de resonancia:
5) El carbono en el contribuyente C no tiene un octeto; en general, los contribuyentes de resonancia en los que un carbono no cumple con la regla del octeto son relativamente menos importantes.
6) En la estructura C, se ha introducido una separación de carga que no está presente en A o B. En general, los contribuyentes de resonancia en los que hay una mayor separación de carga son relativamente menos importantes.
7) En la estructura C, solo hay tres enlaces, en comparación con cuatro en A y B. En general, una estructura de resonancia con un menor número de enlaces totales es relativamente menos importante.
8) El contribuyente de resonancia en el que se ubica una carga formal negativa sobre un átomo más electronegativo, generalmente oxígeno o nitrógeno, es más estable que uno en el que la carga negativa se ubica sobre un átomo menos electronegativo como el carbono. Un ejemplo está en la expresión superior izquierda en la siguiente figura.
A continuación se presentan algunos ejemplos adicionales de contribuyentes de resonancia mayores y menores:

¿Por qué nos preocupamos por un contribuyente de resonancia si es el menor? Veremos más adelante que muy a menudo un colaborador menor aún puede ser extremadamente importante para nuestra comprensión de cómo reacciona una molécula.
a) Dibujar una estructura de resonancia menor para acetona (nombre IUPAC 2-propanona). Explique por qué es un colaborador menor.
b) ¿Son contribuyentes de resonancia de acetona y 2-propanol el uno del otro? Explicar.
Ejercicio 2.18
Dibuje cuatro contribuyentes de resonancia adicionales para la molécula a continuación. Etiquetar cada uno como mayor o menor (la estructura a continuación es de un contribuyente importante).
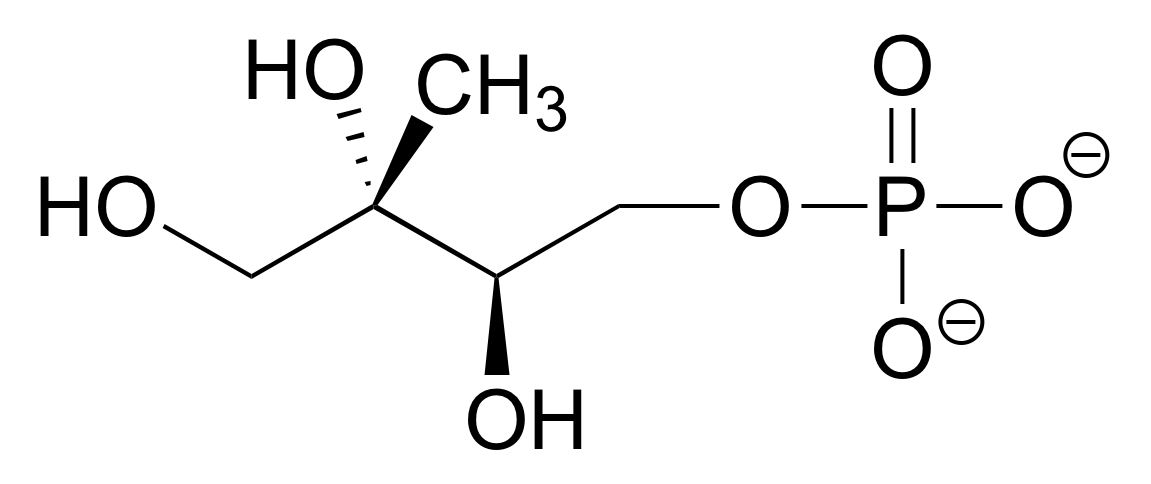
Ejercicio 2.19
Dibujar tres contribuyentes de resonancia de acetato de metilo (nombre IUPAC metanoato de metilo), y ordenarlos de acuerdo a su importancia relativa a la imagen de unión de la molécula. Explica tu razonamiento.
Soluciones a ejercicios
Resonancia y enlaces peptídicos
¿Cuál es el estado de hibridación del átomo de nitrógeno en una amida? A primera vista, parecería lógico decir que es sp 3 -hibridado, porque, al igual que el nitrógeno en una amina, la estructura de Lewis muestra tres enlaces simples y un par solitario. La imagen se ve bastante diferente, sin embargo, si consideramos otro contribuyente de resonancia en el que el nitrógeno tiene un doble enlace con el carbono carbonilo: en este caso, tendríamos que decir que la hibridación aplicable es sp 2, y la geometría de unión trigonal plana en lugar de tetraédrica.

De hecho, esta última imagen es más precisa: el par solitario de electrones en un nitrógeno amida no se localiza en un orbital sp 3, más bien, se deslocalizan como parte de un sistema pi conjugado, y la geometría de unión alrededor del nitrógeno es plano trigonal como se esperaba para hibridación sp 2. Esta es una buena ilustración de un punto importante: la conjugación y la correspondiente deslocalización de la densidad de electrones se está estabilizando, así si la conjugación puede ocurrir, probablemente lo hará.
Uno de los ejemplos más importantes de grupos amida en la naturaleza es el “enlace peptídico” que une aminoácidos para formar polipéptidos y proteínas.

Crítico para la estructura de las proteínas es el hecho de que, aunque convencionalmente se dibuja como un enlace sencillo, el enlace C-N en un enlace peptídico tiene una barrera significativa a la rotación, lo que indica que hasta cierto punto, el solapamiento C-N pi está presente, es decir, hay algún carácter de doble enlace, y el nitrógeno es sp 2 hibridado con geometría plana trigonal.

La barrera a la rotación en los enlaces peptídicos es una parte integral de la estructura de la proteína, introduciendo más rigidez en la cadena principal de la proteína. Si no hubiera barrera a la rotación en un enlace peptídico, las proteínas serían mucho más 'floppy' y el plegamiento tridimensional sería muy diferente.
Dibuje dos imágenes que muestren los orbitales 2p no hibridados y la ubicación de electrones pi en metilamida. Una imagen debe representar al mayor contribuyente de resonancia, el otro el contribuyente menor. ¿Cuántos orbitales 2p superpuestos comparten cuántos electrones unidos a pi?
Ejercicio 2.21
Dibuje dos imágenes que muestren los orbitales 2p no hibridados y la ubicación de los electrones pi en el anión 'enolado' que se muestra a continuación. Una imagen debe representar al mayor contribuyente de resonancia, el otro el contribuyente menor. ¿Cuántos orbitales superpuestos de 2 p están compartiendo cuántos electrones unidos a pi?

Ejercicio 2.22
A continuación se muestra un contribuyente menor de resonancia de una especie conocida como 'enamina', que estudiaremos más en el capítulo 12. Dibuja el mayor contribuyente de resonancia para la enamina y explica por qué tu colaborador es el principal (consulta las reglas de resonancia #5 -8 de esta sección).

Soluciones a ejercicios
Dibuja el mayor contribuyente de resonancia de la estructura a continuación. Incluye en tu figura las flechas curvas apropiadas que muestren cómo llegaste de la estructura dada a tu estructura. Explica por qué tu colaborador es el principal. ¿En qué tipo de orbitales están los dos pares solitarios en el oxígeno?

Solución
En la estructura anterior, el carbono con la carga formal positiva no tiene un octeto completo de electrones de valencia. Usando la convención de flecha curva, un par solitario en el oxígeno se puede mover hacia el enlace adyacente a la izquierda, y los electrones en el doble enlace se desplazan hacia la izquierda (vea las reglas para dibujar contribuyentes de resonancia para convencerse de que estos son movimientos 'legales').

El contribuyente de resonancia resultante, en el que el oxígeno lleva la carga formal, es el principal porque todos los átomos tienen un octeto completo, y hay un enlace adicional dibujado (las reglas de resonancia #5 y #7 aplican ambas). Este sistema se puede considerar como cuatro orbitales paralelos de 2p (uno en C 2, C 3 y C 4, más uno en oxígeno) que comparten cuatro electrones pi. Un par solitario en el oxígeno se encuentra en un orbital 2p no hibridado y es parte del sistema pi conjugado, y el otro se encuentra en un orbital sp 2.
También tenga en cuenta que se puede dibujar un contribuyente adicional, pero también es menor porque tiene un carbono con un octeto incompleto:
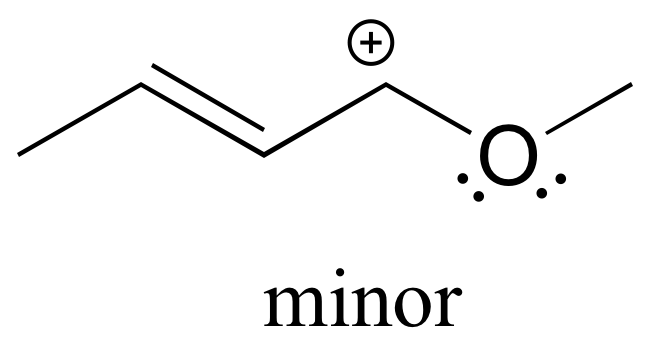
a) Dibujar tres contribuyentes de resonancia adicionales para el carbocatión a continuación. Incluya en su figura las flechas curvas apropiadas que muestren cómo se convierte un colaborador al siguiente.

b) Rellenar los espacios en blanco: el sistema pi conjugado en este carbocatión está compuesto por ______ 2p orbitales que comparten ________ electrones pi deslocalizados.
Ejercicio 2.24
Dibuja el mayor contribuyente de resonancia para cada uno de los aniones a continuación.

c) Rellenar los espacios en blanco: el sistema pi conjugado en la parte (a) está compuesto por ______ 2p orbitales que contienen ________ electrones pi deslocalizados.
Ejercicio 2.25
La siguiente figura muestra cómo la carga formal negativa sobre el oxígeno puede deslocalizarse al carbono indicado por una flecha. Se pueden dibujar más contribuyentes de resonancia en los que la carga negativa se deslocaliza a otros tres átomos en la molécula.
a) Circular estos átomos.
b) Dibujar los dos contribuyentes de resonancia más importantes para la molécula.

Soluciones a ejercicios
Convertirse en experto en dibujar contribuyentes de resonancia, usar la notación de flecha curva para mostrar cómo un colaborador puede convertirse en otro, y comprender los conceptos de conjugación y deslocalización de resonancia son algunos de los trabajos más desafiantes pero también más importantes que tendrá como comienzo estudiante de química orgánica. Si trabajas duro ahora para obtener una comprensión firme de estas ideas, habrás recorrido un largo camino hacia la comprensión de gran parte de lo que sigue en tu curso de química orgánica. Por el contrario, si no logras enfrentarte a estos conceptos ahora, mucho de lo que veas más adelante en el curso te parecerá un montón de líneas misteriosas e incomprensibles, puntos y flechas, y te quedarás en un viaje rudo, por decir lo menos. Más que muchos otros temas en química orgánica, entender la vinculación, conjugación y resonancia es algo en lo que la mayoría de los estudiantes realmente necesitan trabajar 'en persona' con un instructor o tutor, preferiblemente usando un kit de modelado molecular. ¡Sigue trabajando con los problemas, sigue haciendo preguntas y sigue haciéndolo hasta que todo tenga sentido!
Tutoriales en video de Khan Academy


