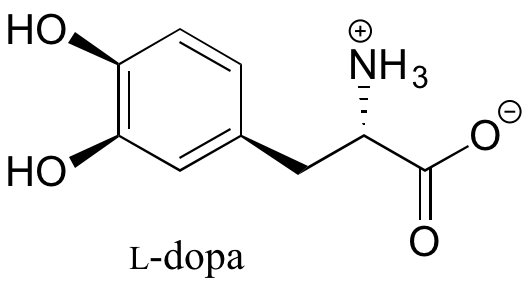
2.2: Teoría del vínculo de valencia
- Page ID
- 72316
Como hemos estado discutiendo cómo usar las estructuras de Lewis para representar la unión en compuestos orgánicos, hasta ahora hemos sido muy vagos en nuestro lenguaje sobre la naturaleza real de los enlaces químicos en sí mismos. Sabemos que un enlace covalente implica el 'compartir' de un par de electrones entre dos átomos, pero ¿cómo sucede esto y cómo conduce a la formación de un enlace que mantiene unidos a los dos átomos?
La teoría del enlace de valencia se usa con mayor frecuencia para describir la unión en moléculas orgánicas. En este modelo, se considera que los enlaces se forman a partir del solapamiento de dos orbitales atómicos en diferentes átomos, cada orbital contiene un solo electrón. Al observar moléculas inorgánicas simples como el hidrógeno molecular (H 2) o el fluoruro de hidrógeno (HF), nuestra comprensión actual de los orbitales s y p atómicos será suficiente. Para explicar la unión en moléculas orgánicas, sin embargo, necesitaremos introducir el concepto de orbitales híbridos.
El enlace sigma en la molécula H 2
El caso más sencillo a considerar es la molécula de hidrógeno, H 2. Cuando decimos que los dos núcleos de hidrógeno comparten sus electrones para formar un enlace covalente, lo que queremos decir en términos de teoría de enlaces de valencia es que los dos orbitales esféricos de 1 s (las esferas grises en la figura siguiente) se superponen, y contienen dos electrones con espín opuesto.
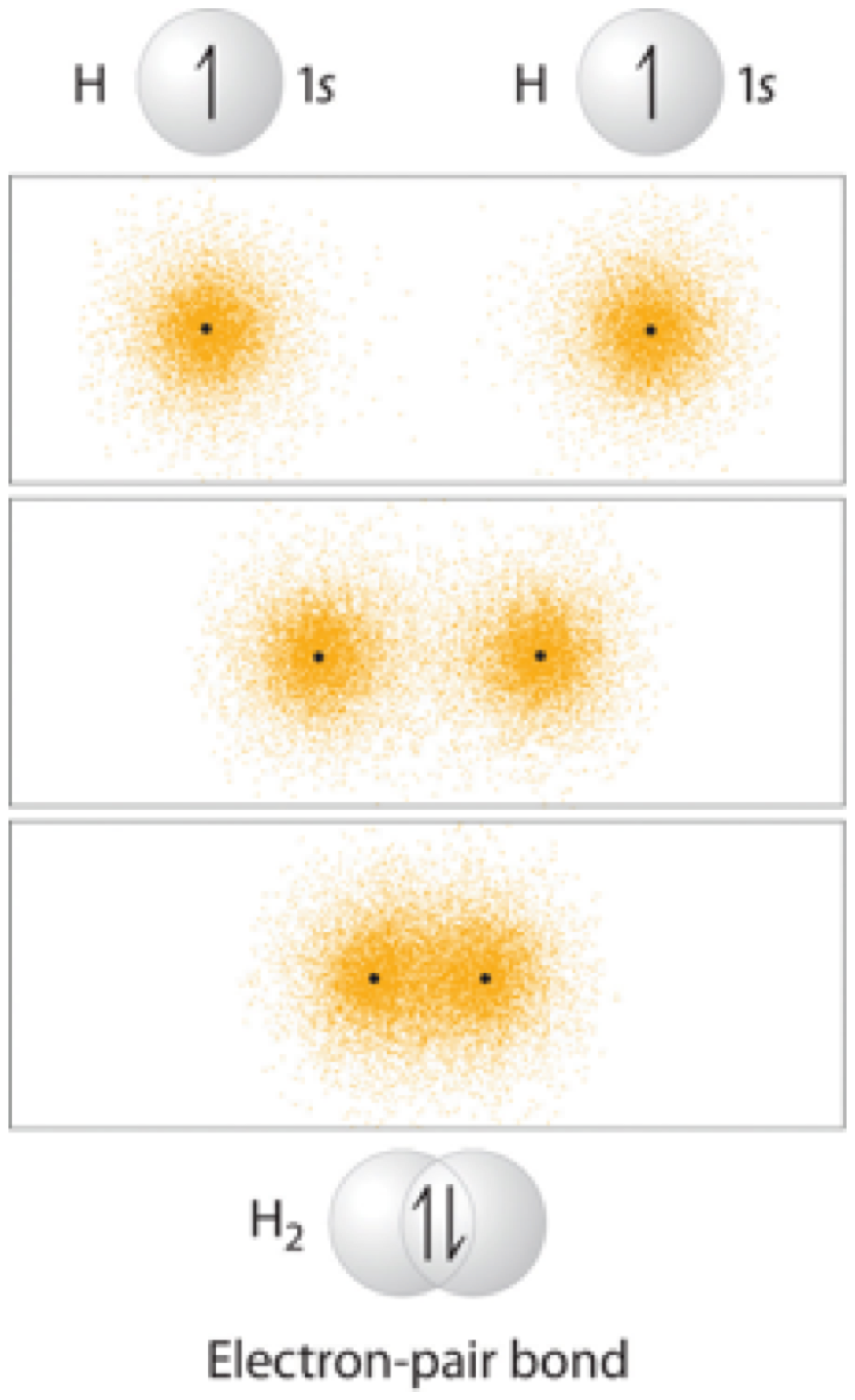
Estos dos electrones son ahora atraídos por la carga positiva de ambos núcleos de hidrógeno, con el resultado de que sirven como una especie de 'cola química' que mantiene unidos los dos núcleos.
¿A qué distancia están los dos núcleos? Si están demasiado separados, sus respectivos orbitales de 1 s no pueden superponerse y, por lo tanto, no se puede formar ningún enlace covalente; siguen siendo solo dos átomos de hidrógeno separados. A medida que se acercan cada vez más, el solapamiento orbital comienza a ocurrir y comienza a formarse un vínculo. Esto disminuye la energía potencial del sistema, ya que nuevas y atractivas interacciones electrostáticas positivo-negativas se hacen posibles entre el núcleo de un átomo y el electrón del segundo.
Pero algo más está sucediendo al mismo tiempo: a medida que los átomos se acercan, la repulsiva interacción positivo-positiva entre los dos núcleos también comienza a aumentar.
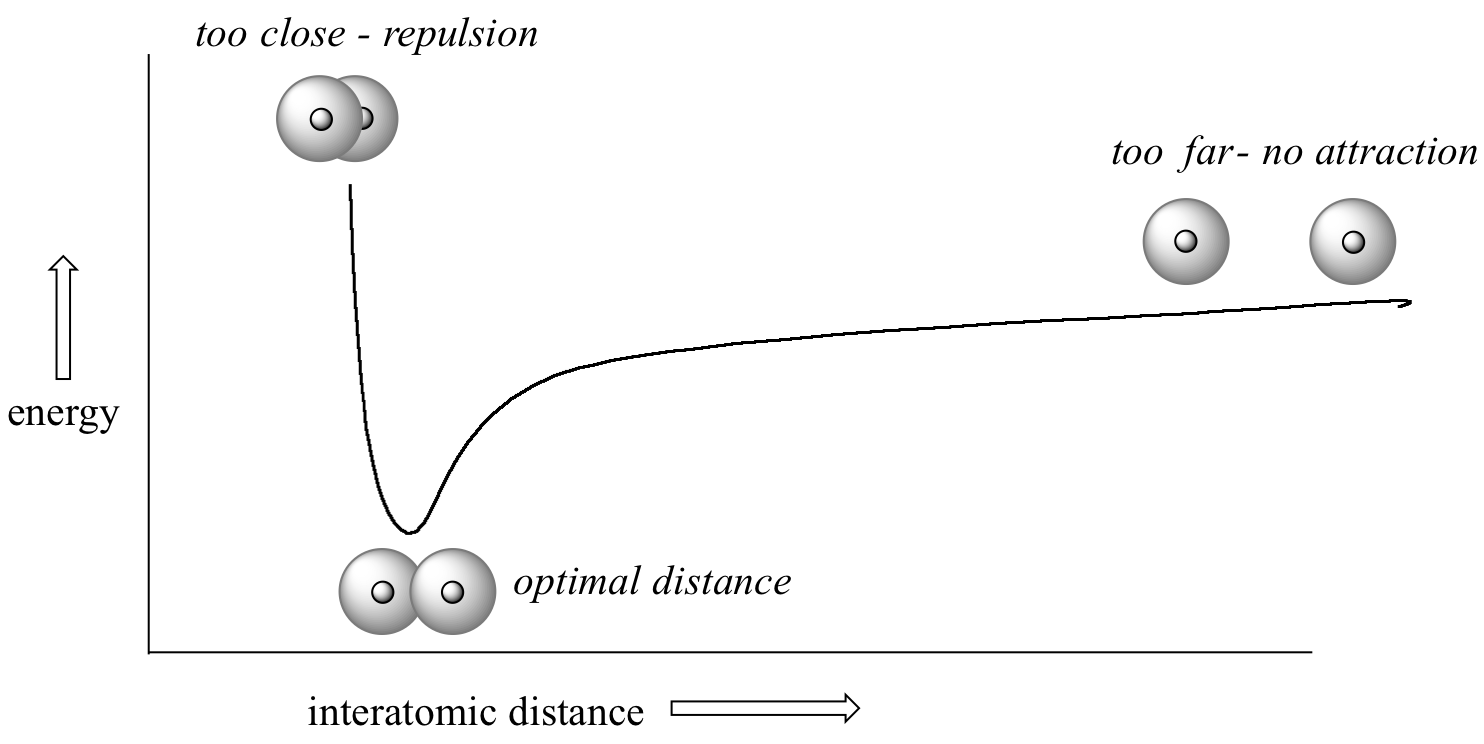
Al principio esta repulsión está más que compensada por la atracción entre núcleos y electrones, pero en cierto punto, a medida que los núcleos se acercan aún más, las fuerzas repulsivas comienzan a superar las fuerzas atractivas, y la energía potencial del sistema se eleva rápidamente. Cuando los dos núcleos están 'demasiado cerca', tenemos una situación inestable, de alta energía. Existe una distancia óptima definida entre los núcleos en la que la energía potencial está en un mínimo, lo que significa que las fuerzas atractivas y repulsivas combinadas suman la mayor fuerza de atracción general. Esta distancia internuclear óptima es la longitud del enlace. Para la molécula H 2, la distancia es de 74 pm (picometros, 10 -12 metros). Asimismo, la diferencia de energía potencial entre el estado de energía más bajo (a la distancia internuclear óptima) y el estado donde los dos átomos están completamente separados se denomina energía de disociación del enlace, o, más simplemente, fuerza de enlace. Para la molécula de hidrógeno, la fuerza del enlace H-H es igual a aproximadamente 435 kJ/mol.
Cada enlace covalente en una molécula dada tiene una longitud y fuerza características. En general, la longitud de un enlace sencillo carbono-carbono típico en una molécula orgánica es de aproximadamente 150pm, mientras que los dobles enlaces carbono-carbono son de aproximadamente 130pm, los dobles enlaces carbono-oxígeno son de aproximadamente 120pm y los enlaces carbono-hidrógeno están en el rango de 100 a 110pm. La fuerza de los enlaces covalentes en moléculas orgánicas varía de aproximadamente 234 kJ/mol para un enlace carbono-yodo (en la hormona tiroidea, por ejemplo), aproximadamente 410 kJ/mol para un enlace carbono-hidrógeno típico, y hasta más de 800 kJ/mol para un triple enlace carbono-carbono.
Tabla de longitudes de enlace y energías de enlace
No es exacto, sin embargo, imaginar los enlaces covalentes como barras rígidas de longitud invariable; más bien, es mejor imaginarlos como resortes que tienen una longitud definida cuando están relajados, pero que pueden comprimirse, extenderse y doblarse. Esta imagen 'elástico' de los enlaces covalentes será muy importante en el capítulo 4, cuando estudiemos la técnica analítica conocida como espectroscopia infrarroja (IR).
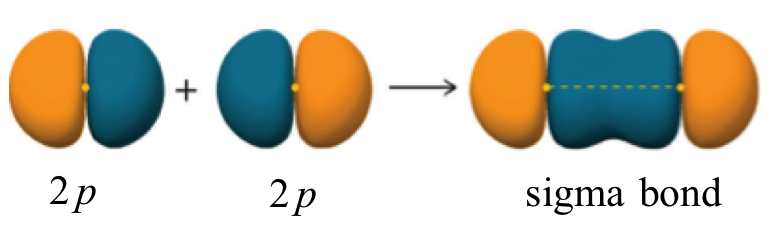
Una característica más del enlace covalente en H 2 es importante considerar en este punto. Los dos orbitales superpuestos de 1 s se pueden visualizar como dos globos esféricos presionados juntos. Esto significa que el enlace tiene simetría cilíndrica: si tuviéramos que tomar un plano transversal del enlace en algún punto, formaría un círculo. Este tipo de enlace se conoce como un enlace sigma (σ).
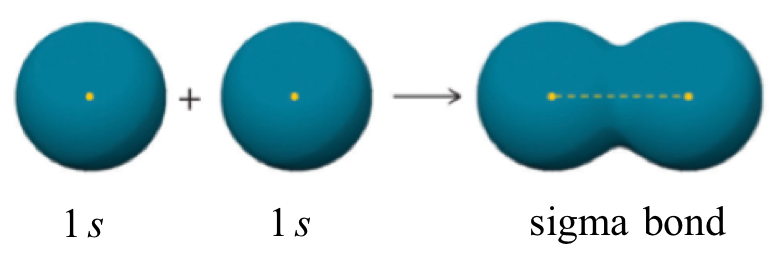
Un enlace sigma se puede formar por superposición de un orbital atómico s con un orbital atómico p. El fluoruro de hidrógeno (HF) es un ejemplo:
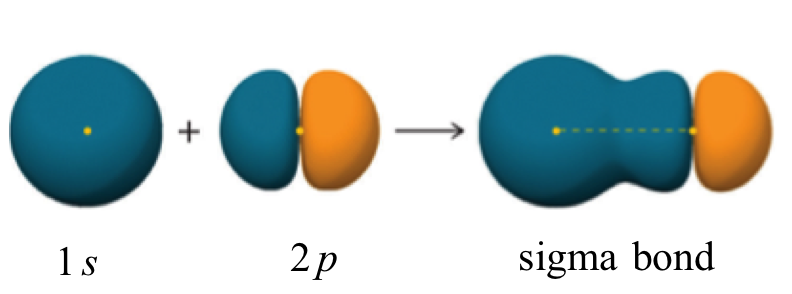
Un enlace sigma también se puede formar por el solapamiento de dos orbitales p. El enlace covalente en flúor molecular, F 2, es un enlace sigma formado por el solapamiento de dos orbitales medio llenos de 2 p, uno por cada átomo de flúor.
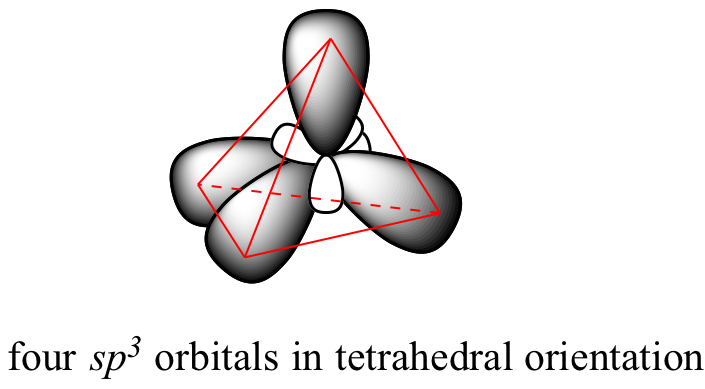
sp 3 orbitales híbridos y unión tetraédrica
Ahora veamos con más cuidado la unión en moléculas orgánicas, comenzando con el metano, CH 4. Recordemos la configuración electrónica de valencia de un átomo de carbono:

Esta imagen es problemática a la hora de describir la unión en metano. ¿Cómo forma el carbono cuatro enlaces si solo tiene dos orbitales p medio llenos disponibles para la unión? Un indicio proviene de la observación experimental de que los cuatro enlaces C-H en metano están dispuestos con geometría tetraédrica alrededor del carbono central, y que cada enlace tiene la misma longitud y resistencia. Para explicar esta observación, la teoría del enlace de valencia se basa en un concepto llamado hibridación orbital. En esta imagen, los cuatro orbitales de valencia del carbono (uno de 2 s y tres orbitales de 2 p) se combinan matemáticamente (recuerde: los orbitales se describen mediante ecuaciones de onda) para formar cuatro orbitales híbridos equivalentes, que se denominan sp 3 orbitales porque se forman a partir de la mezcla de orbitales de una s y tres p. En la nueva configuración electrónica, cada uno de los cuatro electrones de valencia en el carbono ocupa un solo orbital sp 3.
modelo 3D interactivo
(seleccione 'load sp 3 'y 'load H 1s' para ver orbitales)
Esta disposición geométrica tiene perfecto sentido si se considera que es precisamente este ángulo el que permite que los cuatro orbitales (y los electrones en ellos) estén lo más alejados posible entre sí. Esto es simplemente una reformulación de la teoría de la repulsión de pares de electrones de concha de valencia (VSEPR) que aprendió en Química General: los pares de electrones (en orbitales) se organizarán de tal manera que permanezcan lo más separados posible, debido a la repulsión electrostática negativa-negativa.
Cada enlace C-H en metano, entonces, puede describirse como un enlace sigma formado por superposición entre un orbital medio lleno de 1 s en un átomo de hidrógeno y el lóbulo más grande de uno de los cuatro orbitales híbridos sp 3 medio llenos en el carbono central. La longitud de los enlaces carbono-hidrógeno en metano es de 109pm.

Mientras que anteriormente dibujamos una estructura Lewis de metano en dos dimensiones usando líneas para denotar cada enlace covalente, ahora podemos dibujar una estructura más precisa en tres dimensiones, mostrando la geometría de unión tetraédrica. Para hacer esto en una página bidimensional, sin embargo, necesitamos introducir una nueva convención de dibujo: el sistema de cuña sólida/discontinua. En esta convención, una cuña sólida simplemente representa un vínculo que está destinado a ser representado emergiendo del plano de la página. Una cuña discontinua representa un vínculo que está destinado a ser representado apuntando hacia, o detrás, del plano de la página. Las líneas normales implican vínculos que se encuentran en el plano de la página. Este sistema requiere un poco de acostumbrarse, pero con la práctica tu ojo aprenderá a 'ver' inmediatamente la tercera dimensión que se está representando.
Ejercicio 2.1
Imagina que podrías distinguir entre los cuatro átomos de hidrógeno en una molécula de metano, y etiquetarlos de H a a H d. En las imágenes de abajo, la misma molécula de metano es rotada y volteada en varias posiciones. Dibuja las etiquetas de átomos de hidrógeno que faltan. (Será mucho más fácil hacer esto si haces un modelo.)
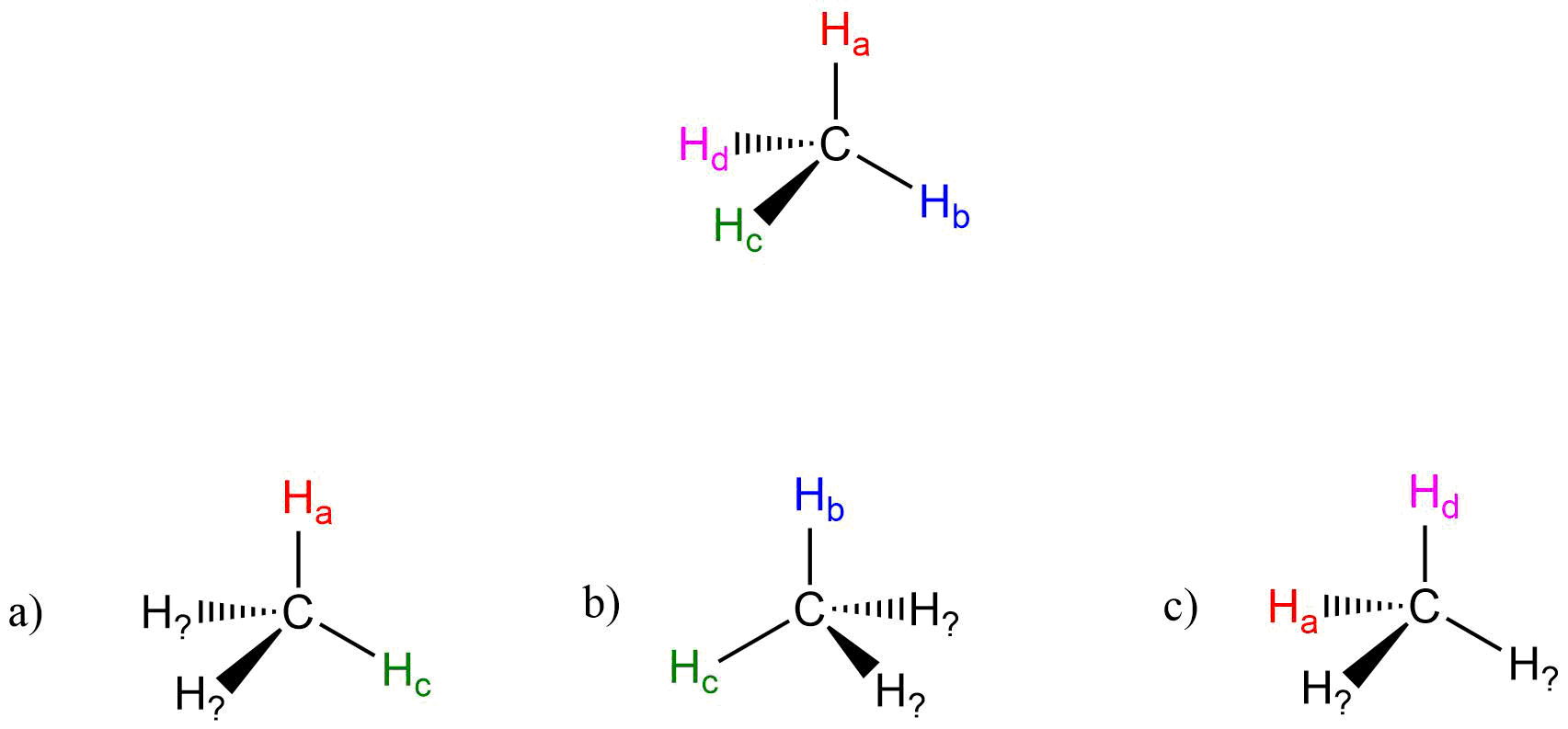
Ejercicio 2.2
¿Qué tipo de orbitales se superponen para formar los enlaces C-Cl en cloroformo, CHCl 3?
Soluciones a ejercicios
¿Cómo se extiende esta imagen de unión a los compuestos que contienen enlaces carbono-carbono? En etano (CH 3 CH 3), ambos carbonos están hibridados sp 3, lo que significa que ambos tienen cuatro enlaces con geometría tetraédrica. El enlace carbono-carbono, con una longitud de enlace de 154pm, se forma por solapamiento de un orbital sp 3 de cada uno de los carbonos, mientras que los seis enlaces carbono-hidrógeno se forman a partir de solapamientos entre los orbitales sp 3 restantes en los dos carbonos y los 1 s orbitales de átomos de hidrógeno. Todos estos son enlaces sigma.
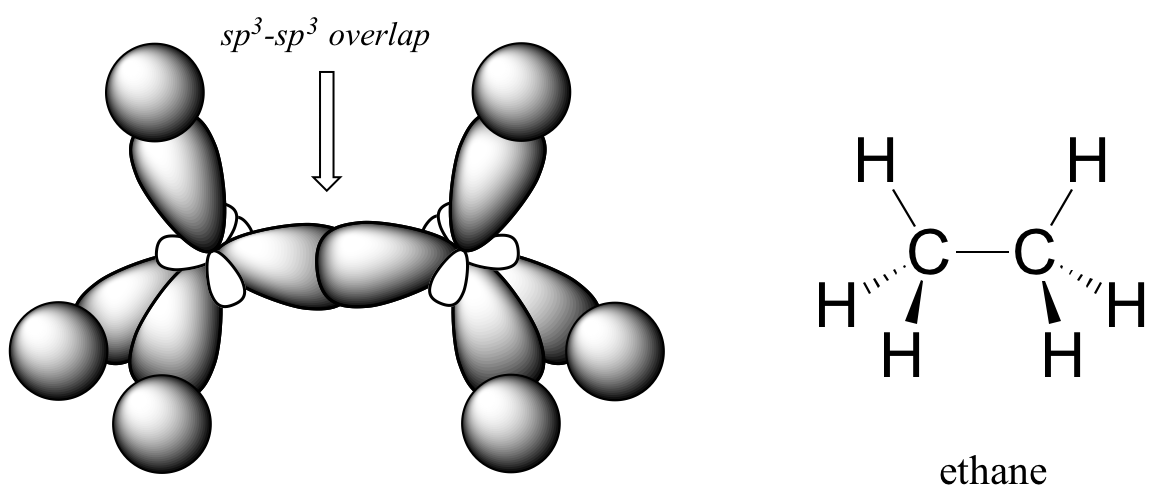
Debido a que se forman a partir del solapamiento extremo a extremo de dos orbitales, los enlaces s igma son libres de rotar. Esto significa, en el caso de la molécula de etano, que los dos grupos metilo (CH 3) pueden representarse como dos ruedas sobre un eje, cada una capaz de girar con respecto a la otra.
-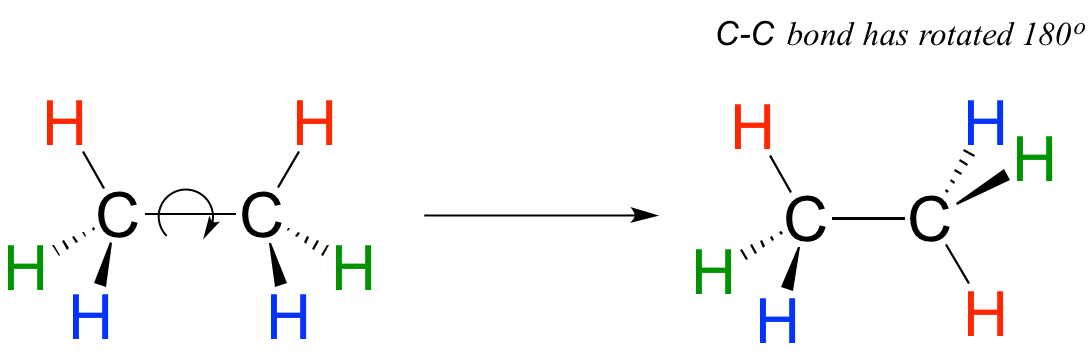
En el capítulo 3 aprenderemos más sobre las implicaciones de la libertad rotacional en los enlaces sigma, cuando discutamos la 'conformación' de moléculas orgánicas.
La imagen de unión sp 3 también se utiliza para describir la unión en aminas, incluyendo el amoníaco, la amina más simple. Al igual que el átomo de carbono en el metano, el nitrógeno central en el amoníaco es sp 3 - hibridado. Con el nitrógeno, sin embargo, hay cinco en lugar de cuatro electrones de valencia a tener en cuenta, lo que significa que tres de los cuatro orbitales híbridos están medio llenos y disponibles para unirse, mientras que el cuarto está completamente ocupado por un par no enlazante (par solitario) de electrones.
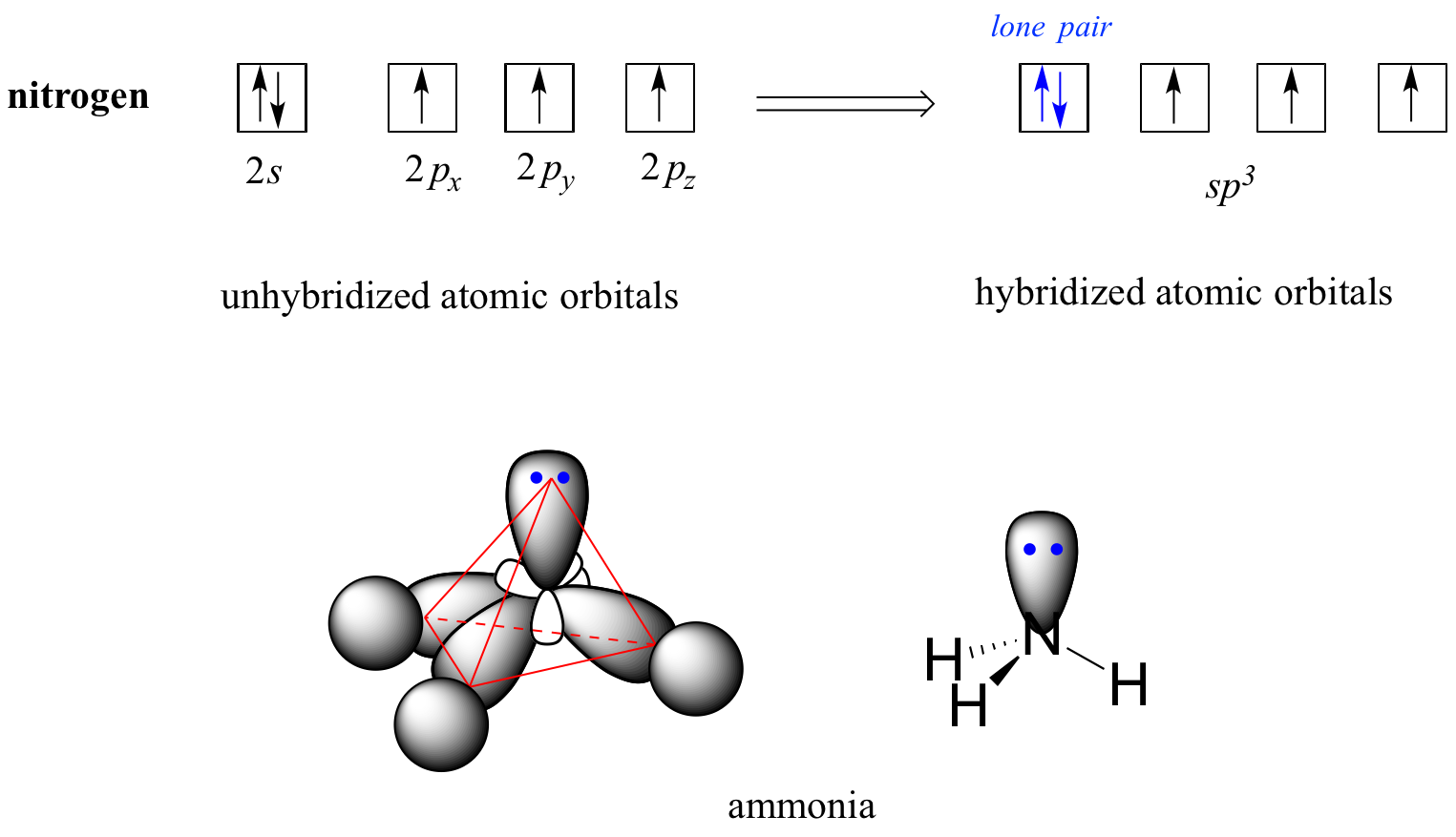
imagen de relleno de espacio
La disposición de unión aquí también es tetraédrica: los tres enlaces N-H de amoníaco se pueden representar formando la base de una pirámide trigonal, con el cuarto orbital, conteniendo el par solitario, formando la parte superior de la pirámide. Recuerde de su estudio de la teoría VSEPR en Química General que el par solitario, con su efecto repulsivo ligeramente mayor, 'empuja' los tres enlaces N-H lejos de la parte superior de la pirámide, lo que significa que los ángulos de enlace H-N-H son ligeramente menores que tetraédricos, a 107.3˚ en lugar de 109.5˚.
La teoría de VSEPR también predice, con precisión, que una molécula de agua está 'doblada' en un ángulo de aproximadamente 104.5˚. El enlace en agua es el resultado de la superposición de dos de los cuatro orbitales híbridos sp 3 en oxígeno con orbitales de 1 s en los dos átomos de hidrógeno. Los dos pares de electrones no enlazantes sobre el oxígeno se localizan en los dos orbitales sp 3 restantes.
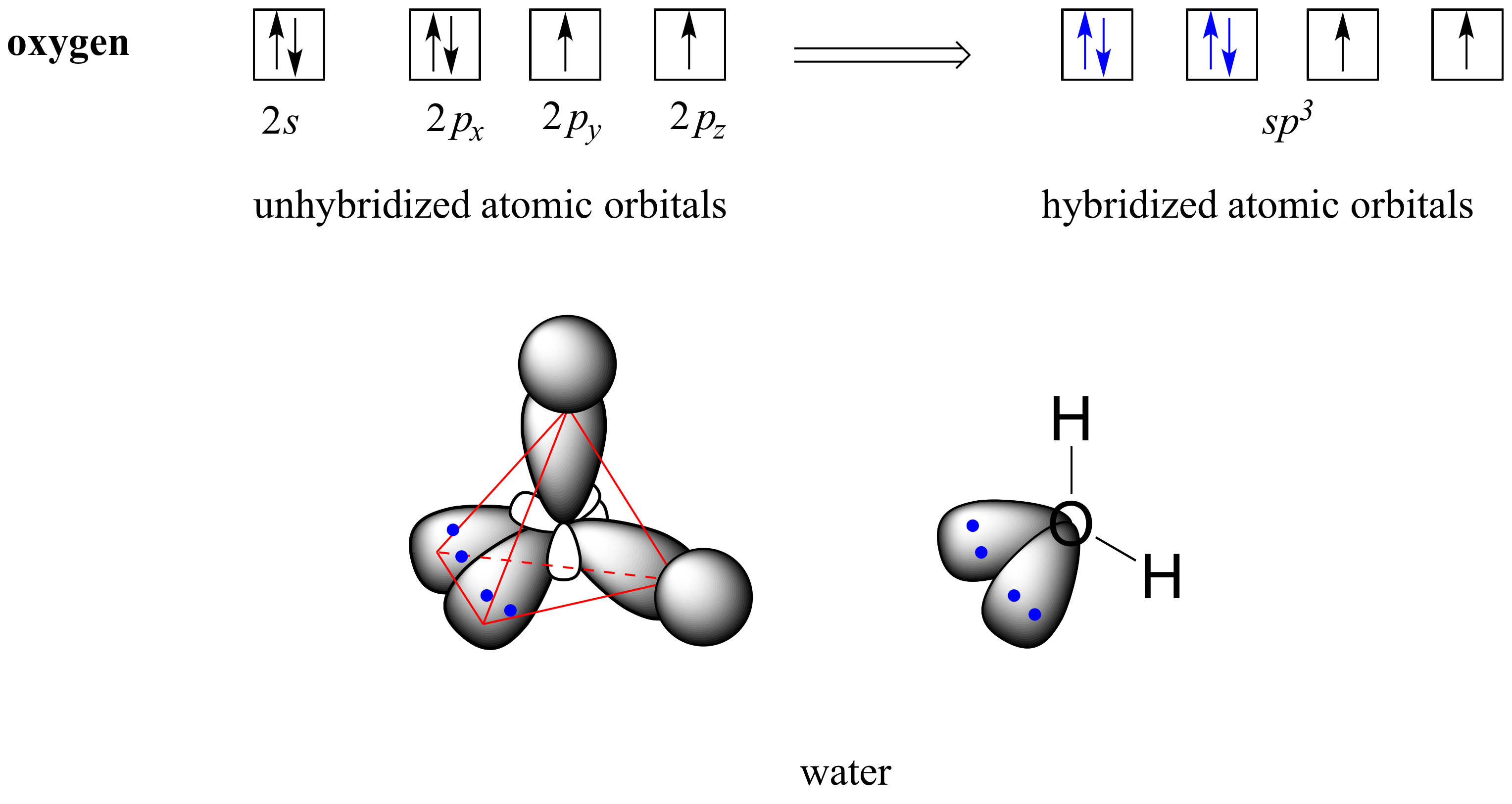
Ejercicio 2.3
Dibuje, en el mismo estilo que las figuras anteriores, imágenes orbitales para la unión en a) metilamina, y b) etanol.
Soluciones a ejercicios
orbitales híbridos sp 2 y sp y enlaces pi
La teoría del enlace de valencia, junto con el concepto orbital híbrido, hace un muy buen trabajo al describir compuestos de doble enlace como el eteno. Tres características experimentalmente observables de la molécula de eteno deben ser contabilizadas por un modelo de unión:
- El eteno es una molécula plana (plana).
- Los ángulos de enlace en el eteno son de aproximadamente 120 o, y la longitud del enlace carbono-carbono es de 134pm, significativamente más corta que el enlace simple carbono-carbono de 154pm en etano.
- Existe una barrera significativa para la rotación alrededor del doble enlace carbono-carbono.
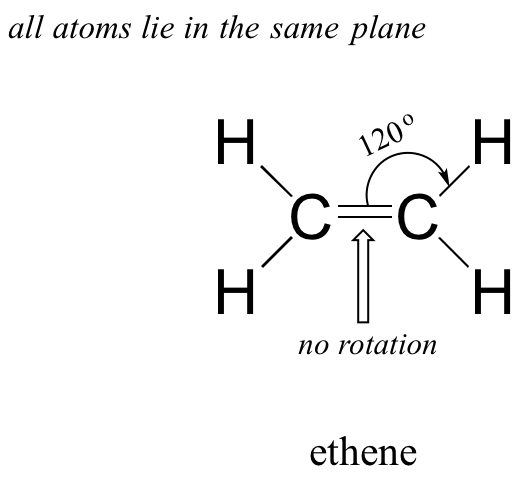
Claramente, estas características no son consistentes con una imagen de unión híbrida sp 3 para los dos átomos de carbono. En cambio, la unión en eteno se describe mediante un modelo que implica la participación de un tipo diferente de orbital híbrido. Tres orbitales atómicos en cada carbono —los orbitales 2 s, 2 p x y 2 p y — se combinan para formar tres híbridos sp 2, dejando el orbital 2 p z sin hibridar.

Los tres híbridos sp 2 están dispuestos con geometría plana trigonal, apuntando a las tres esquinas de un triángulo equilátero, con ángulos de 120° entre ellos. El orbital 2 p z no hibridado es perpendicular a este plano (en las siguientes figuras, los orbitales sp 2 y los enlaces sigma a los que contribuyen están representados por líneas y cuñas; solo se muestran los orbitales 2 p z en el modo 'relleno de espacio').
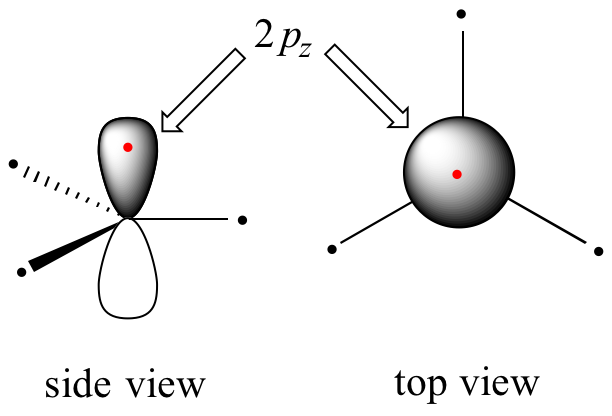
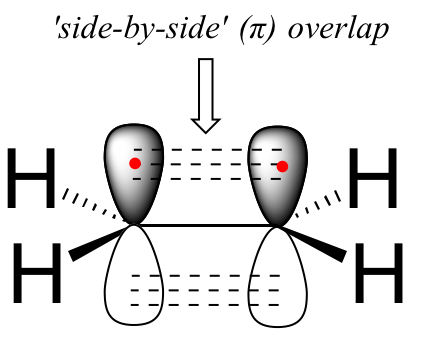
El doble enlace carbono-carbono en eteno consiste en un enlace sigma, formado por el solapamiento de dos orbitales sp 2, y un segundo enlace, llamado pi (π ) , que se forma por el solapamiento lado a lado de los dos orbitales 2 p z no hibridados de cada carbono.
Modelo 3D interactivo (seleccione 'mostrar orbital pi resultante')
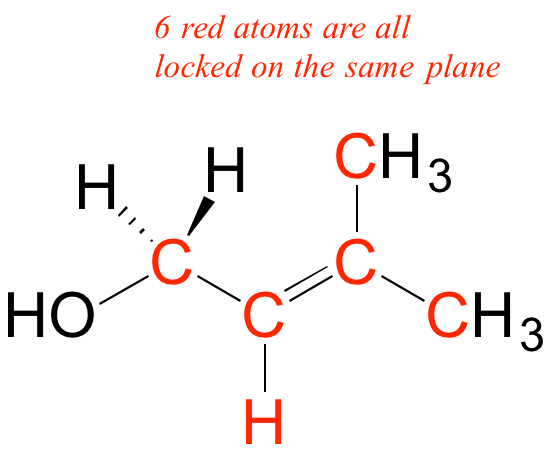
A diferencia de un enlace sigma, un enlace pi no tiene simetría cilíndrica. Si se produjera una rotación sobre este enlace, implicaría interrumpir el solapamiento lado a lado entre los dos orbitales de 2 p z que componen el enlace pi. La presencia del enlace pi así 'bloquea' los seis átomos de eteno en el mismo plano. Este argumento se extiende a grupos alquenos más grandes: en cada caso, seis átomos se encuentran en un mismo plano.
Ejercicio 2.4
Redibuje las estructuras de abajo, indicando los seis átomos que se encuentran en el mismo plano debido al doble enlace carbono-carbono.
Ejercicio 2.5
¿Qué hay de malo en la forma en que se dibuja la siguiente estructura?
Soluciones a ejercicios
Se puede dibujar una imagen similar para la unión en grupos carbonilo, como el formaldehído. En esta molécula, el carbono está hibridado con sp 2, y asumiremos que el átomo de oxígeno también está hibridado con sp 2. El carbono tiene tres enlaces sigma: dos se forman por solapamiento entre orbitales sp 2 con orbitales de 1 s de átomos de hidrógeno, y el tercer enlace sigma se forma por superposición entre el carbono restante sp 2 orbital y un sp 2 orbital en el oxígeno. Los dos pares solitarios en oxígeno ocupan sus otros dos orbitales sp 2.

El enlace pi se forma por solapamiento lado a lado de los orbitales 2 p z no hibridados en el carbono y el oxígeno. Al igual que en los alquenos, los orbitales 2 p z que forman el enlace pi son perpendiculares al plano formado por los enlaces sigma.
a: Dibujar un diagrama de orbitales híbridos en un nitrógeno hibridado sp 2.
b: Dibuja una figura que muestre la imagen de vinculación para la imine a continuación.
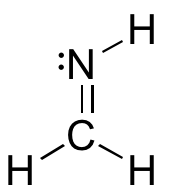
c: En su dibujo para la parte b, ¿qué tipo de orbital contiene el par solitario de nitrógeno?
Soluciones a ejercicios
Recordemos que los carbocationes son especies transitorias de alta energía en las que un carbono solo tiene tres enlaces (en lugar de los cuatro habituales) y una carga formal positiva. Tendremos mucho más que decir sobre los carbocationes en este y en capítulos posteriores. Por ahora, sin embargo, lo importante a entender es que un carbocatión puede describirse como un carbono hibridado sp 2 con un orbital vacío 2p perpendicular al plano de los enlaces sigma.

Finalmente, el concepto orbital híbrido se aplica también a grupos de triple enlace, como alquinos y nitrilos. Consideremos, por ejemplo, la estructura del etino (nombre común acetileno), el alquino más simple.
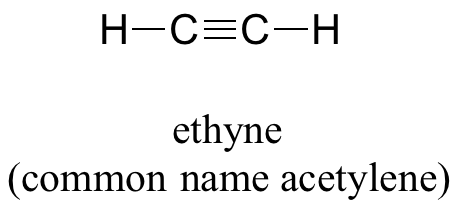
Tanto la teoría VSEPR como la evidencia experimental nos dice que la molécula es lineal: los cuatro átomos se encuentran en línea recta. El triple enlace carbono-carbono tiene solo 120pm de largo, más corto que el doble enlace en eteno, y es muy fuerte, aproximadamente 837 kJ/mol. En la imagen orbital híbrida del acetileno, ambos carbonos se hibridan sp-. En un carbono hibridado sp, el orbital de 2 s se combina con el orbital 2 p x para formar dos orbitales híbridos sp que están orientados en un ángulo de 180° entre sí (por ejemplo, a lo largo del eje x). Los orbitales 2 p y 2 p z permanecen sin hibridar, y están orientados perpendicularmente a lo largo de los ejes y y z, respectivamente.
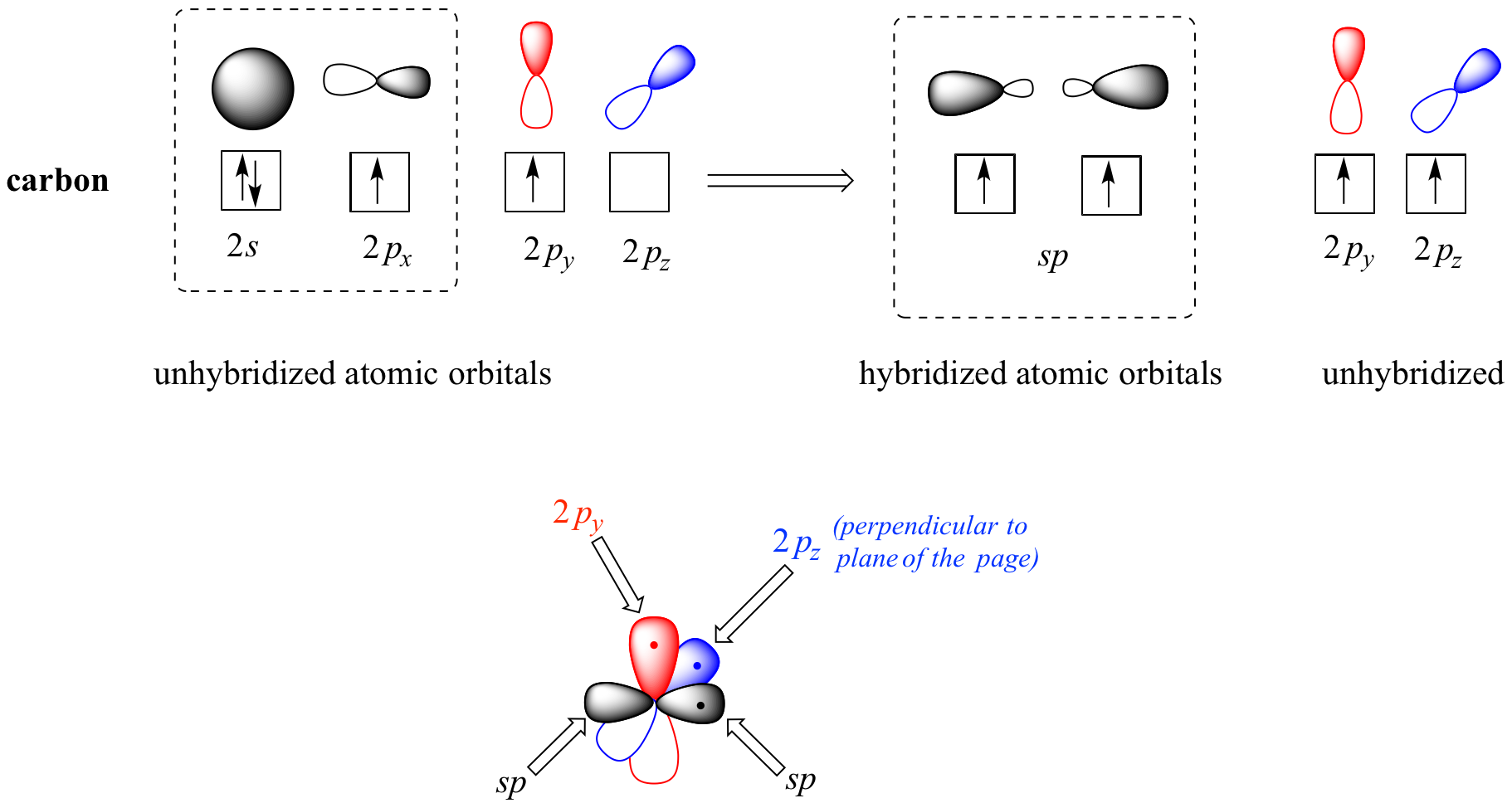
El enlace sigma carbono-carbono, entonces, está formado por el solapamiento de un orbital sp de cada uno de los carbonos, mientras que los dos enlaces sigma carbono-hidrógeno se forman por el solapamiento del segundo orbital sp en cada carbono con un orbital de 1 s sobre un hidrógeno. Cada átomo de carbono todavía tiene dos orbitales medio llenos de 2 p y y 2 p z, que son perpendiculares tanto entre sí como a la línea formada por los enlaces sigma. Estos dos pares perpendiculares de 2 p orbitales forman dos enlaces pi entre los carbonos, dando como resultado un triple enlace global (un enlace sigma más dos enlaces pi).

Ejercicio 2.7
Observe la estructura del difosfato de tiamina en la tabla 'estructuras de coenzimas comunes'. Identificar la hibridación de todos los átomos de carbono en la molécula.
Soluciones a ejercicios
El concepto orbital híbrido explica muy bien otra observación experimental: los enlaces simples adyacentes a dobles y triples enlaces son progresivamente más cortos y más fuertes que los enlaces simples adyacentes a otros enlaces simples. Considere, por ejemplo, los enlaces simples carbono-carbono en propano, propeno y propino.

Los tres son enlaces simples (sigma); el enlace en propino es más corto y más fuerte, mientras que el enlace en propano es más largo y débil. La explicación es relativamente sencilla. Un orbital sp está compuesto por un orbital s y otro orbital p, y por lo tanto tiene 50% carácter s y 50% carácter p. Los orbitales sp 2, en comparación, tienen 33% de carácter s y 67% de carácter p, mientras que los orbitales sp 3 tienen 25% de carácter s y 75% de carácter p. Debido a su forma esférica, los orbitales de 2 s son más pequeños y mantienen los electrones más cerca y 'más apretados' al núcleo, en comparación con los orbitales de 2 p. De ello se deduce que los electrones en un orbital sp, con su mayor carácter s, están más cerca del núcleo que los electrones en un orbital sp 2 o sp 3. En consecuencia, los enlaces que involucran superposición sp - sp 3 (como en el propino) son más cortos y más fuertes que los enlaces que involucran superposición sp 2 - sp 3 (como en propeno). Los enlaces que involucran superposición sp 3 -sp 3 (como en propano) son los más largos y débiles de los tres.
a) ¿Qué tipos de orbitales se superponen en los enlaces b-i indicados a continuación? Asegúrese de distinguir entre enlaces sigma y pi. Se proporciona un ejemplo para el bono 'a'.
b) ¿En qué tipo de orbital se encuentra el par solitario de electrones en el átomo de nitrógeno del enlace a? De bono e?
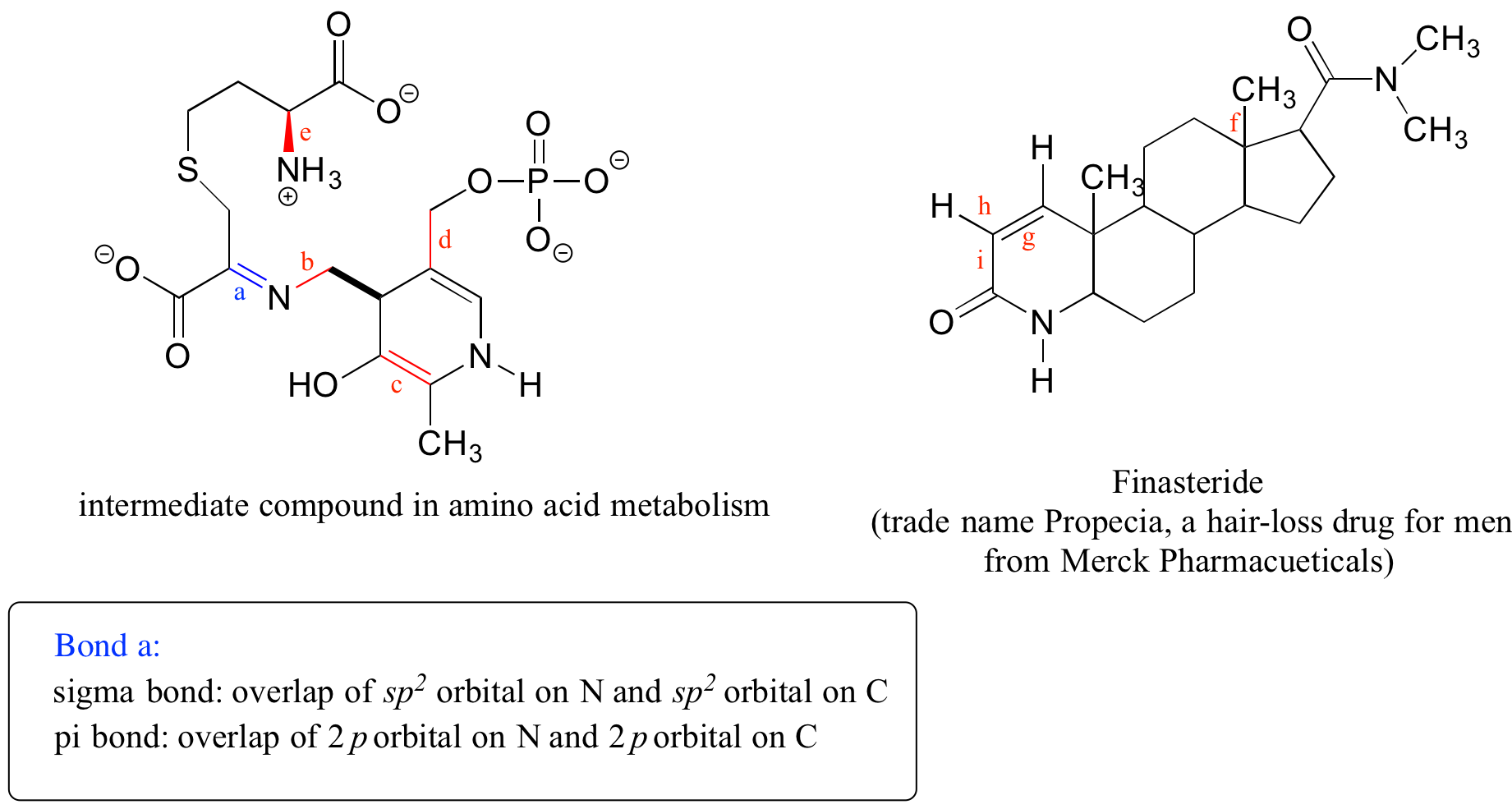
Soluciones a ejercicios
Video tutorial de Khan Academy sobre teoría de bonos de valencia/orbitales híbridos


