2.7: Soluciones a los ejercicios del Capítulo 2
- Page ID
- 72348
E2.1:
E2.2: sp 3 orbital sobre carbono superpuesto con 3p orbital sobre cloro.
E2.3: Tanto el átomo de carbono como el de nitrógeno en CH 3 NH 2 están hibridados con s p 3. El enlace sigma C-N es un solapamiento entre dos orbitales s p 3.
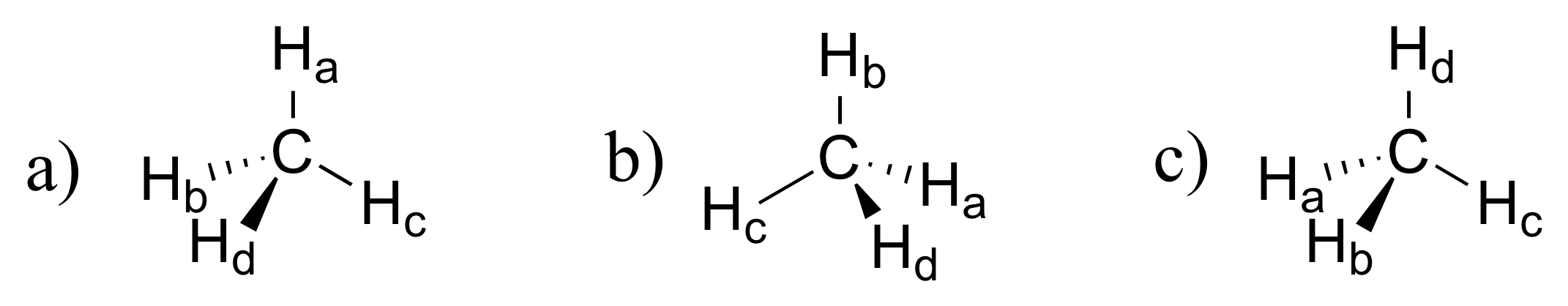
E2.4: Los átomos en rojo se encuentran todos en el mismo plano.
E2.5: Los átomos de carbono en un anillo aromático están hibridados sp 2, por lo que la geometría de unión es plana trigonal: en otras palabras, los enlaces que salen del anillo están en el mismo plano que el anillo, no apuntando por encima del plano del anillo como las cuñas en el dibujo incorrecto indicar. Un dibujo correcto debe usar líneas para indicar que los enlaces están en el mismo plano que el anillo:

E2.6:
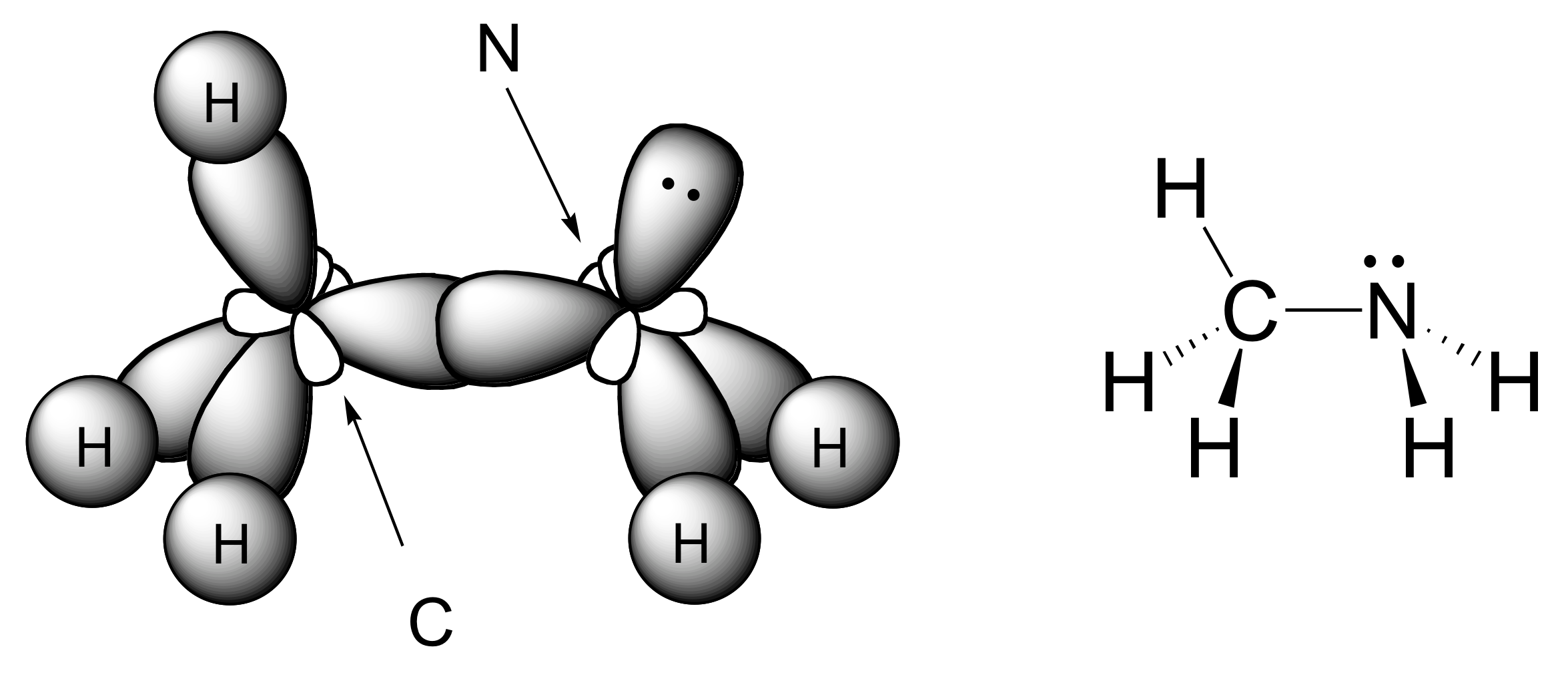
a) Los átomos de carbono y nitrógeno son ambos sp 2 hibridizados. El doble enlace carbono-nitrógeno está compuesto por un enlace sigma formado a partir de dos orbitales sp 2, y un enlace pi formado a partir del solapamiento lado a lado de dos orbitales 2p no hibridados.
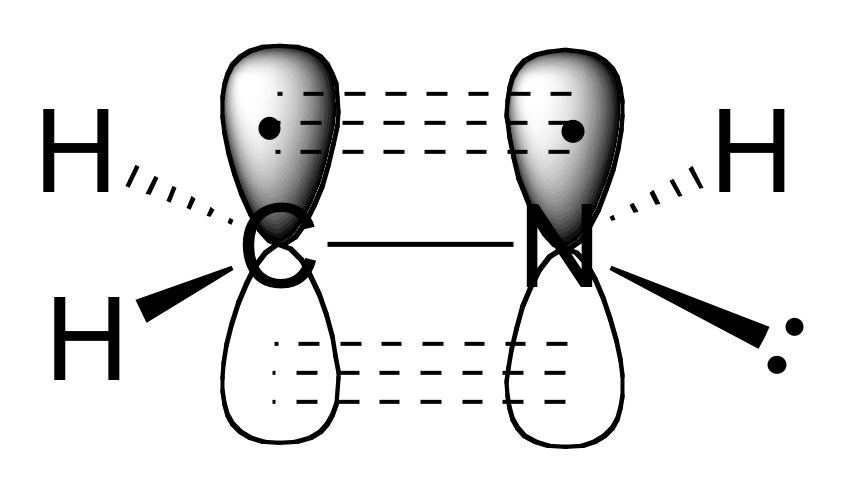
b) Como se muestra en la figura anterior, los electrones de pares solitarios de nitrógeno ocupan uno de los tres orbitales híbridos sp 2.
higo 4
E2.7:
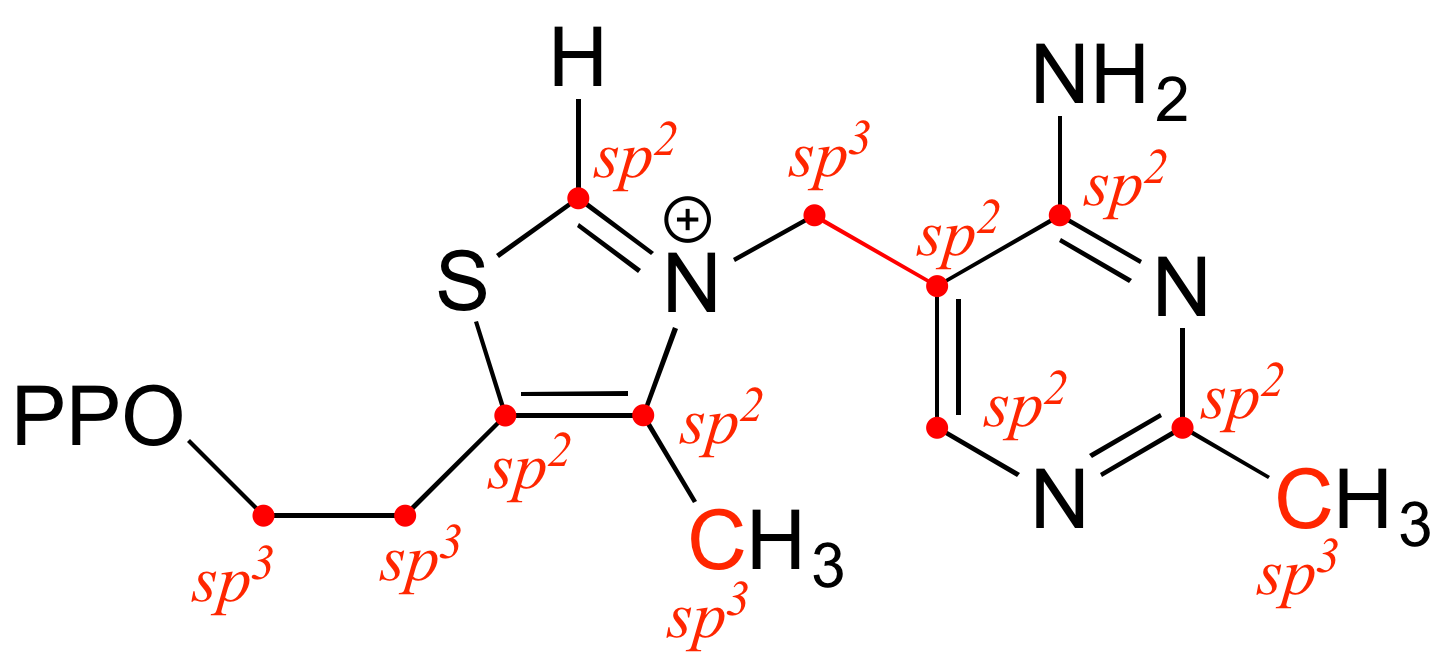
E2.8:
a)
enlace b: N sp 2 -C sp 3 (esto significa un solapamiento de un orbital sp 2 en N y un orbital sp 3 en C)
enlace c: C sp 2 -C sp 2 más C 2 p -C 2 p (pi)
enlace d: C sp 2 -C sp 3
enlace e: C sp 3 -C sp 3
enlace f: C sp 3 -C sp 3
enlace g: C sp 2 -C sp 2 (s) más C 2 p -C 2 p (p i)
enlace h: C sp 2 -H 1 s
enlace i: C sp 2 -C sp 2
b)
enlace a: par solitario en N ocupa un orbital sp 2
enlace e: par solitario en N ocupa un orbital sp 3
E2.9:
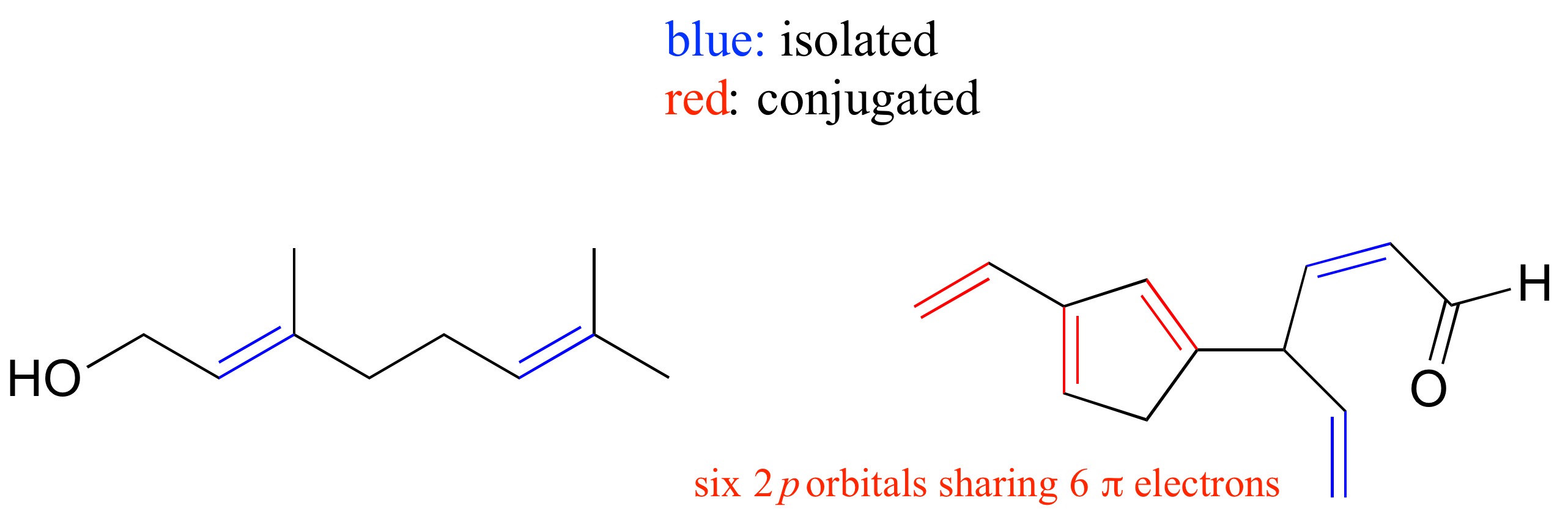
E2.10: El sistema conjugado contiene 22 orbitales de 2 p que comparten 22 electrones p i
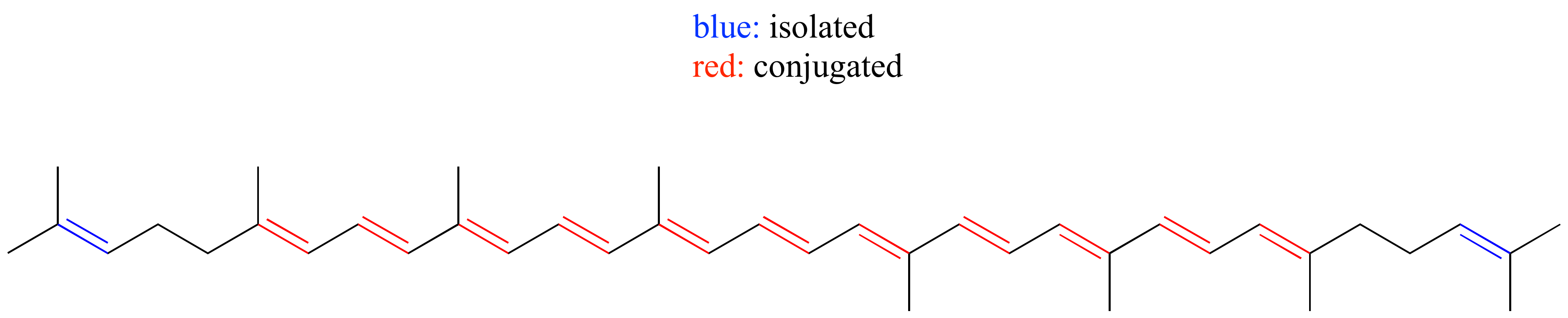
E2.11:
Indol: el nitrógeno es 'pirrol' (el par solitario es parte del anillo aromático)
Purina: N 1, N 3 y N 7 son similares a piridina (par solitario en orbital sp 2); N 9 es 'similar a pirrolo'.
E2.12:
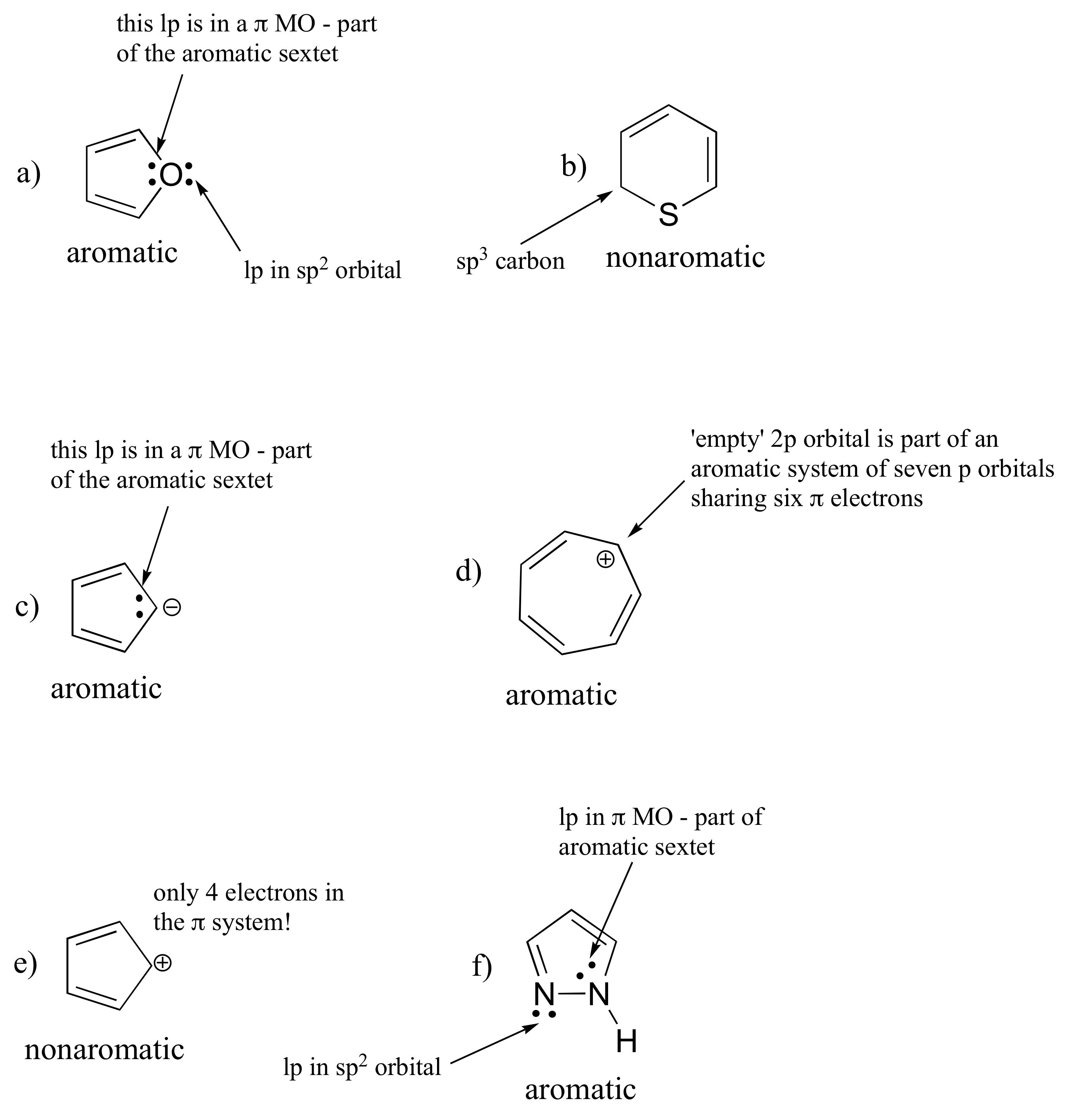
E2.13:
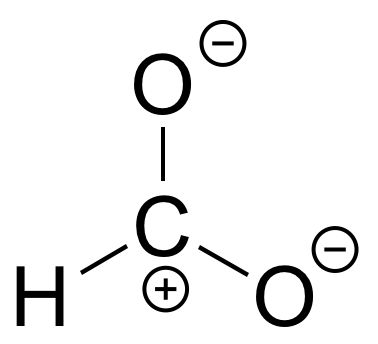
E2.15:
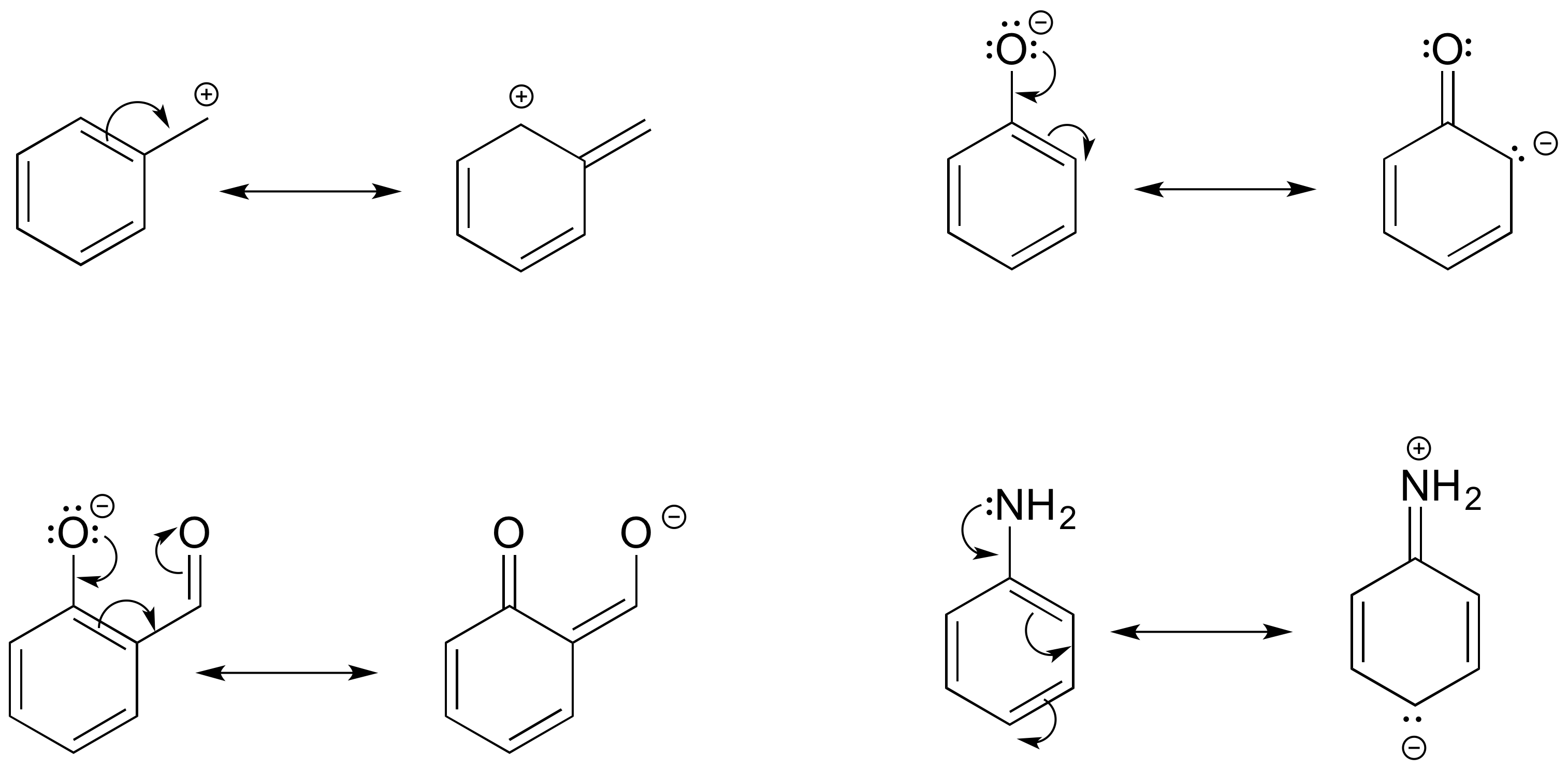
E2.16:
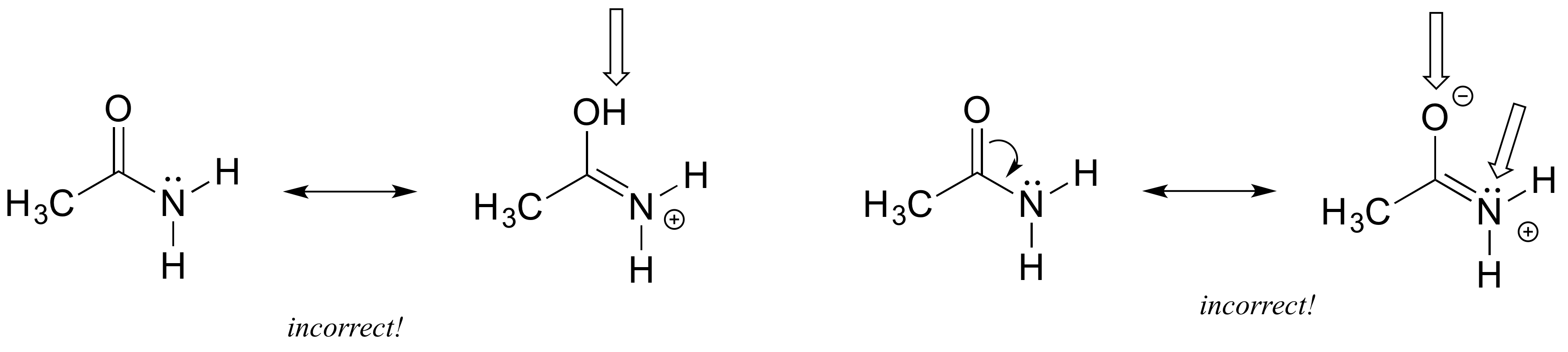
Izquierda: se ha agregado un átomo de H - en los contribuyentes de resonancia, solo se reordenan electrones pi y pares solitarios.
Derecha: Siguiendo la flecha curva, el átomo de oxígeno debe tener sólo 6 electrones y por lo tanto una carga formal positiva. También el nitrógeno está rompiendo la regla del octeto (recuerda que dibujar pares solitarios es opcional, así que incluso si no se dibujan hay que asumir que están ahí).
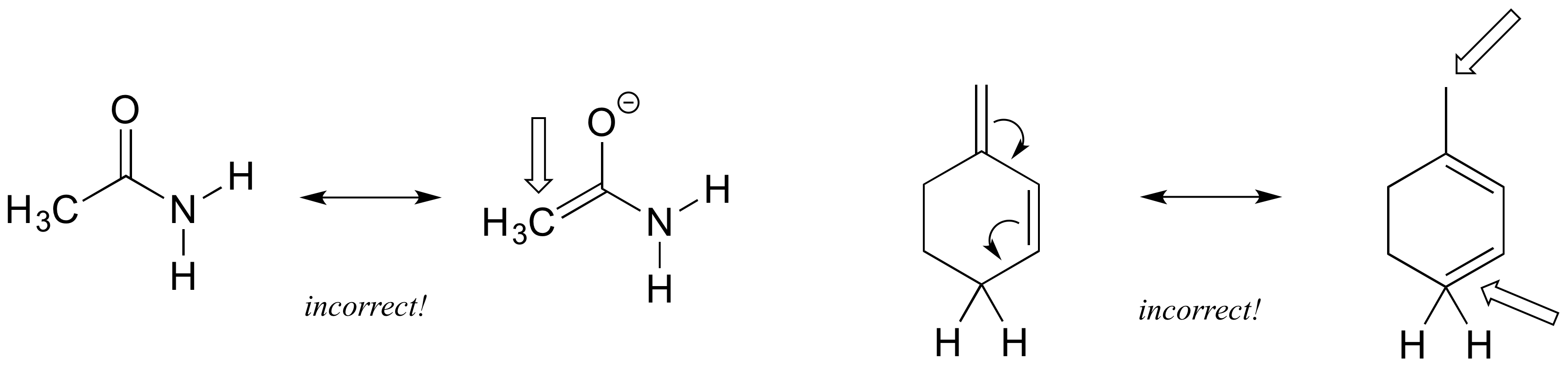
Izquierda: El carbono CH 3 está rompiendo la regla del octeto con 5 enlaces.
Derecha: Un carbono tendría una carga formal positiva si se siguen las flechas, y el otro rompe la regla del octeto con 5 enlaces (¡mantén un seguimiento cuidadoso de los átomos de hidrógeno cuando no se dibujan en estructuras lineales!)
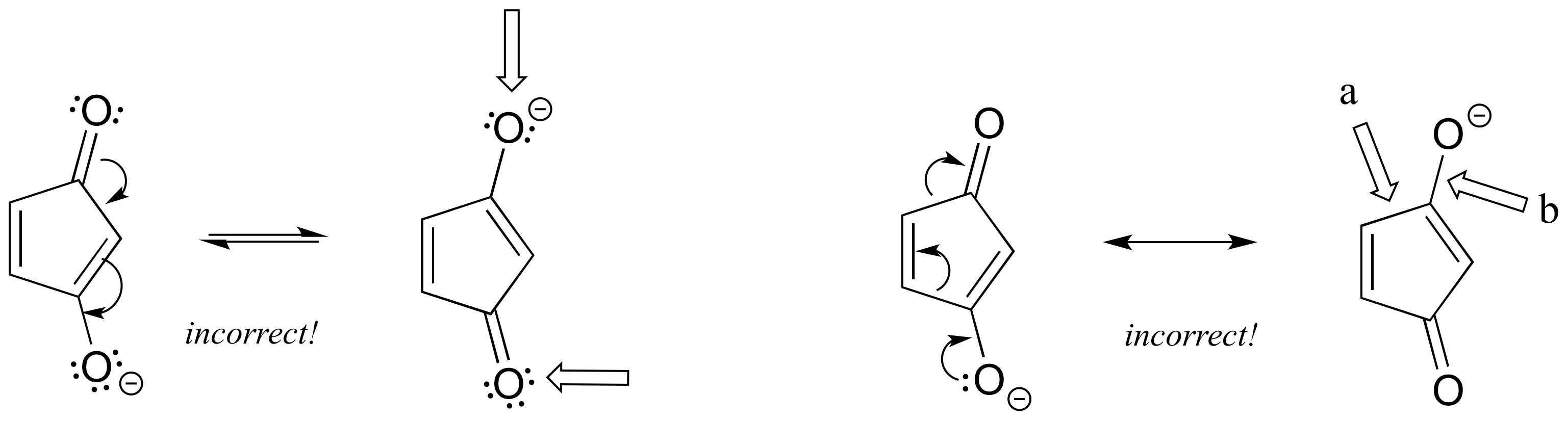
Izquierda: Un oxígeno debe tener una carga formal positiva, y uno rompe la regla del octeto.
Derecha: a) la flecha muestra esta ruptura de enlace sencillo - no se pueden romper enlaces simples en un contribuyente de resonancia. b) la flecha muestra un triple enlace que se forma aquí, lo que también significaría que el oxígeno está rompiendo la regla del octeto.
E2.17:
a)
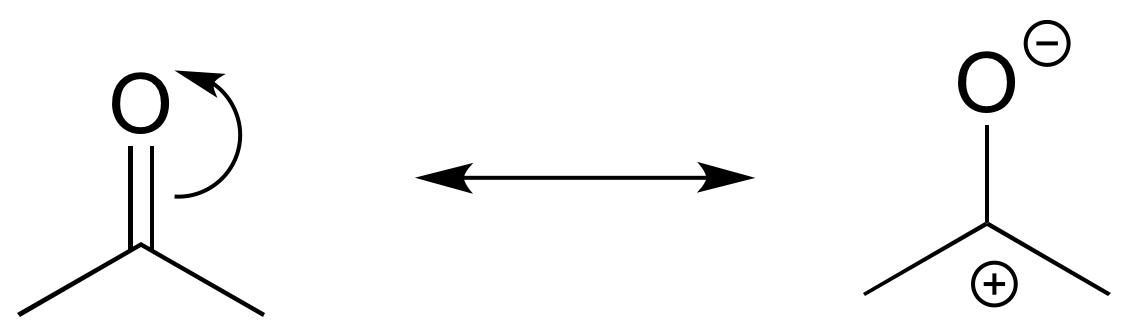
El contribuyente de la izquierda es menor porque a) tiene una separación de cargas, y b) el carbono tiene un octeto incompleto.
b) La acetona y el 2-propanol tienen la misma fórmula molecular pero diferentes disposiciones de unión átomo a átomo. Por lo tanto, son isómeros constitucionales, no contribuyentes de resonancia.
E2.18: Los contribuyentes menores tienen separación adicional de cargos.
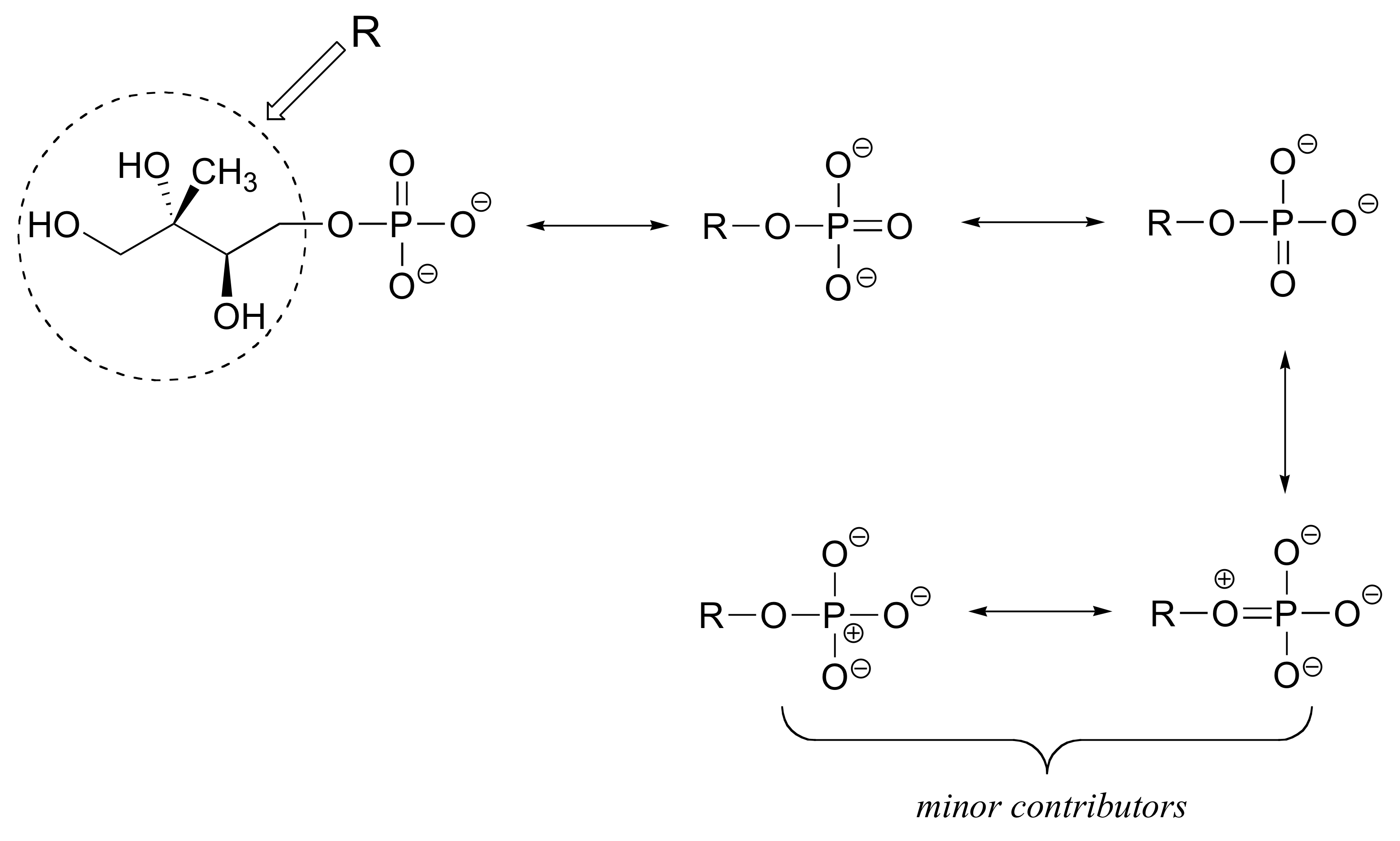
E2.19:
El contribuyente de la izquierda es el más estable: no hay cargos formales.
El contribuyente de la derecha es menos estable: hay cargos formales, y un carbono tiene un octeto incompleto.
El contribuyente en el medio es la estabilidad intermedia: hay cargas formales, pero todos los átomos tienen un octeto completo.
E2.20: Consulta a tu instructor o tutor para una evaluación de tus dibujos orbitales. Ambos contribuyentes deben mostrar tres orbitales p superpuestos (en el oxígeno, carbono carbonílico y nitrógeno) compartiendo cuatro electrones pi.
E2.21: Consulta a tu instructor o tutor para una evaluación de tus dibujos orbitales. Ambos contribuyentes deben mostrar tres orbitales p superpuestos que comparten cuatro electrones p i.
E2.22: Este contribuyente es importante porque no hay cargos formales.
E2.23:
a)
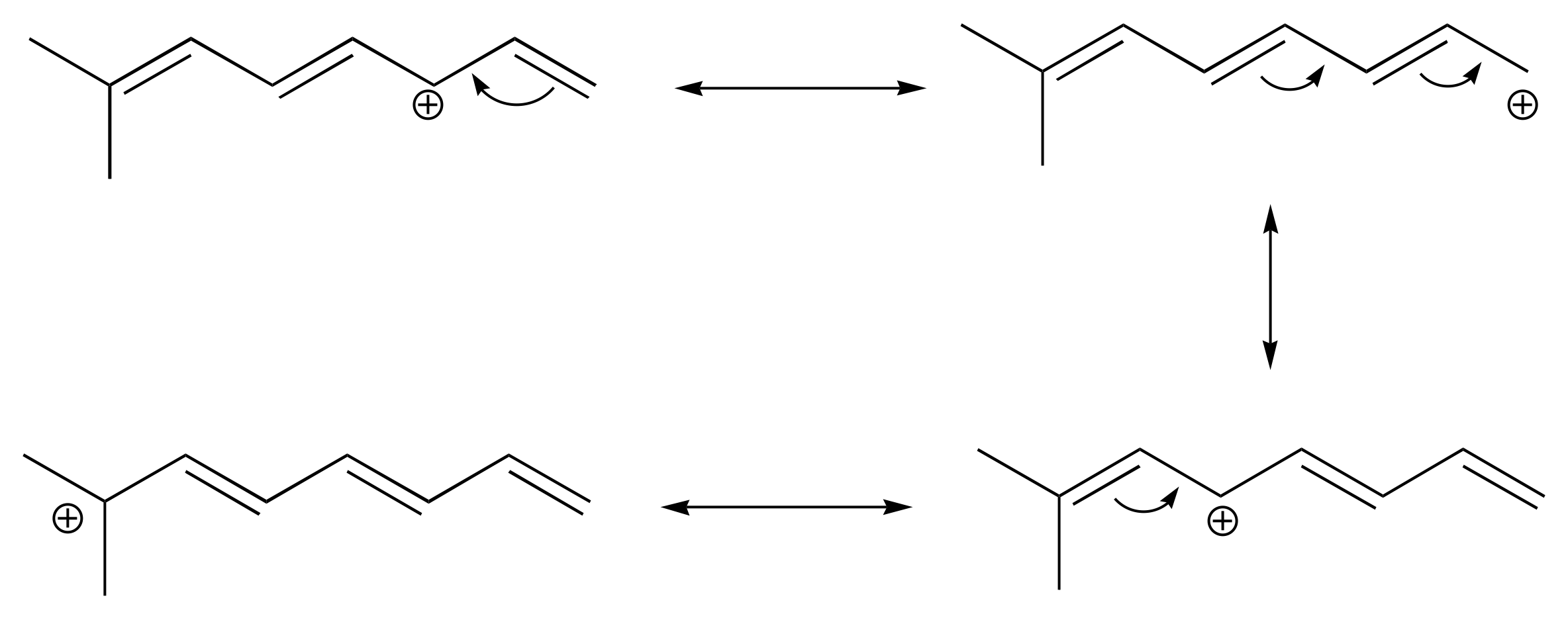
b) El sistema pi conjugado en este carbocatión está compuesto por siete orbitales 2p que contienen seis electrones pi deslocalizados.
E2.24:
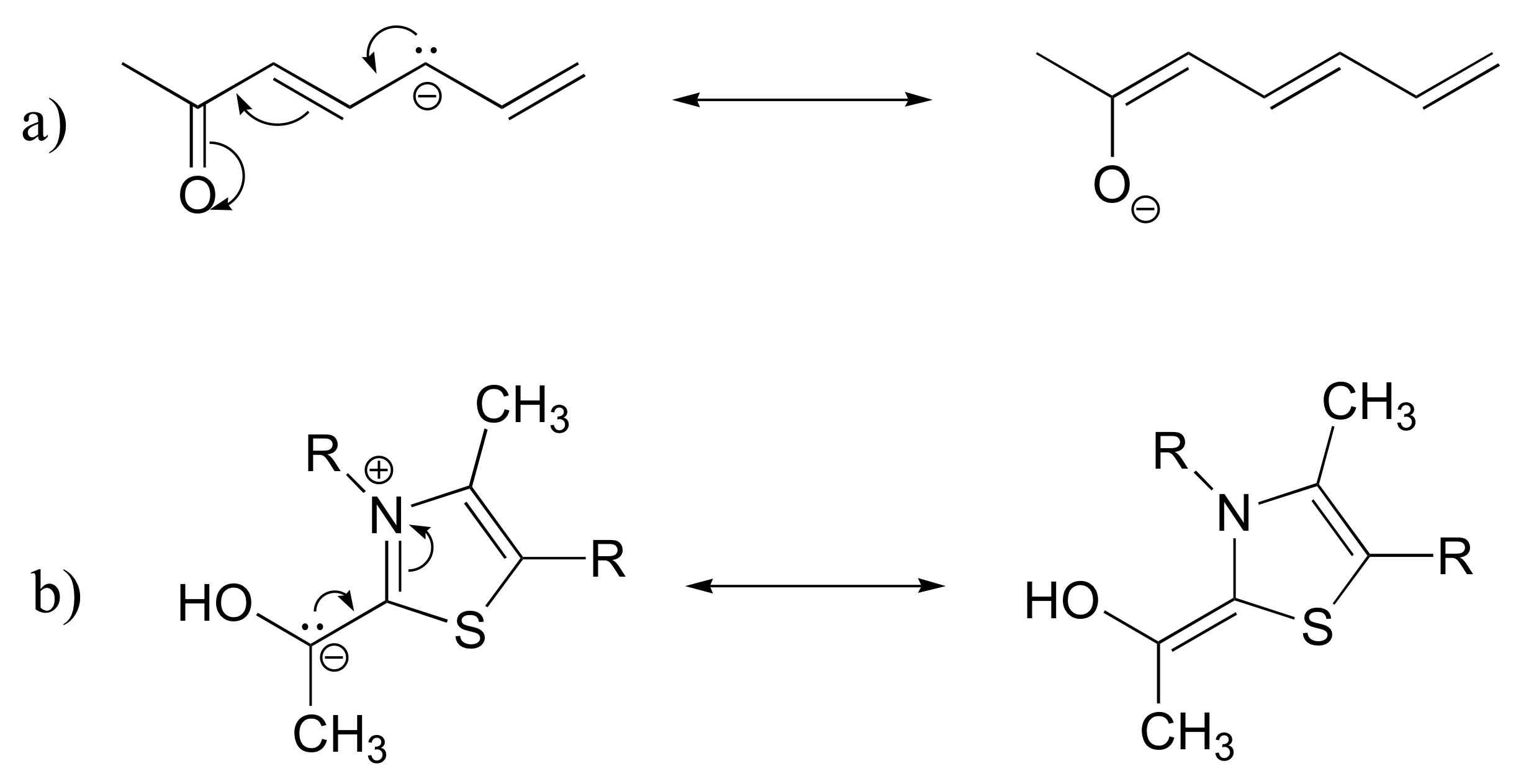
c) El sistema pi conjugado en la estructura a) está compuesto por siete orbitales de 2 p que contienen ocho electrones pi deslocalizados.
E2.25: Los dos principales contribuyentes o aquellos en los que la carga formal negativa se encuentra en un oxígeno en lugar de en un carbono.
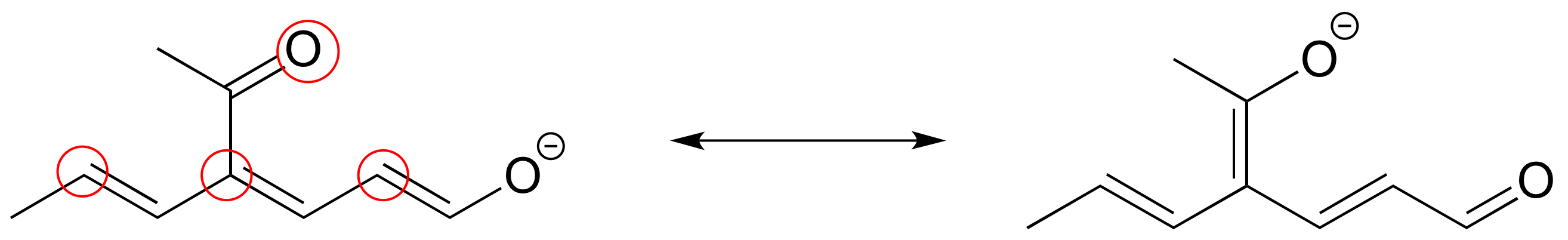
E2.26: La tendencia horizontal se basa en el número atómico (el número de protones en el núcleo). Por ejemplo, el flúor es más electronegativo que el carbono, porque el núcleo de flúor contiene tres protones más, las cargas positivas sobre las cuales acercan los electrones cargados negativamente al núcleo.
La tendencia vertical se basa en el tamaño del átomo, específicamente el tamaño de la 'nube electrónica' que rodea el núcleo. Por ejemplo, el flúor es más electronegativo que el cloro (aunque el cloro contiene más protones) porque los electrones de valencia más externos sobre el flúor, que están en la “concha” n = 2, están más cerca del núcleo que los electrones de valencia en el cloro, que ocupan el n = 3 “caparazón”. La nube de electrones de flúor, por lo tanto, está sujeta a mayores fuerzas de atracción electrostática de los protones (las fuerzas electrostáticas disminuyen rápidamente a medida que aumenta la distancia entre las cargas positivas y negativas).
E2.27: Solo la molécula (b) no tiene un dipolo molecular, debido a su simetría (los dipolos de enlace son iguales y en direcciones opuestas).
E2.28: Para ser un donador de enlaces de hidrógeno, la molécula necesita tener un hidrógeno unido a N, O o F. Para ser un aceptor, simplemente necesita un N, O o F.
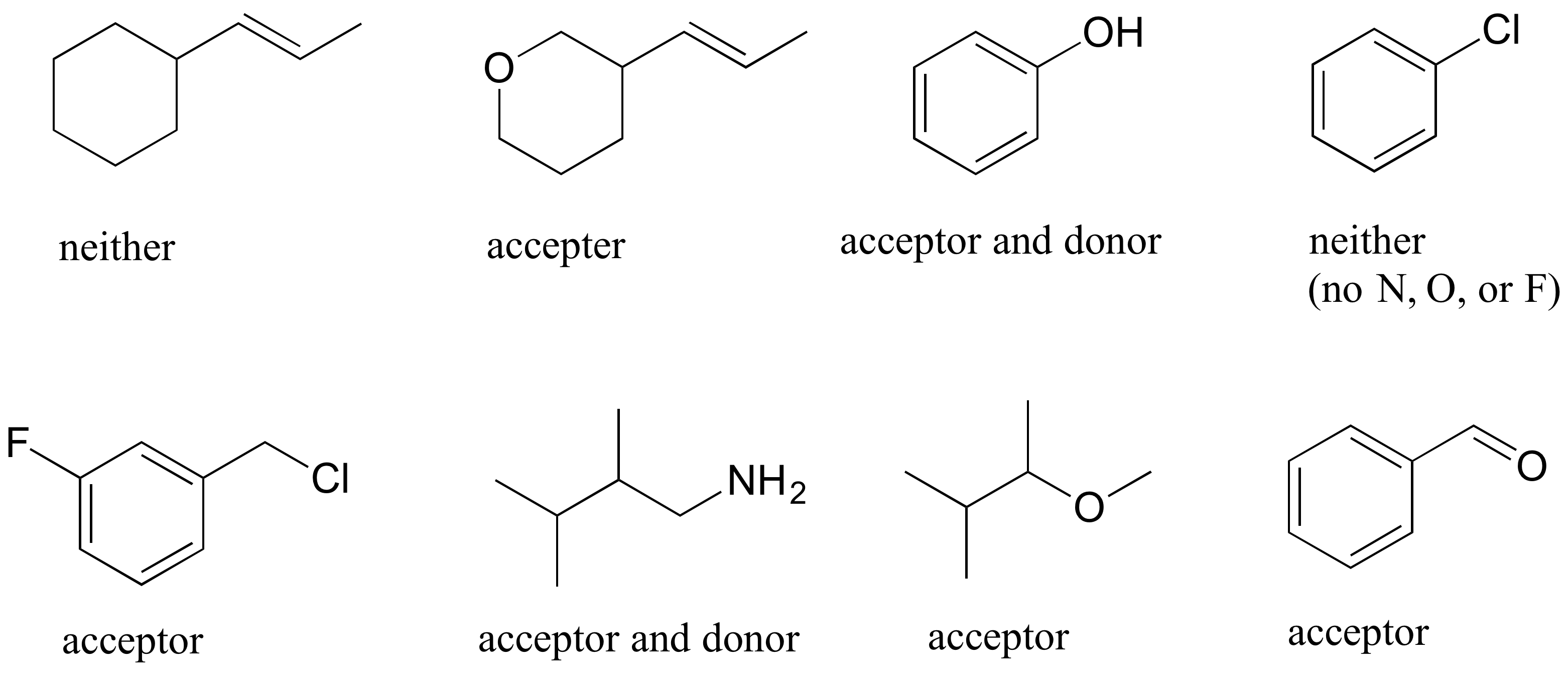
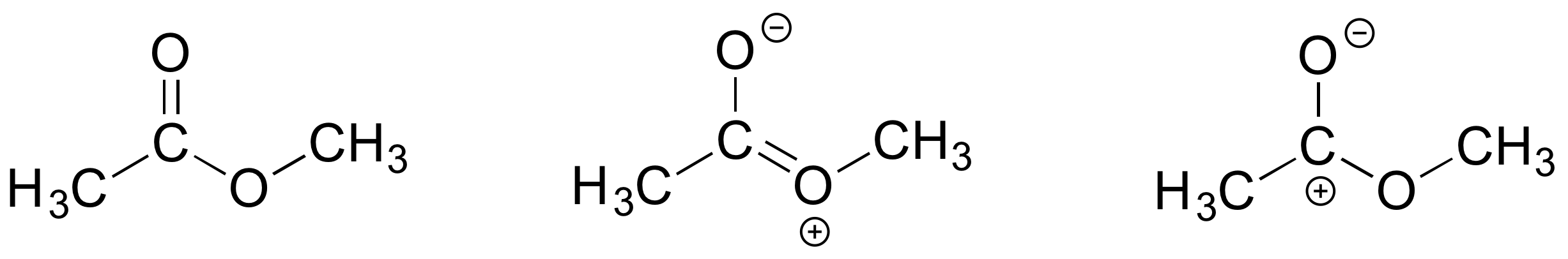
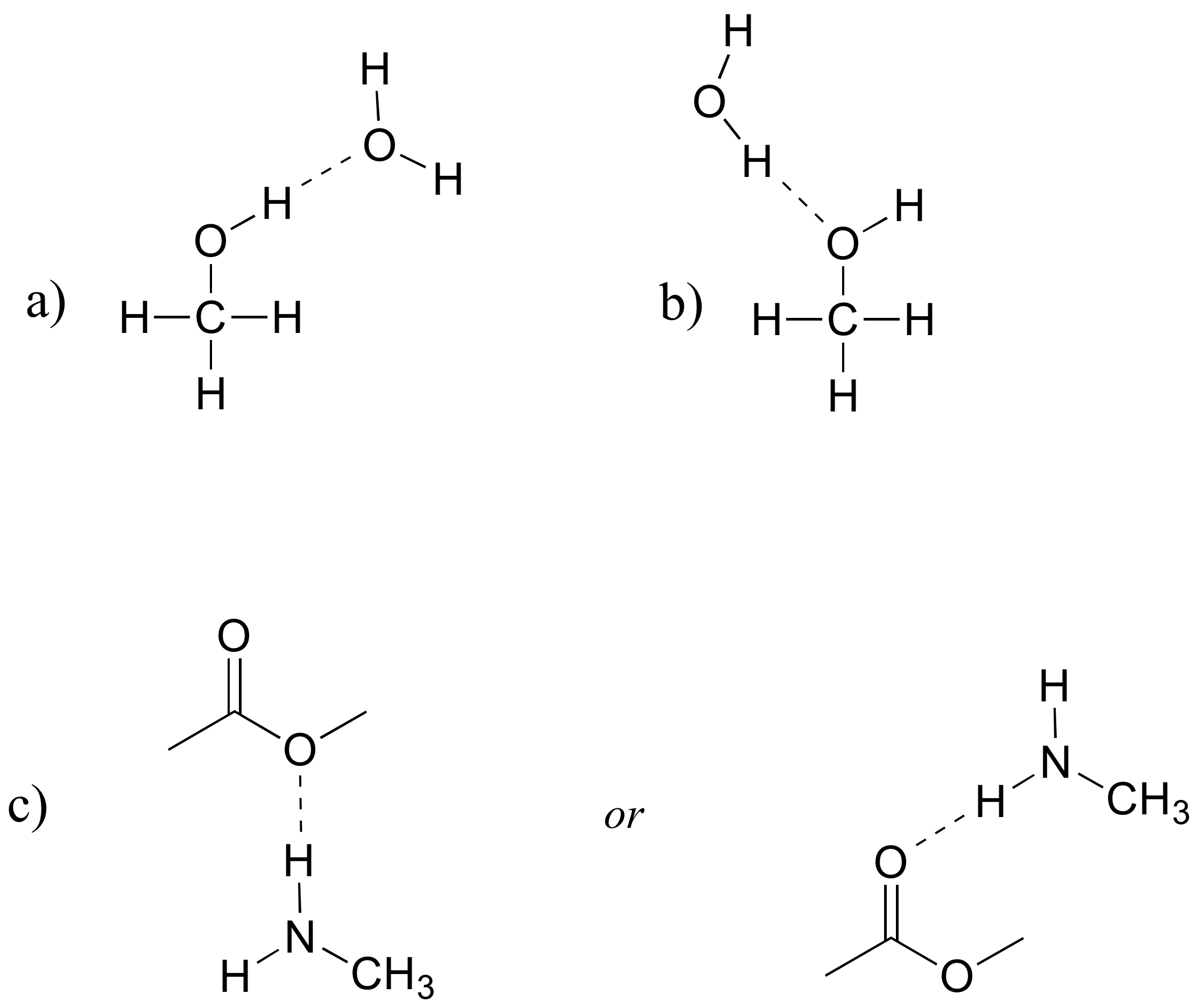
E2.29: Obsérvese en la parte c) que el acetato de metilo solo puede ser un aceptor de enlaces de hidrógeno, no un donante.
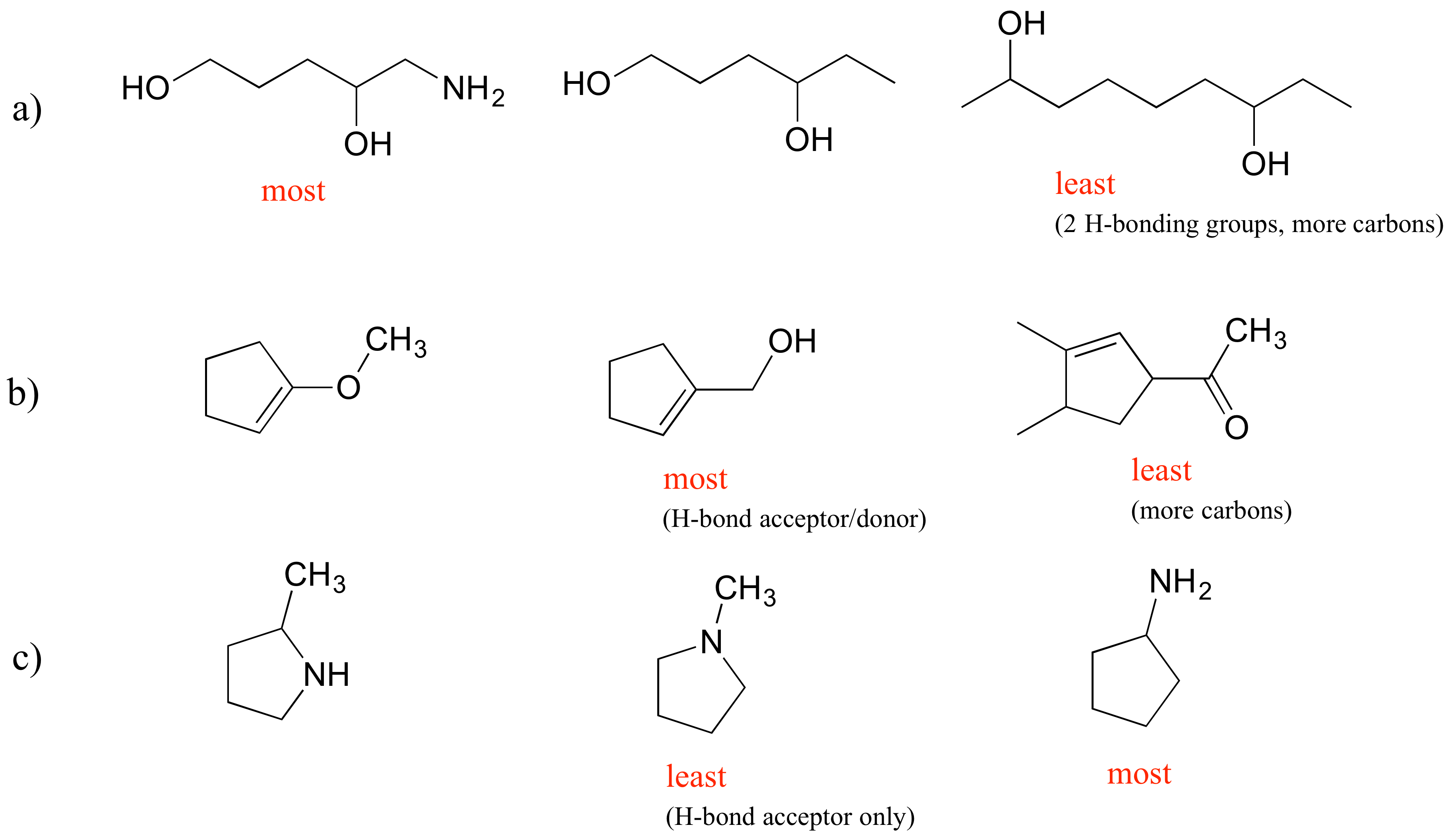
E2.30: Los principales factores en estos ejemplos son el número de grupos de enlace H, si los grupos son aceptores y donantes de enlaces H o simplemente aceptores, y el número de carbonos.
E2.31: El ácido ascórbico y la niacina son solubles en agua (muchos grupos hidrófilos en relación con el número de carbonos). El retinol es soluble en grasa (solo un grupo alcohol hidrofílico, un grupo hidrocarbonado hidrofóbico grande.
E2.32: La anilina es básica y sería protonada (y por lo tanto catiónica) en HCl acuoso. Las especies cargadas son generalmente solubles en agua. Por otro lado, el fenol no es básico y por lo tanto permanecería como una molécula neutra, insoluble en agua.
E2.33: Ambos disolventes alcohólicos podrían formar enlaces H con la ciclohexanona, pero el isopropanol es menos polar (tiene tres carbonos), y por lo tanto sería el mejor disolvente para la ciclohexanona relativamente no polar.
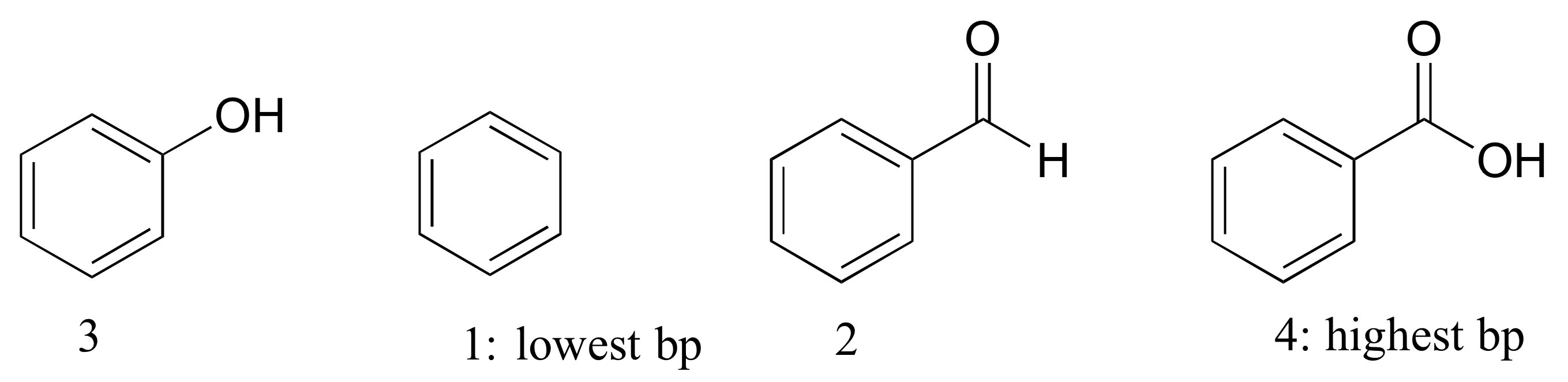
E2.34: El benceno no tiene grupos polares y, por lo tanto, tiene el punto de ebullición más bajo (las interacciones no polares solo mantienen unidas las moléculas). El benzaldehído puede formar interacciones intermoleculares dipolo-dipolo; el fenol y el benzaldehído pueden formar enlaces H intermoleculares, pero el benzaldehído tiene más interacciones dipolo-dipolo debido al átomo de oxígeno adicional.