2.6: Propiedades físicas de los compuestos orgánicos
- Page ID
- 72350
La comprensión de los diversos tipos de fuerzas no covalentes nos permite explicar, a nivel molecular, muchas propiedades físicas observables de los compuestos orgánicos. En esta sección, nos concentraremos en la solubilidad (especialmente la solubilidad en agua), el punto de fusión y el punto de ebullición.
Solubilidad
Prácticamente toda la química orgánica que verás en este curso se lleva a cabo en fase de solución. En el laboratorio orgánico, las reacciones a menudo se realizan en disolventes no polares o ligeramente polares como tolueno (metilbenceno), diclorometano o éter dietílico. En los últimos años, se ha hecho mucho esfuerzo para adaptar las condiciones de reacción para permitir el uso de solventes 'más ecológicos' (es decir, más amigables con el medio ambiente) como el agua o el etanol, que son polares y capaces de formar enlaces de hidrógeno. En las reacciones bioquímicas el disolvente es, por supuesto, agua, pero el 'microambiente' dentro del sitio activo de una enzima -donde está ocurriendo la química real- puede variar de muy polar a muy no polar, dependiendo de qué residuos de aminoácidos estén presentes.
Probablemente recuerdes la regla de 'como se disuelve como' que aprendiste en química general, e incluso antes de tomar alguna química, probablemente observaste en algún momento de tu vida que el aceite no se mezcla con el agua. Revisemos esta regla, y pongamos a trabajar nuestro conocimiento de la unión covalente y no covalente.
Al considerar la solubilidad de un compuesto orgánico en un disolvente dado, la pregunta más importante que debemos hacernos es: ¿qué tan fuertes son las interacciones no covalentes entre el compuesto y las moléculas de disolvente? Si el disolvente es polar, como el agua, entonces un componente de hidrocarburo más pequeño y/o más cargado, enlaces de hidrógeno, y otros grupos polares tenderán a aumentar la solubilidad. Si el disolvente es no polar, como el hexano, entonces es verdad exactamente lo contrario.
Imagina que tienes un matraz lleno de agua, y una selección de sustancias que probarás para ver qué tan bien se disuelven en el agua. La primera sustancia es la sal de mesa, o cloruro de sodio. Como seguramente predeciría, especialmente si alguna vez ha tomado inadvertidamente un bocado de agua mientras nada en el océano, este compuesto iónico se disuelve fácilmente en el agua. ¿Por qué? Debido a que el agua, como molécula muy polar, es capaz de formar muchas interacciones ión-dipolo tanto con el catión sodio como con el anión cloruro, cuya energía es más que suficiente para suplir la energía requerida para romper las interacciones ión-ion en el cristal de sal.

El resultado final, entonces, es que en lugar de cristales de cloruro de sodio, tenemos cationes de sodio individuales y aniones cloruro rodeados de moléculas de agua, la sal ahora está en solución. Las especies cargadas por regla general se disuelven fácilmente en el agua: en otras palabras, son muy hidrófilas (amantes del agua).
Ahora, probaremos un compuesto llamado bifenilo, que, al igual que el cloruro de sodio, es una sustancia cristalina incolora.
El bifenilo no se disuelve en absoluto en agua. ¿Por qué es esto? Porque es una molécula muy no polar, con solo enlaces carbono-carbono y carbono-hidrógeno. Es capaz de unirse muy bien a sí mismo a través de interacciones no polares de van der Waals, pero no es capaz de formar interacciones atractivas significativas con moléculas solventes muy polares como el agua. Así, el costo energético de romper las interacciones bifenilo-bifenilo en el sólido es alto, y se gana muy poco en términos de nuevas interacciones bifenil-agua. El agua es un terrible disolvente para las moléculas de hidrocarburos no polares: son muy hidrofóbicas (temerosas del agua).
A continuación, prueba una serie de compuestos alcohólicos cada vez más grandes, comenzando con metanol (1 carbono) y terminando con octanol (8 carbonos).
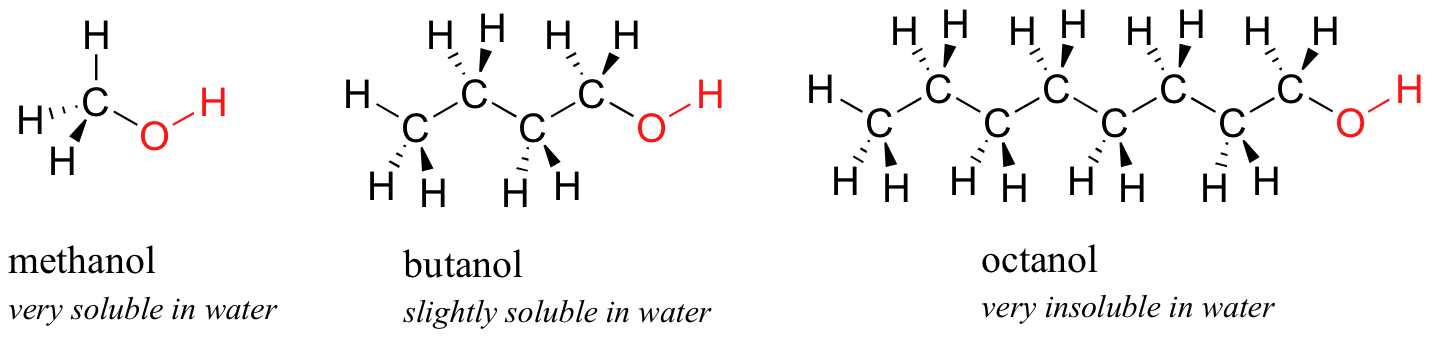
Encuentras que los alcoholes más pequeños -metanol, etanol y propanol- se disuelven fácilmente en agua, en cualquier proporción agua/alcohol que intentes. Esto se debe a que el agua es capaz de formar enlaces de hidrógeno con el grupo hidroxilo en estas moléculas, y la energía combinada de formación de estos enlaces de hidrógeno agua-alcohol es más que suficiente para suplir la energía que se pierde cuando se rompen los enlaces de hidrógeno alcohol-alcohol (y agua-agua). Cuando intentas butanol, sin embargo, comienzas a notar que, a medida que agregas más y más al agua, comienza a formar una capa sobre el agua. El butanol es escasamente soluble en agua.
Los alcoholes de cadena más larga -pentanol, hexanol, heptanol y octanol- son cada vez más insolubles en agua. ¿Qué está pasando aquí? Claramente, los mismos enlaces de hidrógeno agua-alcohol favorables aún son posibles con estos alcoholes más grandes. La diferencia, por supuesto, es que los alcoholes más grandes tienen regiones hidrofóbicas no polares más grandes además de su grupo hidroxilo hidrófilo. A aproximadamente cuatro o cinco carbonos, la influencia de la parte hidrofóbica de la molécula comienza a superar la de la parte hidrófila, y se pierde la solubilidad en agua.
Ahora, intente disolver la glucosa en el agua —aunque tenga seis carbonos al igual que el hexanol, también tiene cinco grupos hidroxilo hidrófilos con enlaces de hidrógeno además de un sexto oxígeno que es capaz de ser un aceptor de enlaces de hidrógeno.
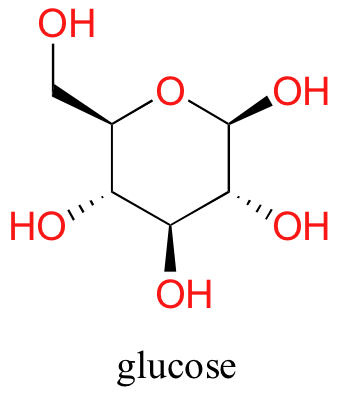
Hemos volcado las escamas hacia el lado hidrófilo, y encontramos que la glucosa es bastante soluble en agua.
Vimos que el etanol era muy soluble en agua (si no lo fuera, ¡beber cerveza o vodka sería bastante inconveniente!) ¿Qué tal el éter dimetílico, que es un isómero constitucional del etanol pero con un éter en lugar de un grupo funcional alcohol? Encontramos que el éter dietílico es mucho menos soluble en agua. ¿Es capaz de formar enlaces de hidrógeno con el agua? Sí, de hecho, lo es —el oxígeno éter puede actuar como aceptor de enlaces de hidrógeno. La diferencia entre el grupo éter y el grupo alcohol, sin embargo, es que el grupo alcohol es tanto un donador como un aceptor de enlaces de hidrógeno.
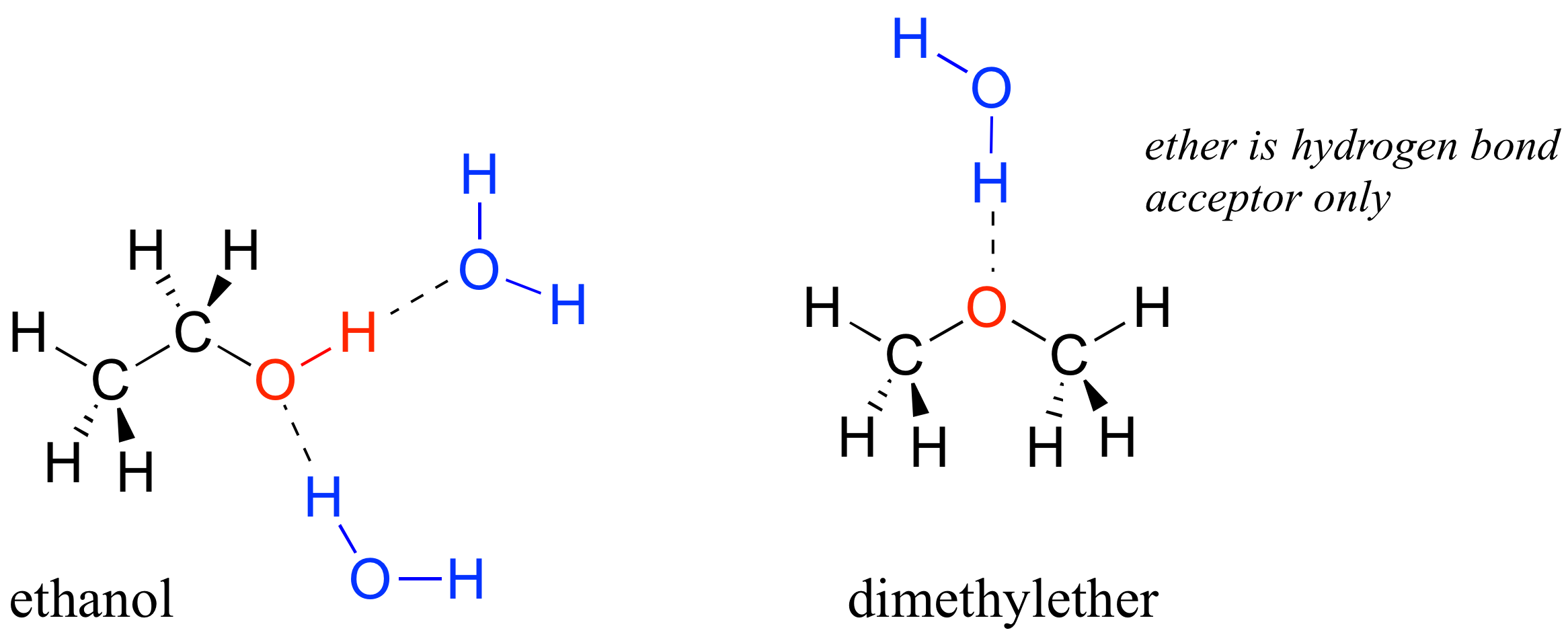
El resultado es que el alcohol es capaz de formar interacciones más energéticamente favorables con el disolvente en comparación con el éter, por lo que el alcohol es mucho más soluble.
Aquí hay otro experimento fácil que se puede hacer (con la supervisión adecuada) en un laboratorio orgánico. Intenta disolver los cristales de ácido benzoico en agua a temperatura ambiente; encontrarás que no es soluble. Como aprenderemos cuando estudiemos la química ácido-base en un capítulo posterior, los ácidos carboxílicos como el ácido benzoico son ácidos relativamente débiles, y por lo tanto existen principalmente en forma ácida (protonada) cuando se agregan al agua pura.
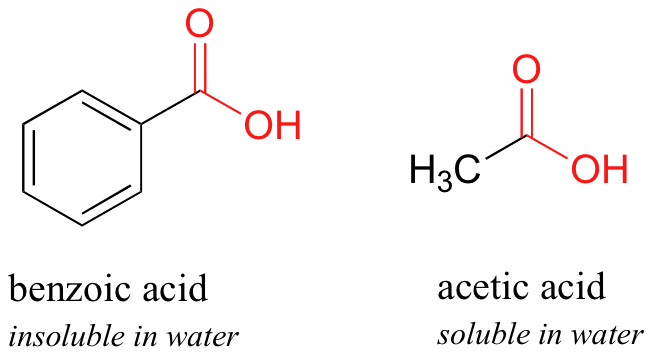
El ácido acético (vinagre) es bastante soluble. Esto es fácil de explicar usando el argumento alcohol pequeño vs alcohol grande: el efecto hidrofílico de enlace de hidrógeno del grupo ácido carboxílico es lo suficientemente poderoso como para superar el efecto hidrófobo de un solo grupo metilo hidrófobo sobre el ácido acético, pero no el mayor efecto hidrófobo del benceno de 6 carbonos grupo en ácido benzoico.
Ahora, intente agregar lentamente un poco de hidróxido de sodio acuoso al matraz que contiene ácido benzoico no disuelto. A medida que el disolvente se vuelve cada vez más básico, el ácido benzoico comienza a disolverse, hasta que está completamente en solución.
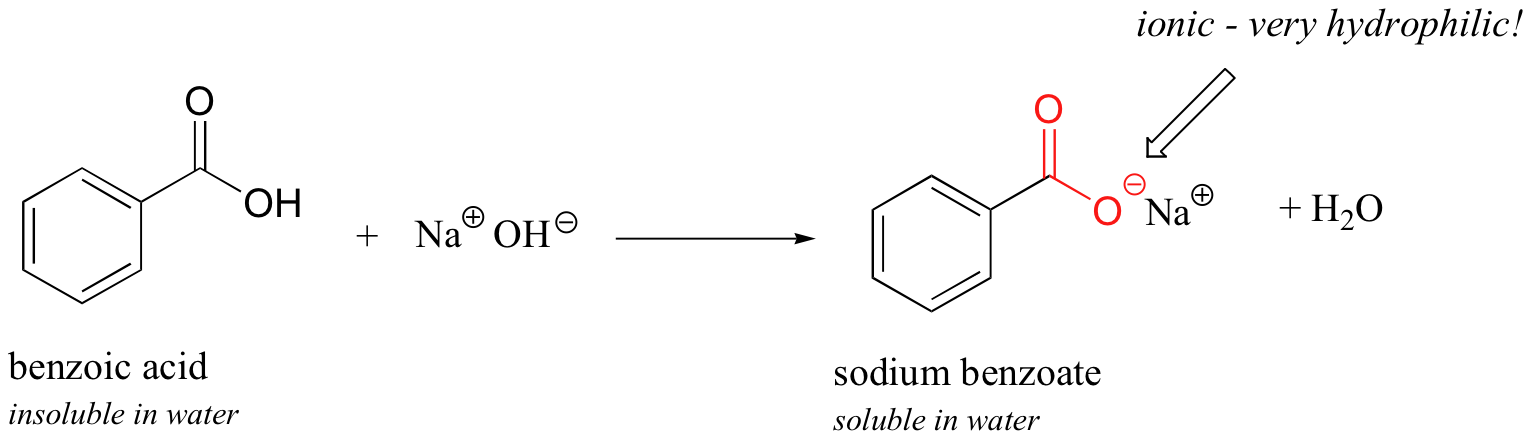
Lo que está sucediendo aquí es que el ácido benzoico se está convirtiendo en su base conjugada, el benzoato. El grupo ácido carboxílico neutro no era lo suficientemente hidrófilo como para constituir el anillo de benceno hidrófobo, pero el grupo carboxilato, con su carga negativa completa, es mucho más hidrófilo. Ahora, el equilibrio se inclina a favor de la solubilidad en agua, ya que la parte aniónica poderosamente hidrófila de la molécula arrastra la parte hidrófoba a la solución. Recuerde, las especies cargadas generalmente se disuelven fácilmente en el agua. Si quieres precipitar el ácido benzoico de nuevo de la solución, simplemente puedes agregar suficiente ácido clorhídrico para neutralizar la solución y reprotonar el carboxilato.
Si estás tomando un componente de laboratorio de tu curso de química orgánica, probablemente harás al menos un experimento en el que usarás este fenómeno para separar físicamente un ácido orgánico como el ácido benzoico de un compuesto hidrocarbonado como el bifenilo.
Se pueden hacer argumentos similares para racionalizar la solubilidad de diferentes compuestos orgánicos en disolventes no polares o ligeramente polares. En general, cuanto mayor es el contenido de grupos cargados y polares en una molécula, menos soluble tiende a ser en disolventes como el hexano. El cloruro de sodio iónico y muy hidrófilo, por ejemplo, no es en absoluto soluble en disolvente hexano, mientras que el bifenilo hidrófobo es muy soluble en hexano.
Debido a que nos estamos concentrando en la química biológicamente relevante, tomemos un minuto para revisar cómo evaluar la solubilidad de un compuesto en agua, el disolvente biológico:
R: ¿Cuántos carbonos? Siendo todos los demás iguales, más carbonos significa más de un carácter no polar/hidrófobo y, por lo tanto, una menor solubilidad en agua.
B: ¿Cuántos y qué tipo de grupos hidrófilos? Cuanto más, mayor es la solubilidad en agua. En orden de importancia:
- Cualquier cosa con un grupo cargado (por ejemplo, amonio, carboxilato, fosfato) es casi con certeza soluble en agua, a menos que tenga un grupo no polar variar grande, en cuyo caso lo más probable es que sea soluble en forma de micelas, como un jabón o detergente (ver siguiente sección).
- Cualquier grupo funcional que pueda donar un enlace de hidrógeno al agua (por ejemplo, alcoholes, aminas) contribuirá significativamente a la solubilidad en agua.
- Cualquier grupo funcional que solo pueda aceptar un enlace de hidrógeno del agua (por ejemplo, cetonas, aldehídos, éteres) tendrá un efecto algo menor pero aún significativo sobre la solubilidad en agua.
- Otros grupos que contribuyen a la polaridad (por ejemplo, haluros de alquilo, sulfuros de tioles) harán una pequeña contribución a la solubilidad en agua.
Clasifique cada conjunto de tres compuestos a continuación de acuerdo con su solubilidad en agua (más soluble a menos):
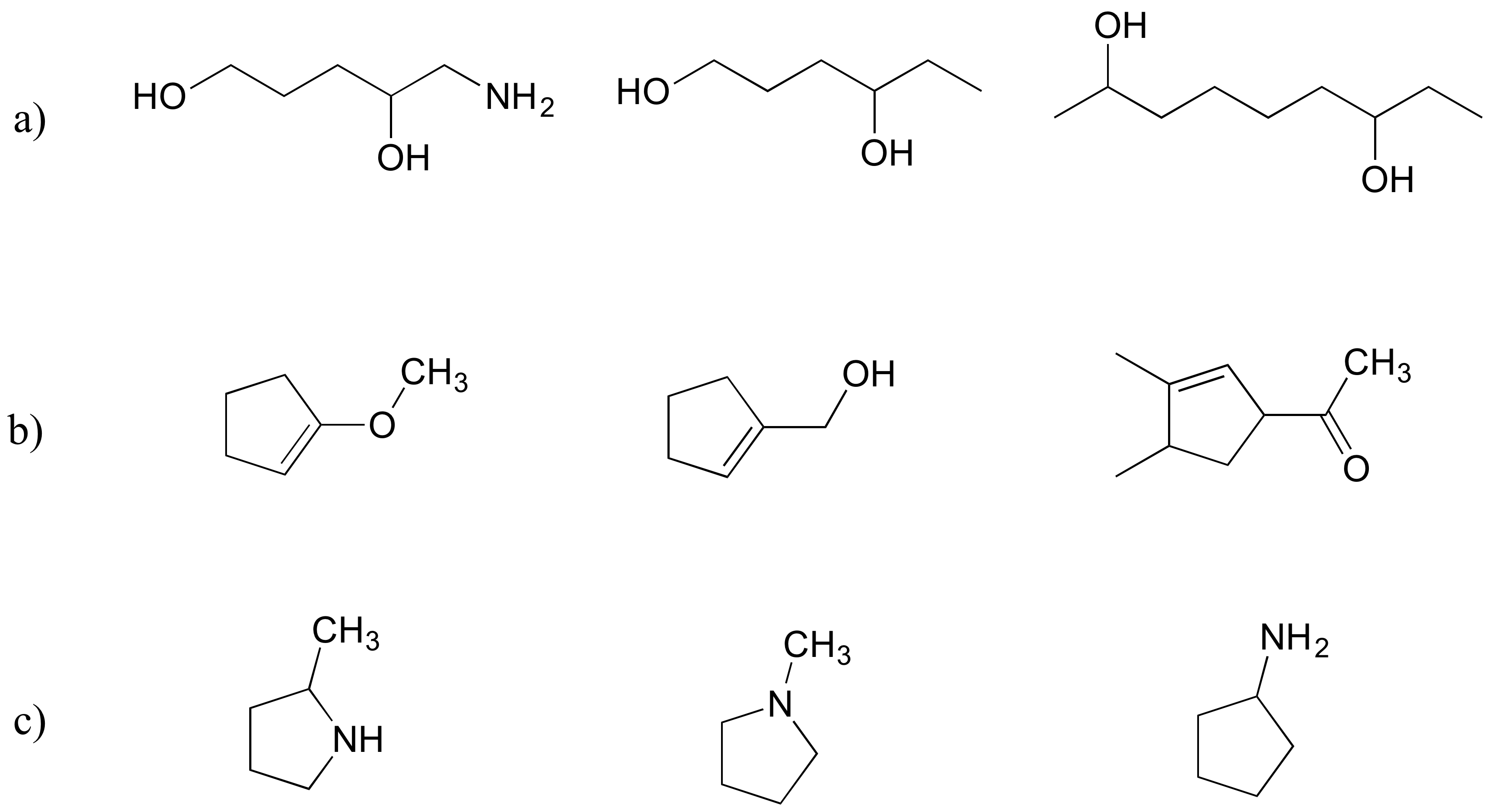
Ejercicio 2.31
Las vitaminas pueden clasificarse como solubles en agua o liposolubles (considera que la grasa es un 'disolvente' muy no polar. Decidir una clasificación para cada una de las vitaminas que se muestran a continuación.
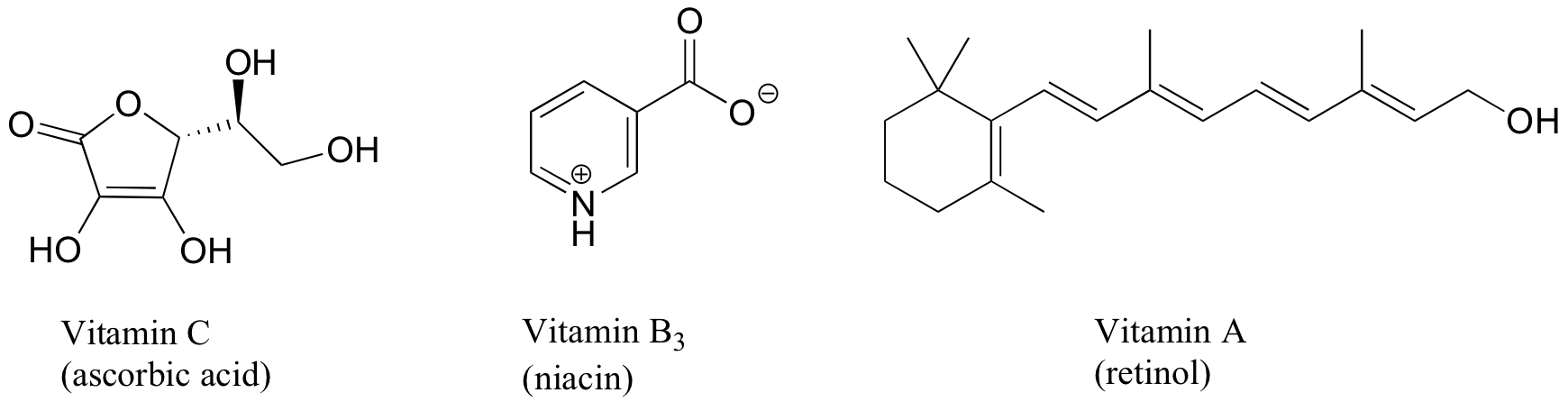
Ejercicio 2.32
Tanto la anilina como el fenol son en su mayoría insolubles en agua pura. Predice la solubilidad de estos dos compuestos en ácido clorhídrico acuoso al 10%, y explica tu razonamiento.
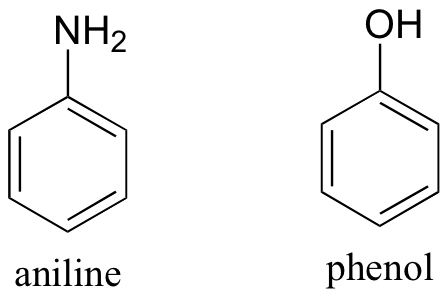
Ejercicio 2.33
¿Predeciría que el metanol o el 2-propanol (alcohol para frotar) serían un mejor disolvente para la ciclohexanona? ¿Por qué?
Soluciones a los ejercicios
Debido a que el agua es el disolvente biológico, la mayoría de las moléculas orgánicas biológicas, para mantener la solubilidad en agua, contienen uno o más grupos funcionales cargados: la mayoría de las veces fosfato, amonio o carboxilato.
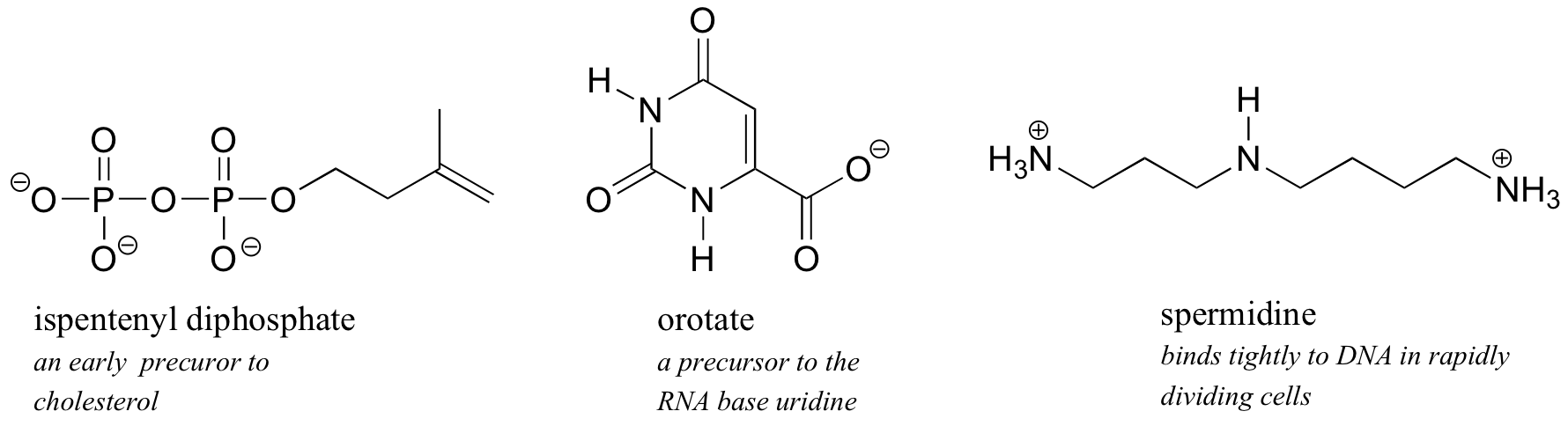
Obsérvese que la carga en estos grupos funcionales depende de su estado de protonación: la espermidina, por ejemplo, podría extraerse con tres grupos amina (no cargados) en lugar de los grupos amonio cargados como se muestra, y el orotato podría extraerse en la forma de ácido carboxílico sin carga. Resulta, sin embargo, que estos tres grupos funcionales están todos cargados cuando están en un tampón al pH fisiológico de aproximadamente 7.3. Tendremos mucho más que decir sobre los aspectos ácido-base de estos grupos en el capítulo 7.
Los carbohidratos a menudo carecen de grupos cargados, pero como discutimos en nuestro 'experimento de pensamiento' con glucosa, son bastante solubles en agua debido a la presencia de múltiples grupos hidroxilo, que pueden formar enlaces de hidrógeno con el agua.
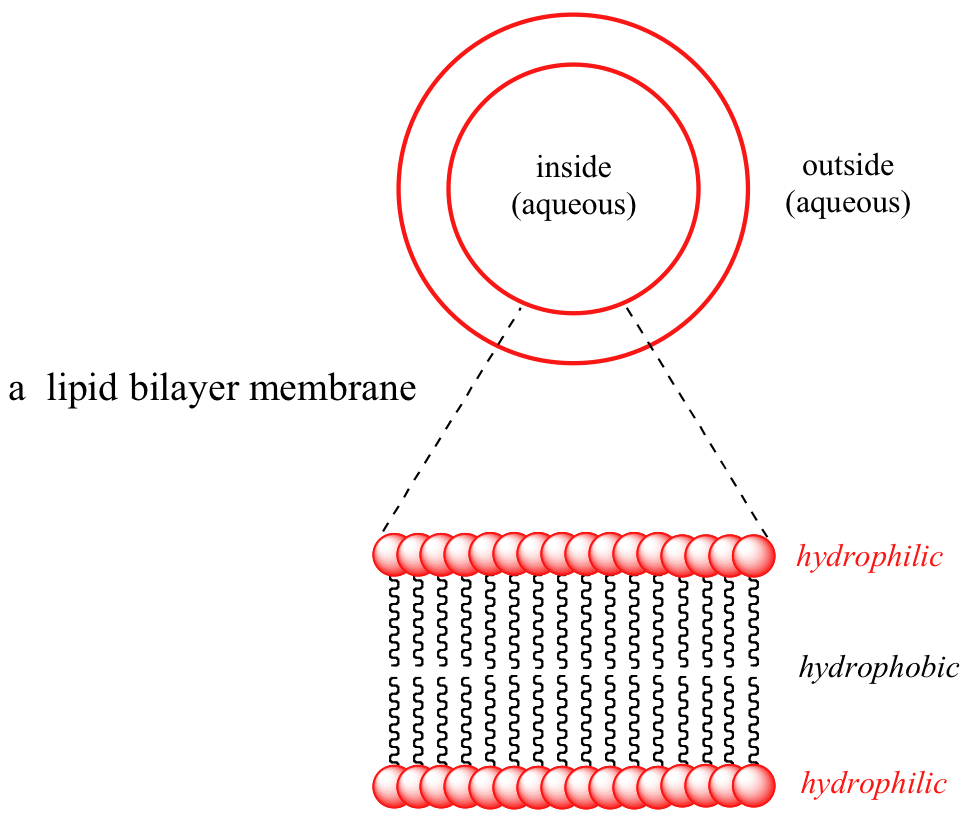
Algunas biomoléculas, por el contrario, contienen componentes claramente hidrófobos. Los lípidos de membrana son anfipáticos, lo que significa que contienen componentes tanto hidrofóbicos como hidrófilos. Las membranas celulares están compuestas por lípidos de membrana dispuestos en una 'bicapa', con las 'colas' hidrófobas apuntando hacia adentro y las 'cabezas' hidrófilas formando las superficies interna y externa, ambas en contacto con el agua.
Imágenes 3D interactivas de una molécula de jabón de ácidos grasos y una micela de jabón (Edutopics)
El interior no polar de la bicapa lipídica es capaz de 'disolver' biomoléculas hidrófobas como el colesterol. Las biomoléculas polares y cargadas, por otro lado, no son capaces de cruzar la membrana, porque son repelidas por el ambiente hidrófobo del interior de la bicapa. El transporte de moléculas solubles en agua a través de una membrana se puede lograr de manera controlada y específica mediante proteínas especiales de transporte transmembrana, un tema fascinante del que aprenderás más si tomas una clase de bioquímica.
Un principio similar es la base para la acción de los jabones y detergentes. Los jabones están compuestos por ácidos grasos como el estearato obtenido a través de la hidrólisis básica de triacilgliceroles en grasas y aceites.
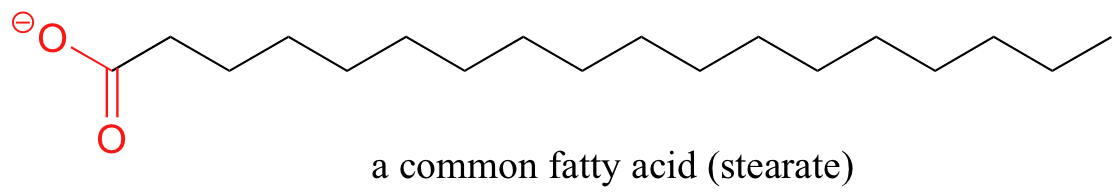
Al igual que los lípidos de membrana, los ácidos grasos son anfipáticos. En solución acuosa, las moléculas de ácidos grasos en los jabones formarán espontáneamente micelas, una estructura esférica que permite que las colas hidrófobas eviten el contacto con el agua y simultáneamente formen contactos favorables de van der Waals entre sí.
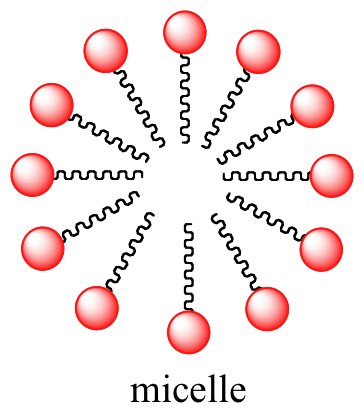
Imágenes 3D interactivas de una molécula de jabón de ácidos grasos y una micela de jabón (Edutopics)
Debido a que el exterior de la micela está cargado, la estructura en su conjunto es soluble en agua. Las micelas se formarán espontáneamente alrededor de pequeñas partículas de aceite que normalmente no se disolverían en agua, y llevarán la partícula con ella a la solución. Aprenderemos más sobre la química de la elaboración de jabón en el capítulo 11.
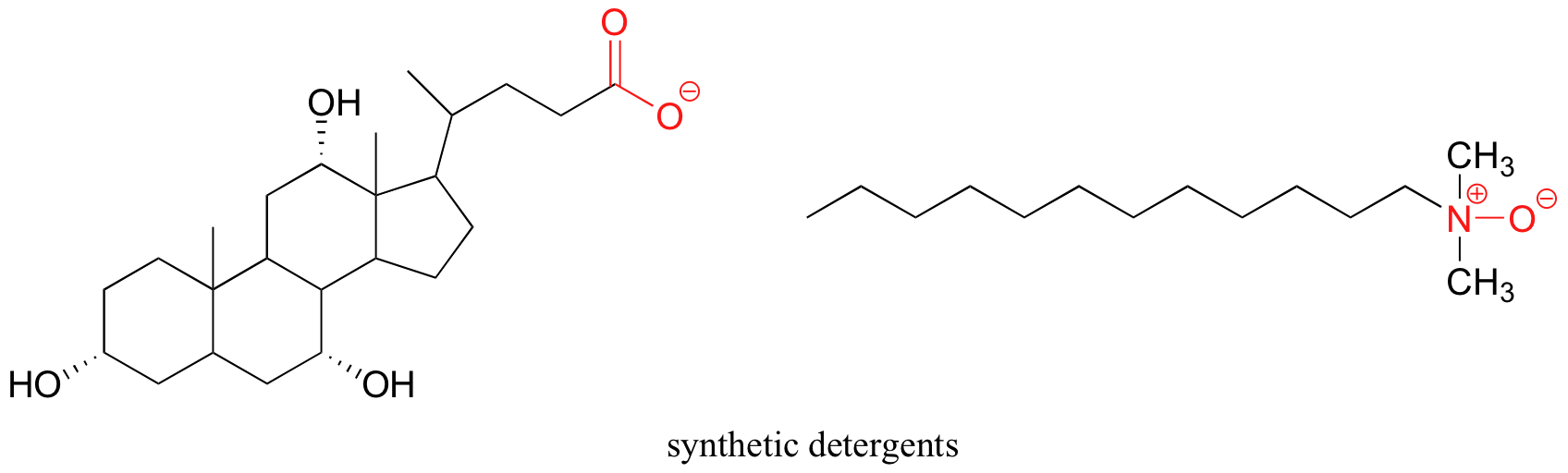
Los detergentes sintéticos son moléculas anfipáticas no naturales que funcionan según el mismo principio que el descrito para los jabones.
Punto de ebullición y punto de fusión
Los puntos de fusión y ebullición observables de diferentes moléculas orgánicas proporcionan una ilustración adicional de los efectos de las interacciones no covalentes. El principio general involucrado es simple: ¿qué tan bien puede un compuesto unirse a sí mismo? La fusión y la ebullición son procesos en los que se alteran las interacciones no covalentes entre moléculas idénticas en una muestra pura. Cuanto más fuertes sean las interacciones no covalentes, más energía se requiere, en forma de calor, para separarlas.
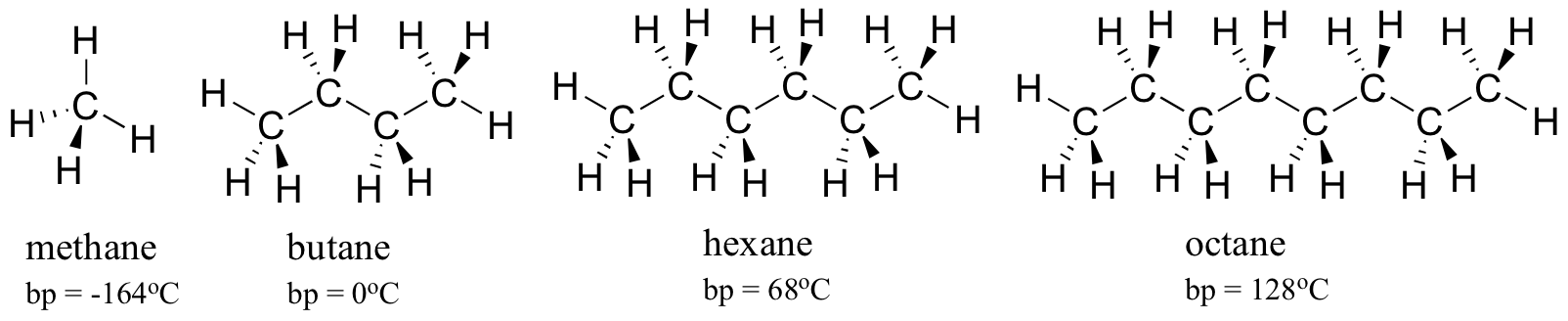
Como regla general, las moléculas más grandes tienen puntos de ebullición (y fusión) más altos. Considera los puntos de ebullición de hidrocarburos cada vez más grandes. Más carbonos e hidrógenos significa una mayor superficie posible para la interacción de van der Waals y, por lo tanto, mayores puntos de ebullición. Bajo cero grados centígrados (y a presión atmosférica) el butano es un líquido, debido a que las moléculas de butano se mantienen unidas por las fuerzas de Van der Waals. Por encima de cero grados, sin embargo, las moléculas obtienen suficiente energía térmica para separarse y entrar en la fase gaseosa. El octano, por el contrario, permanece en la fase líquida hasta los 128 o C, debido al aumento de las interacciones de van der Waals posibilitadas por la mayor superficie de las moléculas individuales.
La fuerza de los enlaces intermoleculares de hidrógeno y las interacciones dipolo-dipolo se refleja en puntos de ebullición más altos. Observe la tendencia del hexano (solo interacciones de van der Waals), 3-hexanona (interacciones dipolo-dipolo) y 3-hexanol (enlaces de hidrógeno). En las tres moléculas, las interacciones de van der Waals son significativas. El grupo cetona polar permite que la 3-hexanona forme interacciones intermoleculares dipolo-dipolo, además de las interacciones más débiles de van der Waals. El 3-hexanol, debido a su grupo hidroxilo, es capaz de formar enlaces de hidrógeno intermoleculares, que aún son más fuertes.

De particular interés para los biólogos (y prácticamente cualquier otra cosa que esté viva en el planeta) es el efecto de los enlaces de hidrógeno en el agua. Debido a que es capaz de formar redes estrechas de enlaces de hidrógeno intermoleculares, el agua permanece en fase líquida a temperaturas de hasta 100 O C a pesar de su pequeño tamaño. El mundo obviamente sería un lugar muy diferente si el agua hierve a los 30 O C.
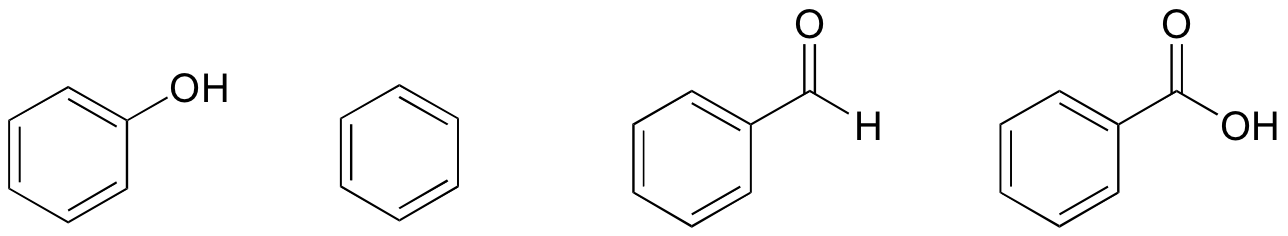
Con base en sus estructuras, clasifica el fenol, el benceno, el benzaldehído y el ácido benzoico en términos de menor a mayor punto de ebullición. Explica tu razonamiento.
Soluciones a los ejercicios
Al pensar en interacciones intermoleculares no covalentes, también podemos predecir puntos de fusión relativos. Se aplican todos los mismos principios: interacciones intermoleculares más fuertes dan como resultado un punto de fusión más alto. Los compuestos iónicos, como se esperaba, suelen tener puntos de fusión muy altos debido a la fuerza de las interacciones ión-ion. Al igual que con los puntos de ebullición, la presencia de grupos polares y de enlace de hidrógeno en los compuestos orgánicos generalmente conduce a puntos de fusión más altos. El tamaño de una molécula influye en su punto de fusión así como en su punto de ebullición, nuevamente debido al aumento de las interacciones de van der Waals entre las moléculas.
Lo diferente de las tendencias del punto de fusión, que no vemos con las tendencias de punto de ebullición o solubilidad, es la importancia de la forma de una molécula y su capacidad de empaquetar firmemente. Imagínate tratando de hacer un montón estable de pelones de beisbolo en el piso. Simplemente no funciona, porque las esferas no se empacan bien; hay muy poca área de contacto entre cada bola. Sin embargo, es muy fácil hacer una pila de objetos planos como libros.
El mismo concepto se aplica a qué tan bien se empaquetan las moléculas en un sólido. La forma plana de los compuestos aromáticos les permite empaquetarse de manera eficiente y, por lo tanto, los aromáticos tienden a tener puntos de fusión más altos en comparación con los hidrocarburos no planos con pesos moleculares similares. Al comparar los puntos de fusión del benceno y el tolueno, se puede ver que el grupo metilo adicional en el tolueno altera la capacidad de la molécula para empaquetarse fuertemente, disminuyendo así la fuerza acumulativa de las fuerzas intermoleculares de van der Waals y disminuyendo el punto de fusión.
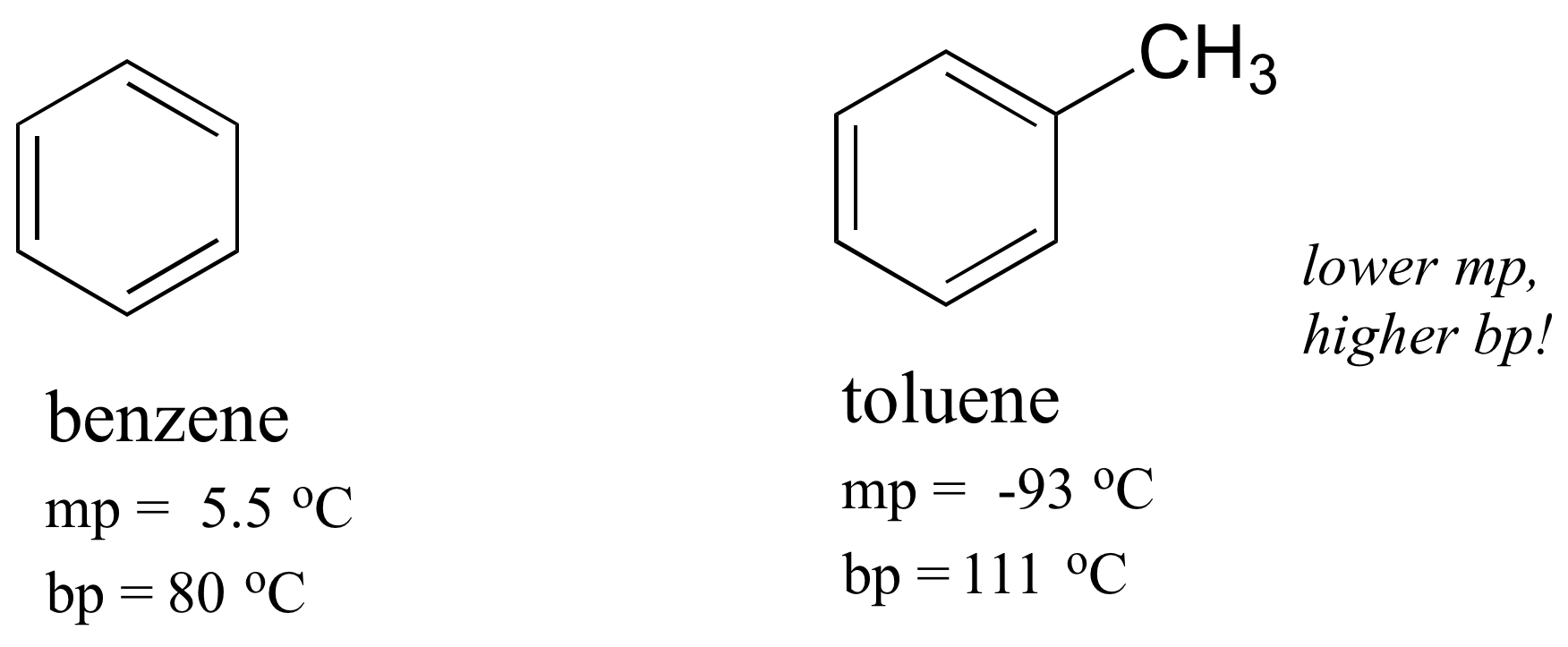
¡Tenga en cuenta también que el punto de ebullición para el tolueno está significativamente por encima del punto de ebullición del benceno! El factor clave para la tendencia del punto de ebullición en este caso es el tamaño (el tolueno tiene un carbono más), mientras que para la tendencia del punto de fusión, la forma juega un papel mucho más importante. Esto tiene sentido cuando se considera que la fusión implica 'desempaquetar' las moléculas de su matriz ordenada, mientras que hervir implica simplemente separarlas de su asociación ya suelta (líquida) entre sí.
Propiedades físicas de lípidos y proteínas
Lípidos
Un interesante ejemplo biológico de la relación entre la estructura molecular y el punto de fusión lo proporciona la diferencia física observable entre las grasas animales como la mantequilla o la manteca de cerdo, que son sólidas a temperatura ambiente, y los aceites vegetales, que son líquidos. Recordemos que las grasas y aceites son triacilgliceroles: ácidos grasos ligados a una columna vertebral de glicerol. En los aceites vegetales, los componentes de ácidos grasos son insaturados, lo que significa que contienen uno o más dobles enlaces. La grasa animal sólida, en contraste, contiene principalmente cadenas de hidrocarburos saturados, sin dobles enlaces.

Imagen 3D interactiva de un triacilglicerol saturado (BioTopics)
Ácidos grasos saturados vs monoinsaturados (BioTopics)
Los dobles enlaces en los aceites vegetales hacen que esas cadenas de hidrocarburos sean más rígidas y se “doblen” en ángulo (recuerde que la rotación está restringida alrededor de los dobles enlaces), con el resultado de que no se empaquetan tan estrechamente y, por lo tanto, se pueden romper (fundir) más fácilmente.
En un contexto relacionado, la fluidez de una membrana celular (esencialmente, el punto de fusión) está determinada en gran medida por la longitud y el grado de insaturación de las 'colas' de ácidos grasos en los lípidos de la membrana. Los ácidos grasos más largos y saturados hacen que la membrana sea menos fluida (son capaces de maximizar las interacciones de van der Waals), mientras que los ácidos grasos más cortos e insaturados hacen que la membrana sea más fluida.
Proteínas
Las mismas fuerzas no covalentes de las que acabamos de aprender también son parte integral de la estructura de la proteína: cuando una proteína se pliega, lo hace de tal manera que se forman interacciones no covalentes muy específicas entre los residuos de aminoácidos en diferentes regiones de la cadena, cada uno convirtiéndose en parte del 'pegamento molecular' que mantiene la cadena unida en su forma correctamente plegada. Los enlaces de hidrógeno y las interacciones carga-carga son particularmente importantes a este respecto. En general, el interior de una proteína plegada es relativamente hidrofóbico, mientras que la superficie exterior, que por supuesto está en contacto constante con el agua, es muy hidrófila -muchas cadenas laterales cargadas como aspartato, glutamato, lisina y arginina señalan fuera de la superficie de una estructura proteica.
La mayoría de las proteínas de los organismos 'mesófilos' (aquellos que prosperan en temperaturas intermedias, incluidos los humanos) se desnaturalizarán -vendrán desplegadas- a altas temperaturas, ya que el calor interrumpe las interacciones no covalentes específicas que mantienen unida la cadena proteica. Las proteínas desplegadas generalmente no son solubles en agua debido a que las regiones interiores más hidrófobas ya no están ocultas del disolvente, por lo que la desnaturalización va acompañada de precipitación. Obviamente, una proteína desplegada también pierde su funcionalidad.
En las últimas décadas, nos hemos dado cuenta de que una amplia variedad de microbios habitan de forma natural en ambientes extremadamente calurosos como el agua hirviendo de las aguas termales en el Parque Nacional Yellowstone, o la base de un respiradero térmico de aguas profundas. ¿Cómo aguantan las proteínas de estos 'termófilos' al calor? No hay nada extraordinario en estas proteínas que las haga tan resistentes al calor, aparte del hecho de que han evolucionado de manera que simplemente tienen más 'pegamento' molecular que las mantiene unidas -en particular, interacciones más iónicas entre residuos con carga opuesta. En solo uno de los muchos ejemplos, se comparó la estructura tridimensional de una enzima de Pyrococcus horikoshii, un microbio aislado de un respiradero térmico profundo en el Océano Pacífico, con una enzima muy similar en humanos. La proteína termófila tiene una interacción carga-carga estabilizante entre el grupo carboxilato terminal en el último aminoácido de la cadena y un residuo de arginina cerca del comienzo de la cadena.
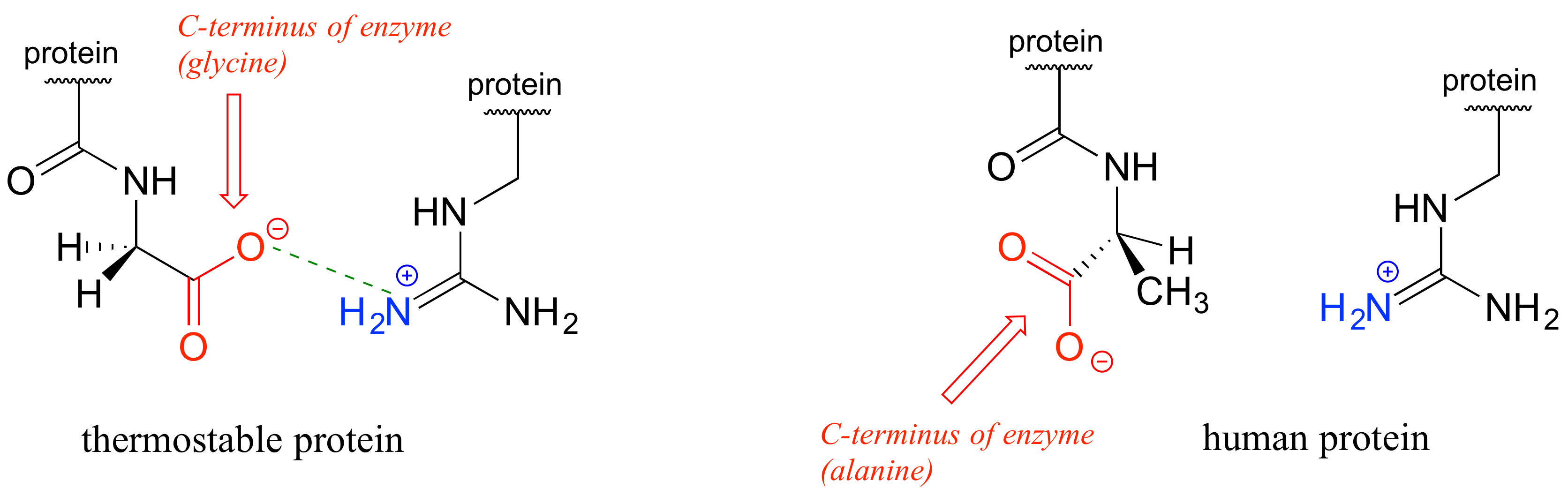
Esta interacción no está presente en la versión humana de la proteína debido a que el grupo carboxilato terminal está en ángulo lejos del grupo cargado positivamente en la arginina. La interacción carga-carga única no es por sí misma responsable de la termoestabilidad de la proteína P. horikoshii - otras interacciones similares a lo largo de la estructura de la proteína también contribuyen (ver el reporte original en PLOS Biology 2011, 9, e 1001027).
Por el contrario, las proteínas de organismos 'psicrófilos' -aquellos que viven en temperaturas extremadamente frías, como en suelos árticos o en pequeñas bolsas de agua en hielo polar- tienen menos interacciones estabilizantes carga-carga. Esto les da la flexibilidad para funcionar a temperaturas en las que las proteínas mesófilas humanas o de E. coli estarían congeladas e inactivas. Por otro lado, una proteína psicrófila típica se desplegará rápidamente, precipitará y perderá su funcionalidad a temperatura ambiente.
Los científicos están sumamente interesados en las proteínas termoestables, ya que la capacidad de funcionar a altas temperaturas puede ser un rasgo muy deseable para una proteína utilizada en procesos industriales. De hecho, la ADN polimerasa termoestable de Thermus aquaticus (la enzima es conocida por los biólogos moleculares como 'polimerasa Taq') es la enzima que hace posible el proceso de PCR (reacción en cadena de la polimerasa), y ha ganado miles de millones de dólares en regalías para la compañía farmacéutica Hoffman La Roche , el titular de la patente. Muchos grupos de investigación están buscando enzimas útiles en especies termófilas, y otros están trabajando en formas de diseñar la estabilidad térmica en las enzimas mesófilas existentes jugando con sus secuencias de aminoácidos para introducir nuevas interacciones estabilizantes carga-carga.
Tutoriales en video de Khan Academy sobre solubilidad, punto de ebullición


