3.4: Quiralidad y estereoisómeros
- Page ID
- 72592
Pasamos ahora al concepto de quiralidad que formó la base de la historia sobre Louis Pasteur al inicio de este capítulo. Recordemos que el término quiral, de la obra griega para 'mano', se refiere a cualquier cosa que no pueda superponerse sobre su propia imagen especular. Tus manos, por supuesto, son quirales - no puedes superponer tu mano izquierda a tu derecha, y no puedes meter tu mano izquierda en un guante diestro (que también es un objeto quiral). Otra forma de decir esto es que tus manos no tienen un plano de simetría especular: no puedes encontrar ningún plano que bisecta tu mano de tal manera que un lado del plano sea una imagen especular del otro lado. Los objetos quirales no tienen un plano de simetría.
Tu rostro, por otro lado es aquiral -carente de quiralidad- porque, a pesar de algunas pequeñas desviaciones, podrías superponer tu rostro sobre su imagen especular. Si alguien te mostrara una fotografía de imagen especular de tu cara, podrías alinear la imagen, punto por punto, con tu cara real. Tu cara tiene un plano de simetría, porque el lado izquierdo es la imagen especular del lado derecho.
Lo que Pasteur, Biot y sus contemporáneos aún no entendieron completamente cuando Pasteur hizo su descubrimiento de la quiralidad molecular fue la fuente de la quiralidad a nivel molecular. Era lógico pensar que una molécula quiral es aquella que no contiene un plano de simetría, y por lo tanto no puede superponerse a su imagen especular. Ahora sabemos que las moléculas quirales contienen uno o más centros quirales, que casi siempre son carbonos tetraédricos (sp 3 -hibridados) con cuatro sustituyentes diferentes. Considera la molécula de caricatura A a continuación: un carbono tetraédrico, con cuatro sustituyentes diferentes denotados por bolas de cuatro colores diferentes (por el momento, no te preocupes por cuáles podrían ser exactamente estos sustituyentes -veremos ejemplos reales muy pronto).
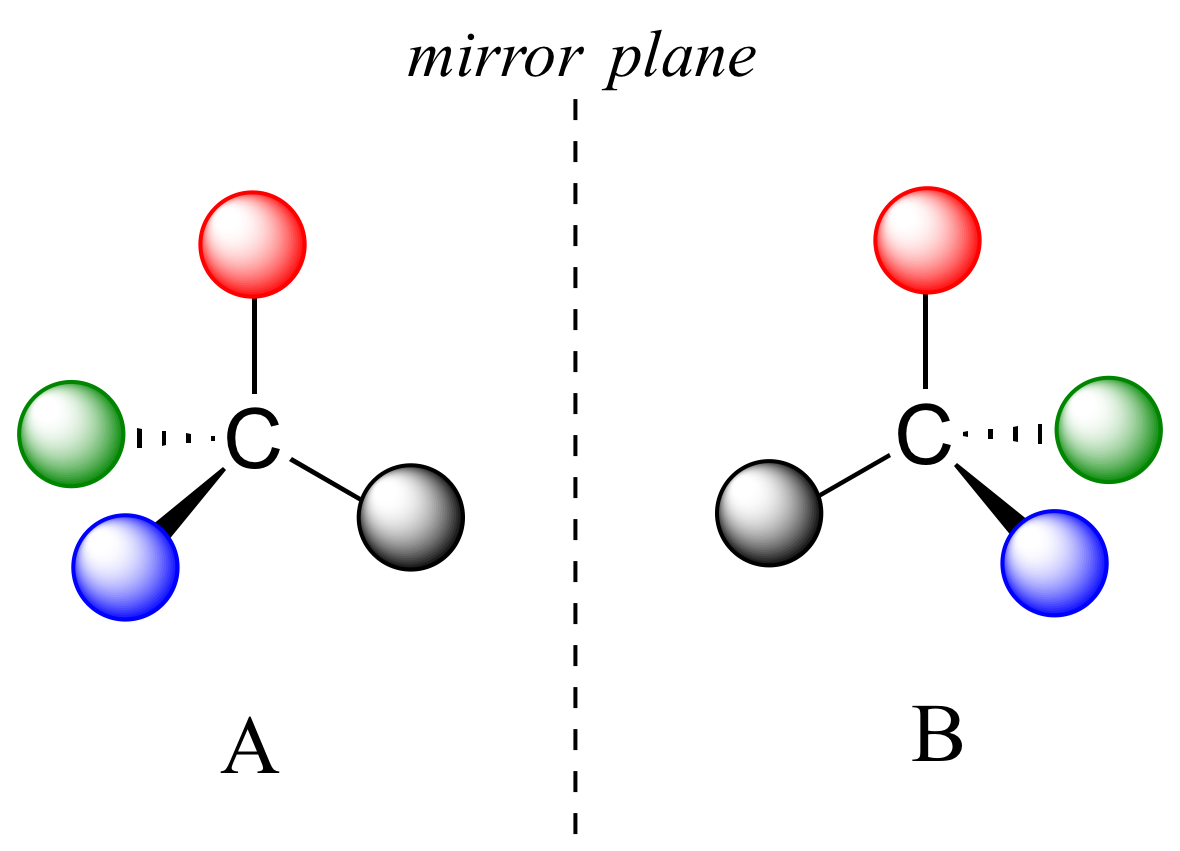
La imagen especular de A, que llamaremos B, se dibuja en el lado derecho de la figura, y un espejo imaginario está en el medio. Observe que cada punto de A se alinea a través del espejo con el mismo punto en B: en otras palabras, si A se mirara en el espejo, vería a B mirando hacia atrás.
Ahora bien, si volteamos el compuesto A y tratamos de superponerlo punto por punto sobre el compuesto B, encontramos que no podemos hacerlo: si superponemos bolas cualesquiera de dos colores, entonces las otras dos están desalineadas.
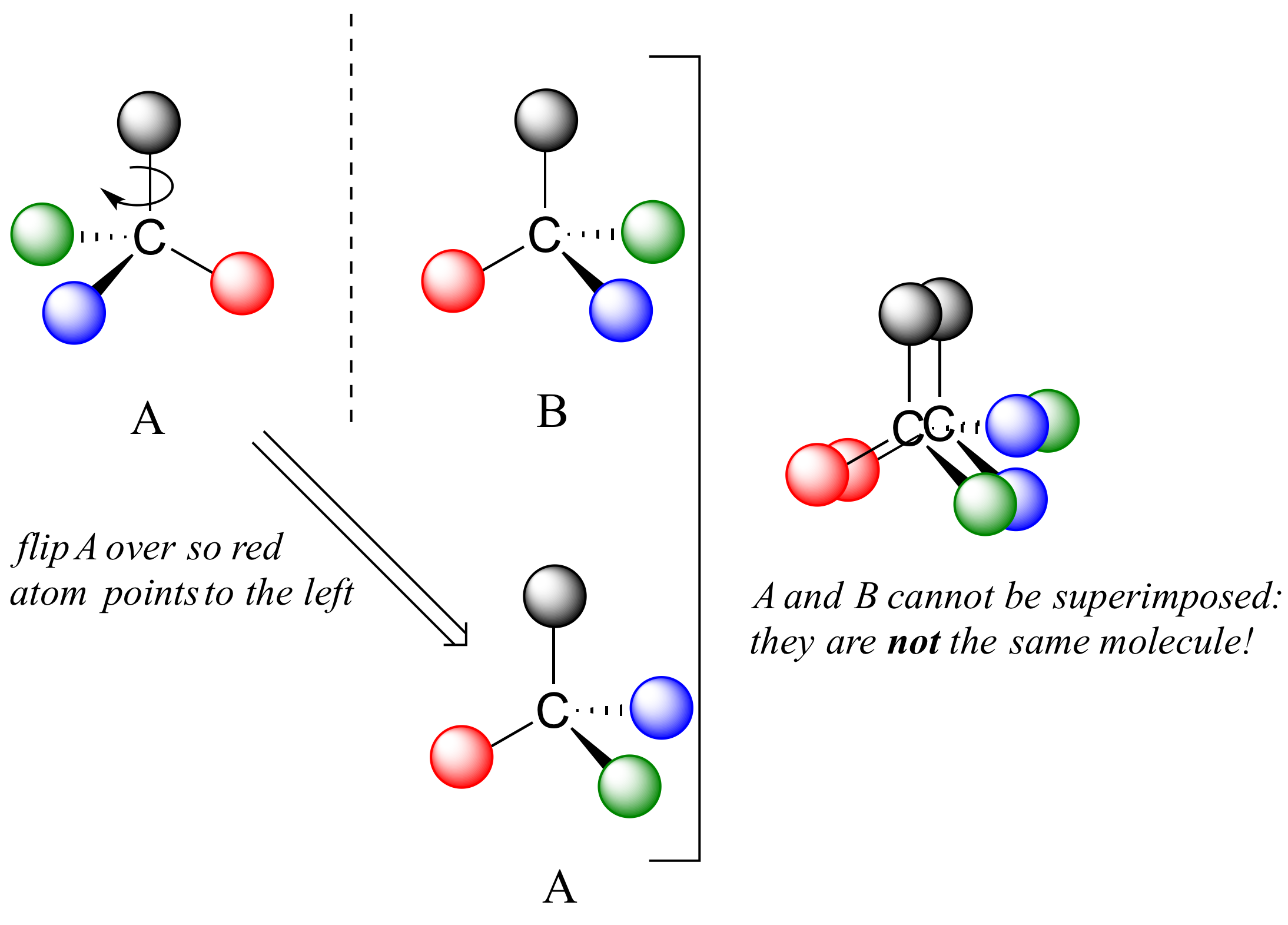
A no es superponible sobre su imagen especular (B), así por definición A es una molécula quiral. De ello se deduce que B tampoco es superponible sobre su imagen especular (A), y así también es una molécula quiral. También observe en la figura a continuación (y convencerse con modelos) que ni A ni B tienen un plano interno de simetría.
A y B son estereoisómeros: moléculas con la misma fórmula molecular y la misma disposición de enlaces, pero una disposición diferente de átomos en el espacio. Existen dos tipos de estereoisómeros: enantiómeros y diastereómeros. Los enantiómeros son pares de estereoisómeros que son imágenes especulares entre sí: así, A y B son enantiómeros. Debe ser evidente que una molécula quiral siempre tendrá un (y solo uno) enantiómero: los enantiómeros vienen en pares. Los enantiómeros tienen propiedades físicas idénticas (punto de fusión, punto de ebullición, densidad, etc.). Sin embargo, los enantiómeros sí difieren en la forma en que interactúan con la luz polarizada (pronto aprenderemos más sobre esto) y también pueden interactuar de maneras muy diferentes con otras moléculas quirales -proteínas, por ejemplo. Comenzaremos a explorar esta última idea más adelante en este capítulo, y veremos muchos ejemplos a lo largo del resto de nuestro estudio de la química orgánica biológica.
Los diastereómeros son estereoisómeros que no son imágenes especulares entre sí. Por ahora, nos concentraremos en entender los enantiómeros, y luego volveremos a los diastereómeros.
Definimos un centro quiral como un carbono tetraédrico con cuatro sustituyentes diferentes. Si, en cambio, un carbono tetraédrico tiene dos sustituyentes idénticos (dos átomos negros en la figura de dibujos animados de abajo), entonces por supuesto todavía tiene una imagen especular (¡todo tiene una imagen especular, a menos que estemos hablando de un vampiro!) Sin embargo, es superponible sobre su imagen especular, y tiene un plano de simetría.
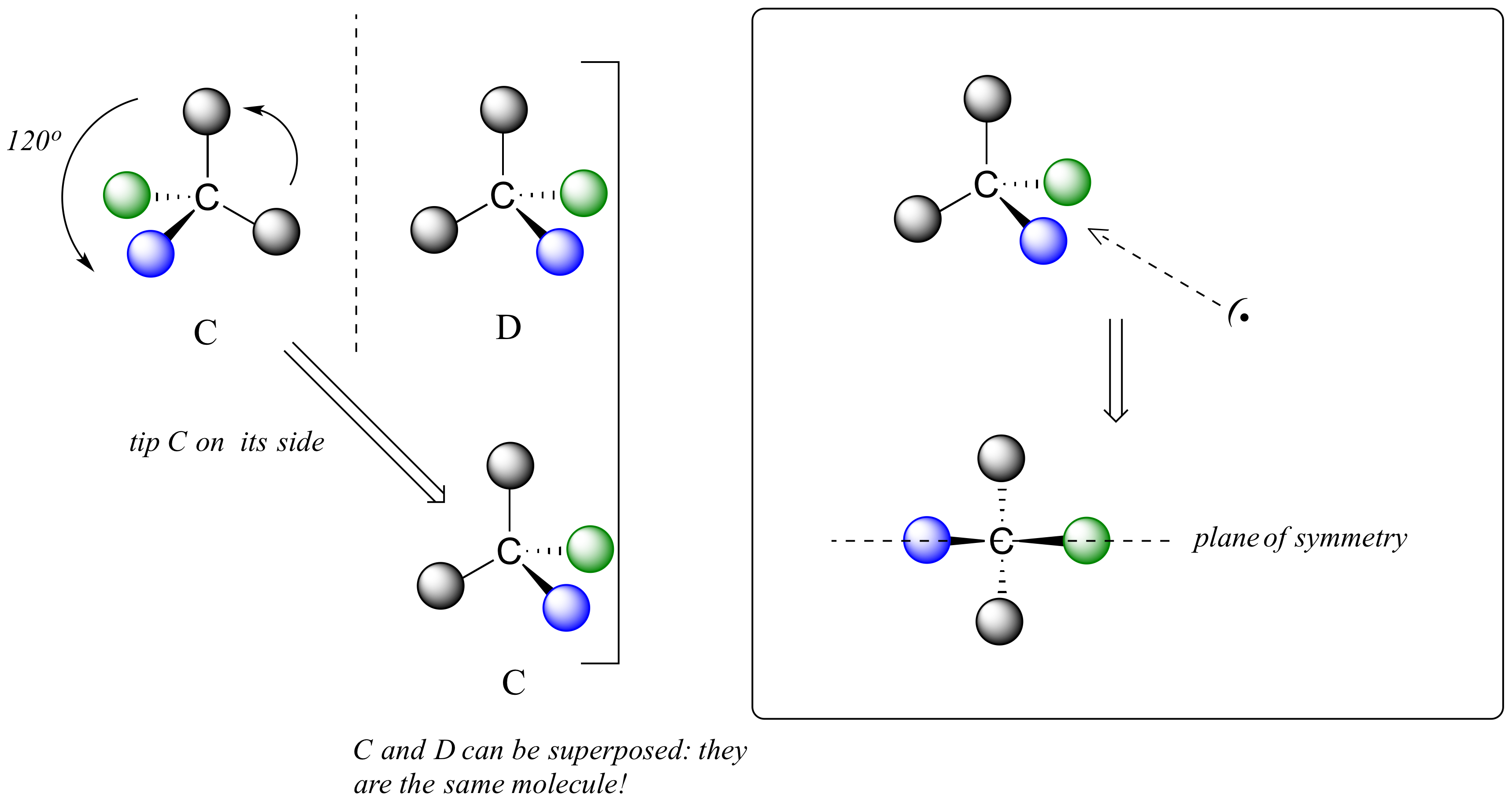
Esta molécula es aquiral (carente de quiralidad). Usando el mismo razonamiento, podemos ver que un carbono plano trigonal (sp 2 -hibridado) tampoco es un centro quiral.
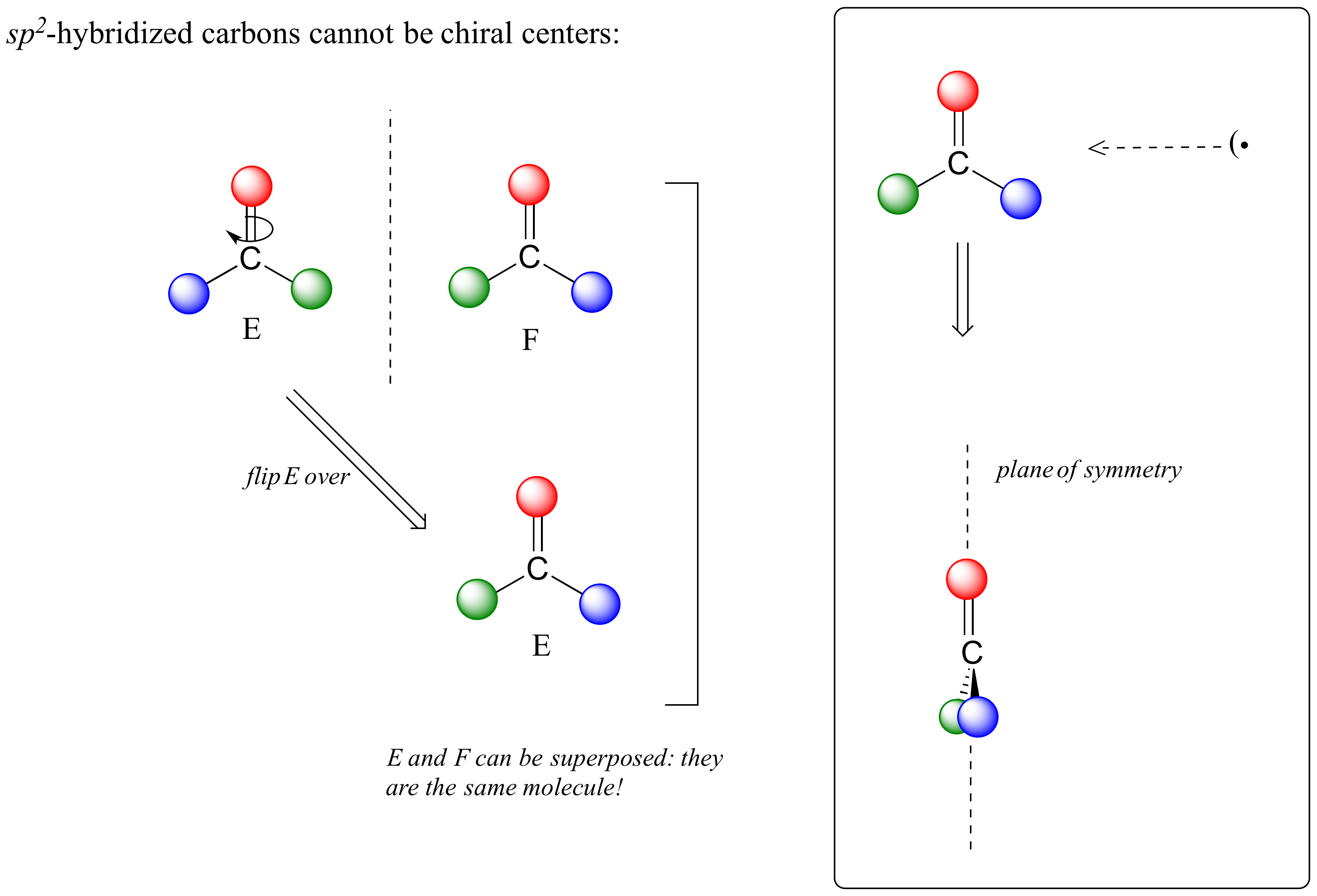
Observe que la estructura E puede superponerse a F, su imagen especular - todo lo que tienes que hacer es recoger E, darle la vuelta, y es lo mismo que F. Esta molécula tiene un plano de simetría, y es aquiral.
Apliquemos nuestra discusión general a moléculas reales. Por ahora, limitaremos nuestra discusión a moléculas con un solo centro quiral. Resulta que el ácido tartárico, tema de nuestra introducción capitular, tiene dos centros quirales, por lo que volveremos a él más adelante.
Considera el 2-butanol, dibujado en dos dimensiones a continuación.
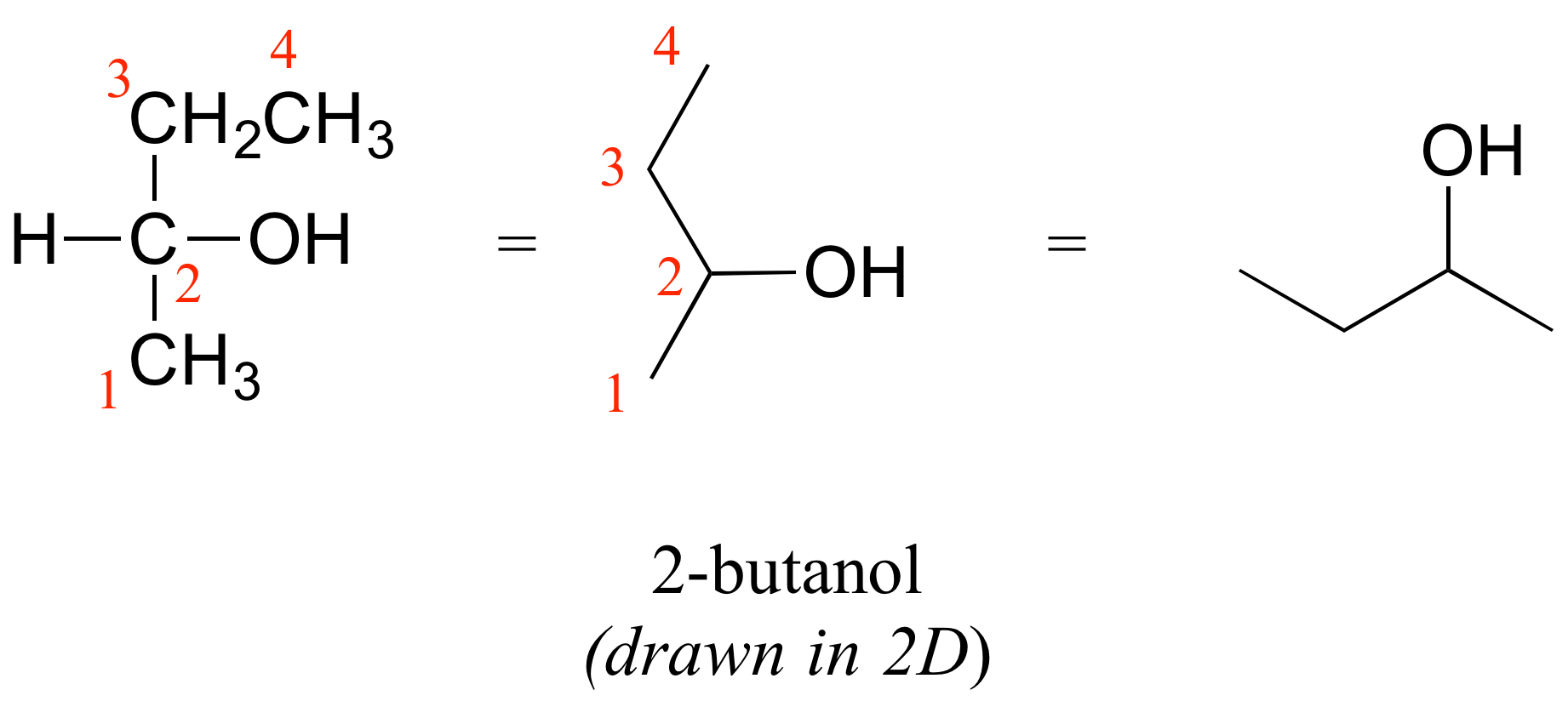
El carbono #2 es un centro quiral: es sp 3 -hibridado y tetraédrico (aunque no esté dibujado de esa manera arriba), y las cuatro cosas a las que se unen son diferentes: un hidrógeno, un grupo metilo (-CH 3), un grupo etilo (-CH 2 CH 3) y un hidroxilo (OH) grupo. Dibujemos la unión en C 2 en tres dimensiones, y llamemos a esta estructura A. También dibujaremos la imagen especular de A, y llamaremos a esta estructura B.
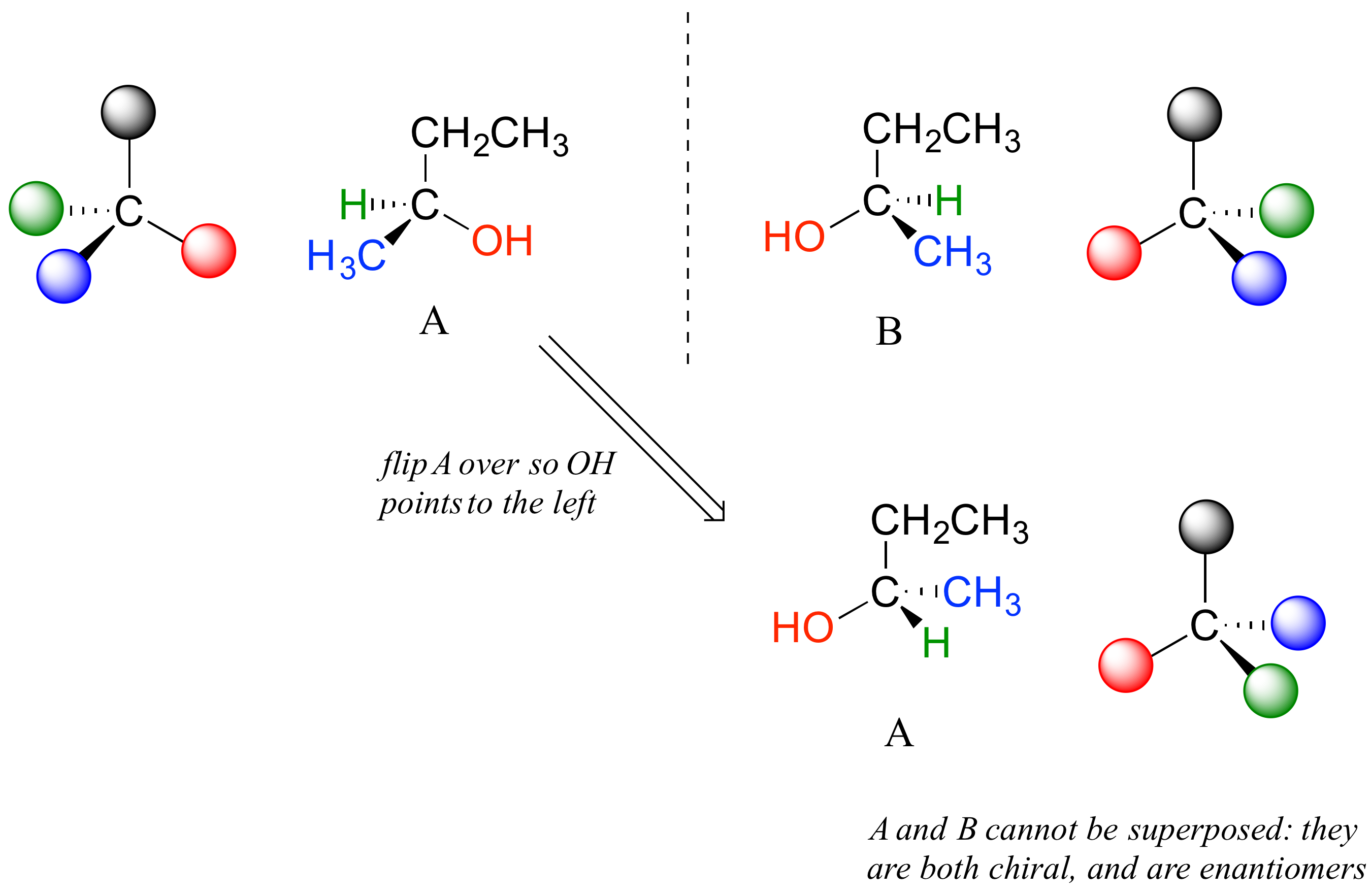
Cuando tratamos de superponer A sobre B, encontramos que no podemos hacerlo. A y B son ambas moléculas quirales, y son enantiómeros entre sí.
El 2-propanol, a diferencia del 2-butanol, no es una molécula quiral. El carbono #2 está unido a dos sustituyentes idénticos (grupos metilo), por lo que no es un centro quiral.
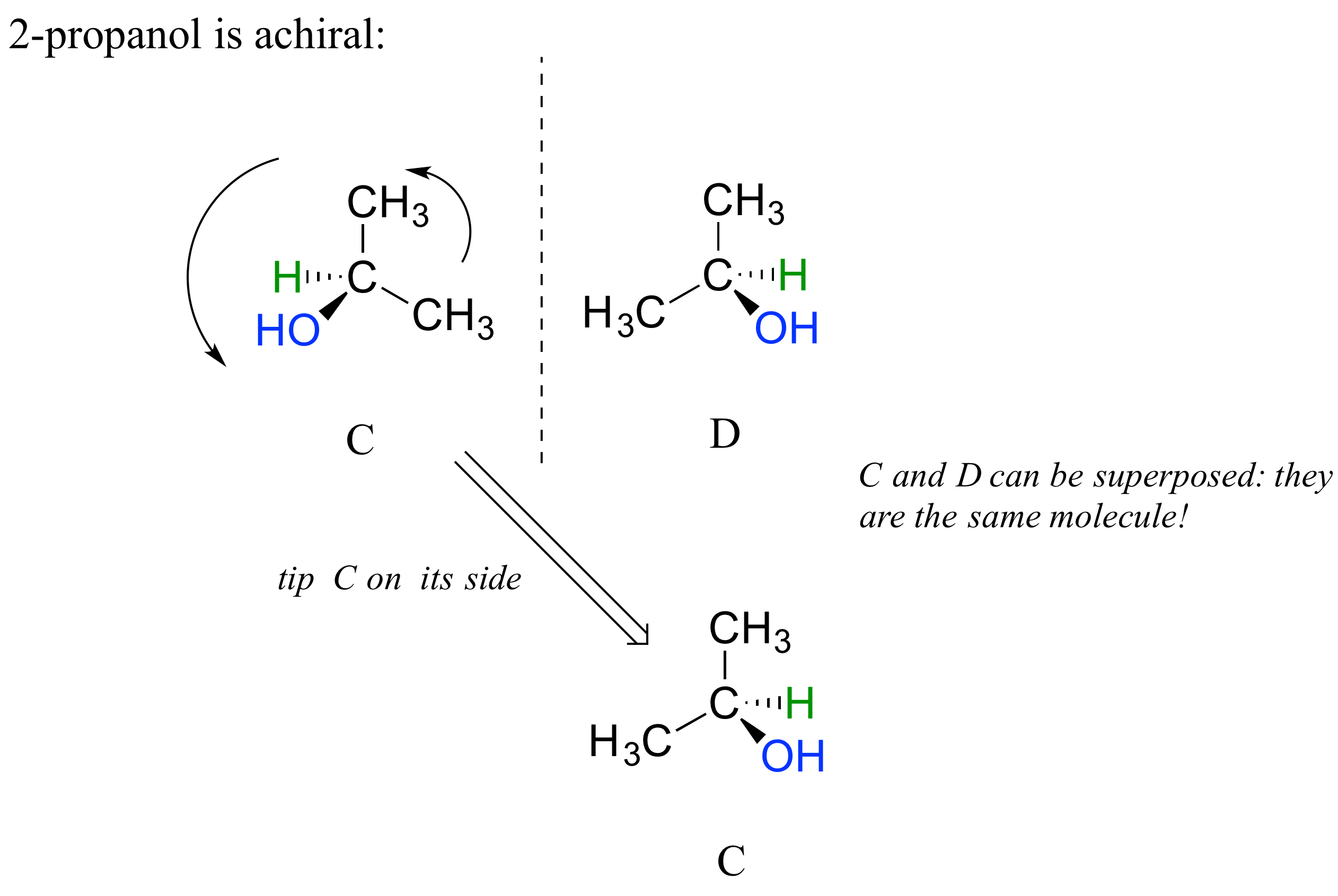
Observe que el 2-propanol es superponible en su propia imagen especular.
Cuando miramos moléculas muy simples como el 2-butanol, no es difícil sacar la imagen especular y reconocer que no es superponible. Sin embargo, con moléculas más grandes y complejas, esto puede ser un desafío desalentador en términos de dibujo y visualización tridimensional. La manera fácil de determinar si una molécula es quiral es simplemente buscar la presencia de uno o más centros quirales: las moléculas con centros quirales serán (casi siempre) quirales. Insertamos aquí la advertencia 'casi siempre' porque es posible llegar a la excepción a esta regla -tendremos más que decir sobre esto más adelante, pero no te preocupes por ello por ahora.
Aquí hay otro truco para facilitarte tu vida estereoquímica: si quieres dibujar el enantiómero de una molécula quiral, no es necesario que te tomes la molestia de dibujar la imagen espejo punto por punto, como lo hemos hecho hasta ahora con fines de ilustración. En cambio, mantenga el esqueleto de carbono igual, y simplemente invierta los enlaces de cuña sólidos y discontinuas en el carbono quiral: eso logra lo mismo. Debes usar modelos para convencerte de que esto es cierto, y también para convencerte de que el intercambio de dos sustituyentes cualesquiera sobre el carbono quiral dará como resultado la formación del enantiómero.
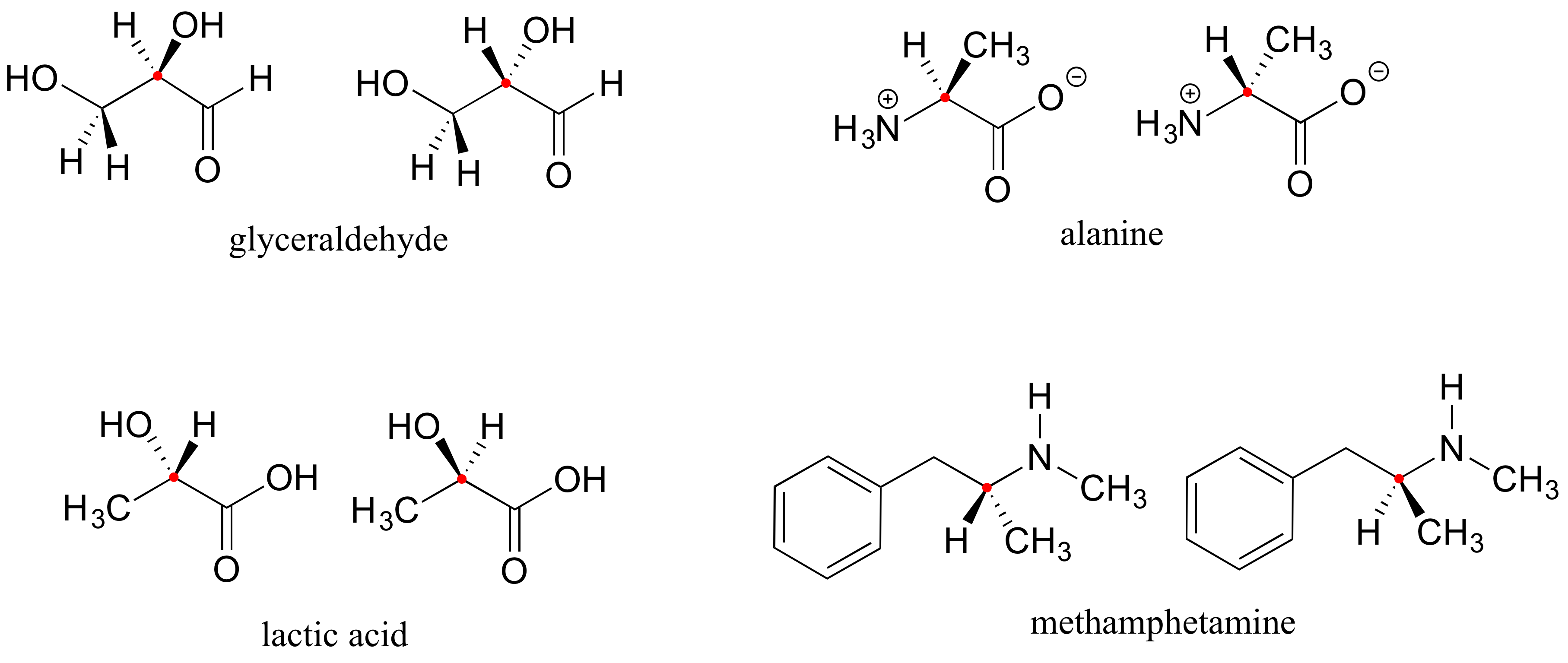
Aquí hay cuatro ejemplos más de biomoléculas quirales, cada una mostrada como un par de enantiómeros, con centros quirales marcados por puntos rojos.
Aquí hay algunos ejemplos de biomoléculas aquirales: convénzate de que ninguna de ellas contiene un centro quiral:
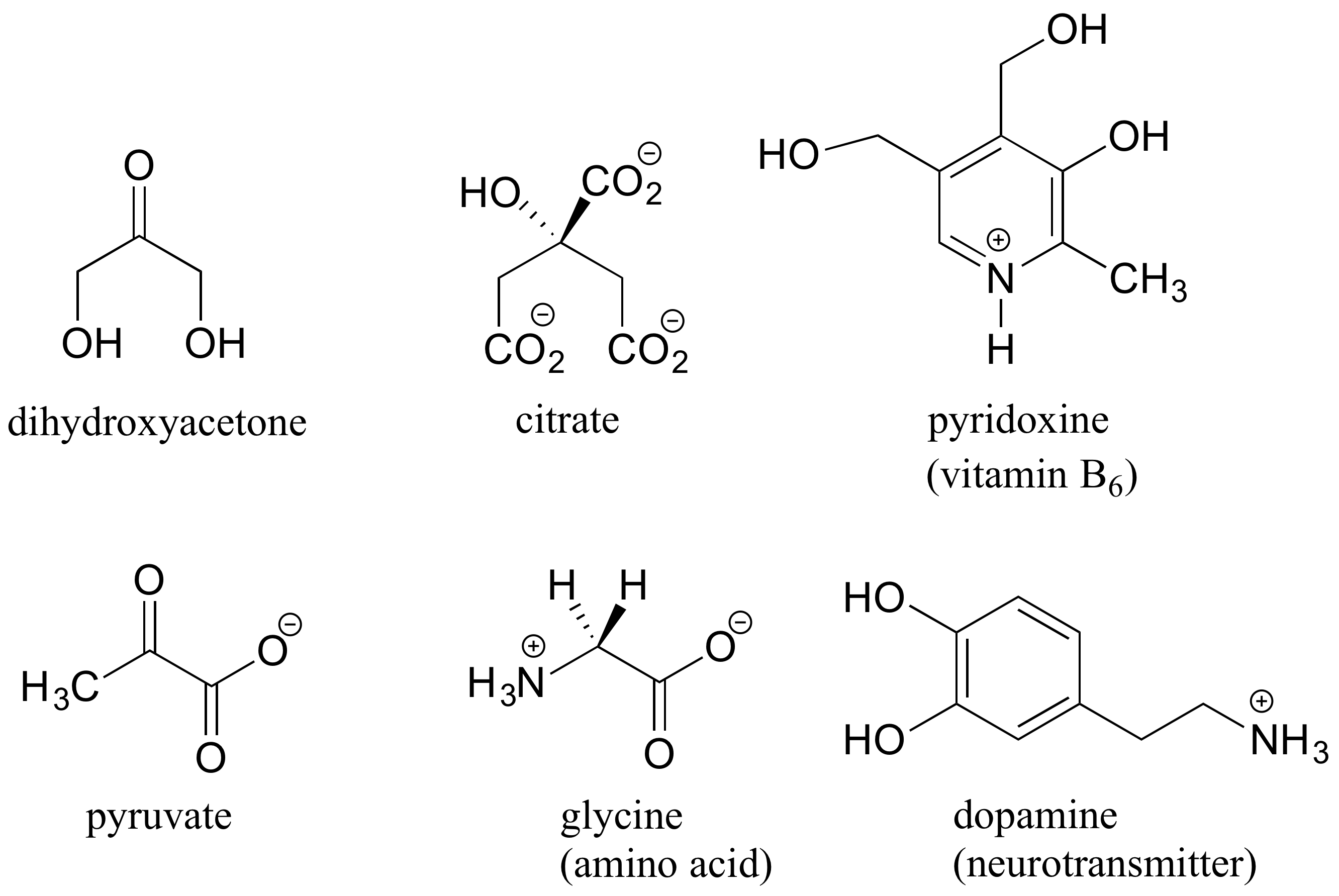
Al buscar centros quirales, es importante reconocer que la cuestión de si se utiliza o no la convención de dibujo de cuña rayada/sólida es irrelevante. Las moléculas quirales a veces se dibujan sin usar cuñas (aunque obviamente esto significa que se está omitiendo la información estereoquímica). Por el contrario, las cuñas se pueden utilizar en carbonos que no son centros quirales — miren, por ejemplo, los dibujos de glicina y citrato en la figura anterior.
¿Puede un centro quiral ser algo más que un carbono tetraédrico con cuatro sustituyentes diferentes? La respuesta a esta pregunta es 'sí'; sin embargo, estos centros quirales alternativos son muy raros en el contexto de la química orgánica biológica, y fuera del alcance de nuestra discusión aquí.
También te habrás preguntado sobre las aminas: ¿no deberíamos considerar que una amina secundaria o terciaria es un centro quiral, ya que son tetraédricas y están unidas a cuatro sustituyentes diferentes, si los electrones de par solitario se cuentan como un 'sustituyente'? Dicho de otra manera, ¿no es una amina no superponible en su imagen especular?
La respuesta: sí lo es, en el cuadro estático, pero en realidad, el nitrógeno de una amina se está invirtiendo rápida y reversiblemente, o volteando del revés, a temperatura ambiente.

Si tienes problemas para imaginarlo, toma una pelota de tenis vieja y córtala por la mitad. Entonces, toma una de las mitades cóncavas y dale la vuelta al revés, luego de nuevo: esto es lo que está haciendo la amina. El resultado final es que los dos 'enantiómeros' si la amina son en realidad dos formas de rápida interconversión de la misma molécula, y así la amina en sí no es un centro quiral. Este proceso de inversión no tiene lugar sobre un carbono tetraédrico, que por supuesto no tiene electrones de par solitario.
Localizar todos los centros quirales (puede haber más de uno en una molécula). Recuerde, los átomos de hidrógeno unidos al carbono generalmente no se dibujan en la convención de estructura lineal, ¡pero todavía están ahí!
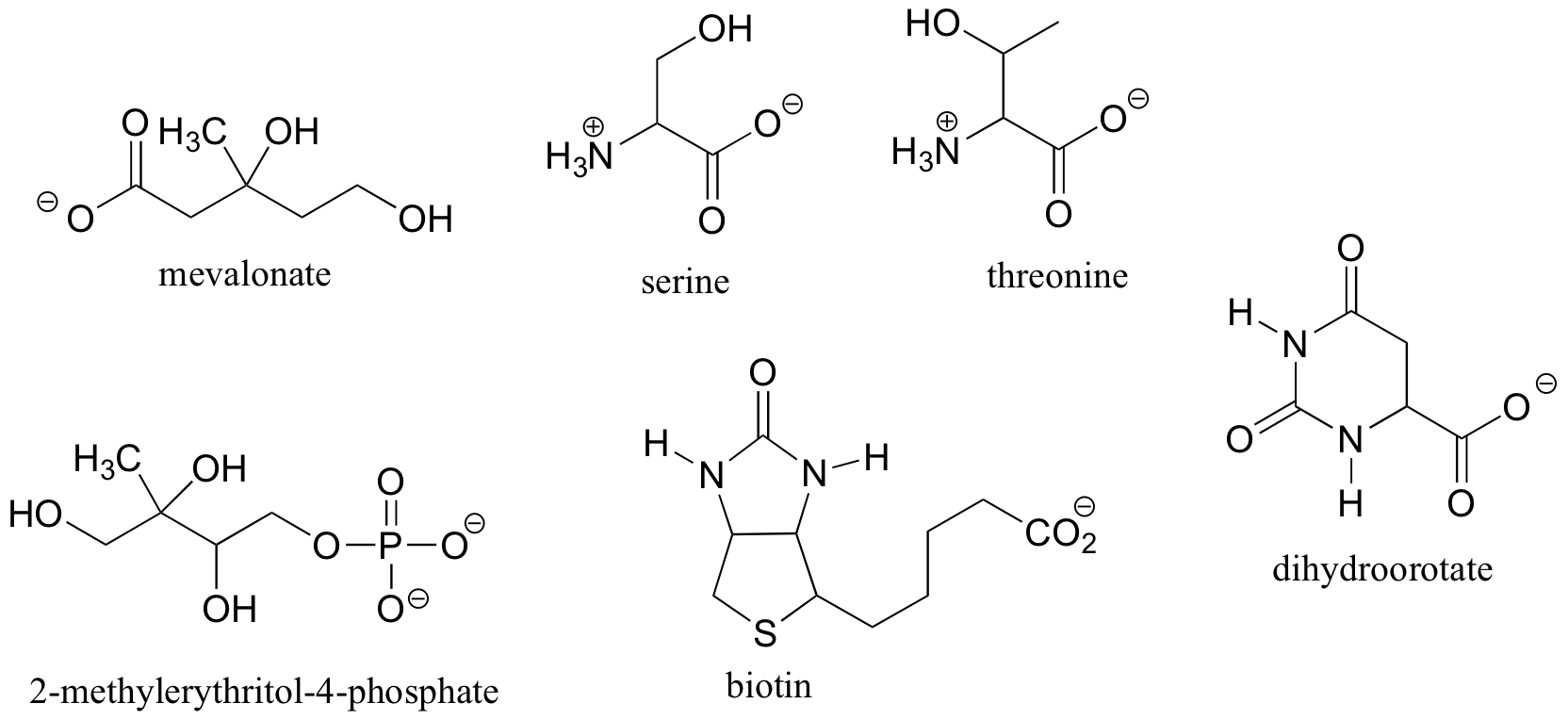
Ejercicio 3.9
a) Dibujar dos enantiómeros de i) mevalonato y ii) serina.
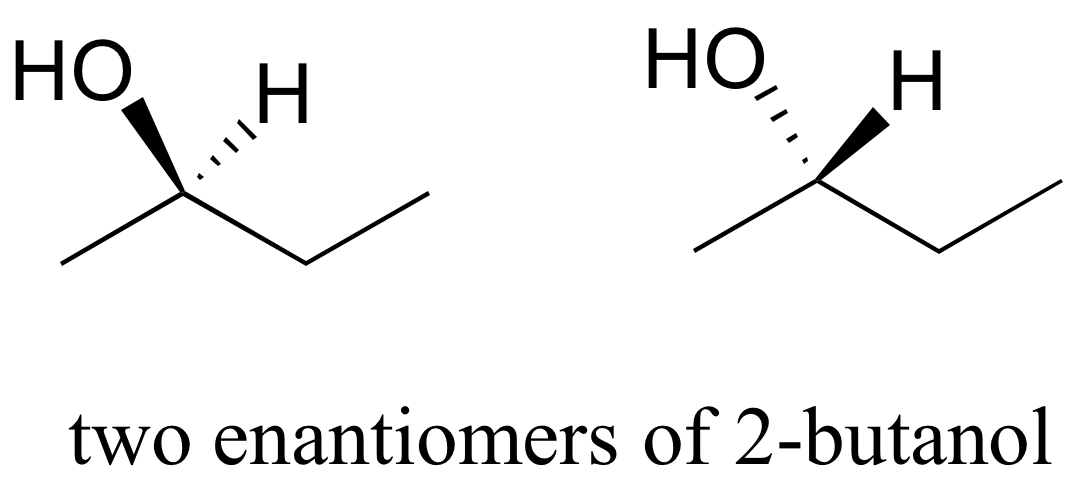
b) ¿Las dos estructuras de 2-butanol están por debajo de los enantiómeros?

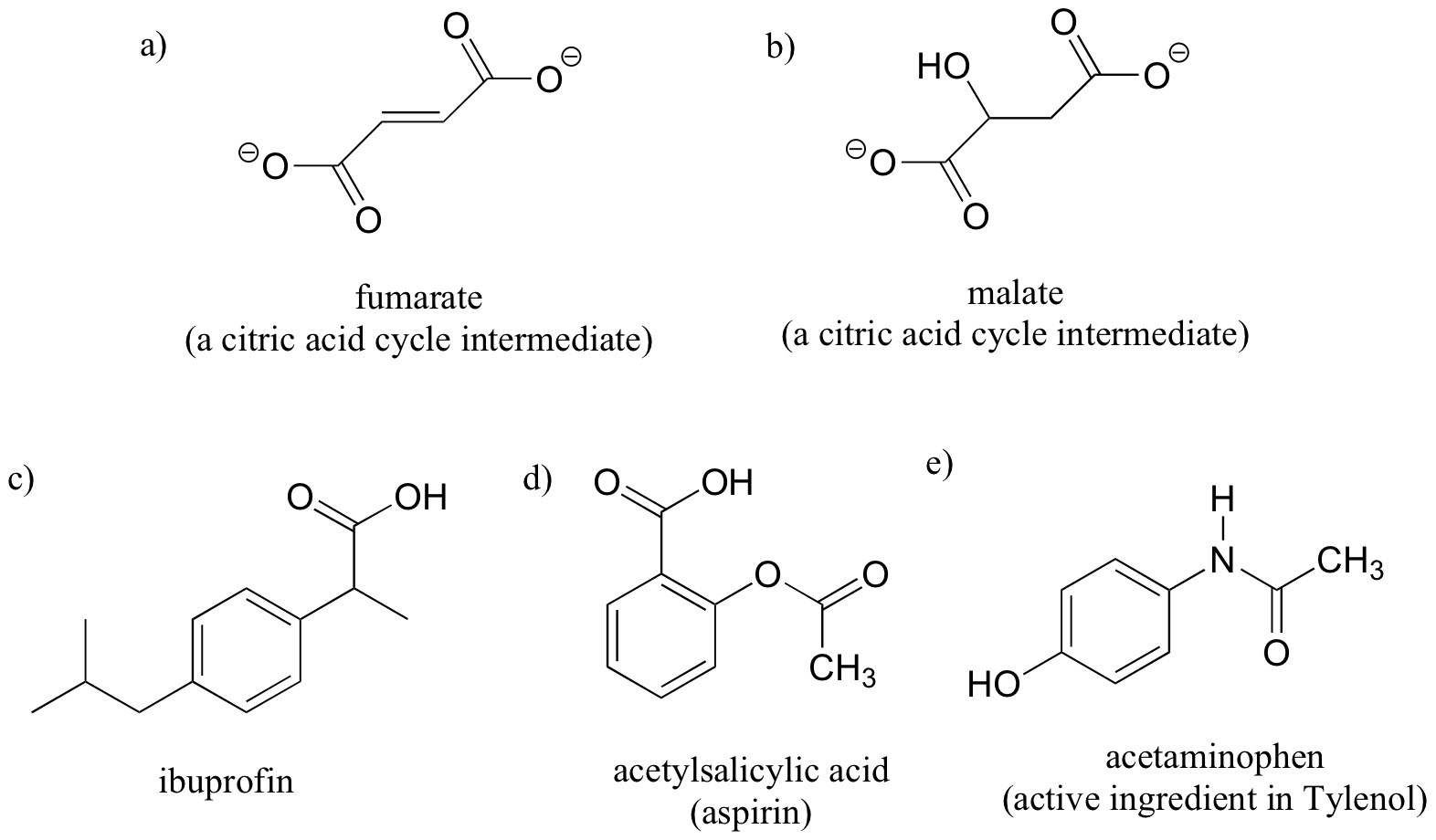
Ejercicio 3.10
Marque las moléculas siguientes como quirales o aquirales, y localice todos los centros quirales.
Soluciones a los ejercicios
Tutoriales en video de Khan Academy


