3.5: Nombrar centros quirales- el sistema R y S
- Page ID
- 72548
Los químicos necesitan una manera conveniente de distinguir un estereoisómero de otro. El sistema Cahn-Ingold Prelog es un conjunto de reglas que nos permite definir sin ambigüedades la configuración estereoquímica de cualquier estereocentro, utilizando las designaciones 'R' (del latín recto, que significa diestro) o 'S' (de el latín siniestro, que significa zurdo).
Las reglas para este sistema de nomenclatura estereoquímica son, en la superficie, bastante simples.
1: Asignar prioridades a los cuatro sustituyentes, siendo #1 la prioridad más alta y #4 la más baja. Las prioridades se basan en el número atómico.
2: Traza un círculo de #1 a #2 a #3.
3: Determinar la orientación del grupo prioritario #4. Si está orientado al plano de la página (lejos de usted), vaya al paso 4a. Si está orientado fuera del plano de la página (hacia usted) vaya al paso 4b.
4a: (grupo #4 apuntando lejos de ti): un círculo en sentido horario en la parte 2 corresponde a la configuración R, mientras que un círculo en sentido contrario a las agujas del reloj corresponde a la configuración S.
4b: (grupo #4 apuntando hacia usted): un círculo en sentido horario en la parte 2 corresponde a la configuración S, mientras que un círculo en sentido contrario a las agujas del reloj corresponde a la configuración R.
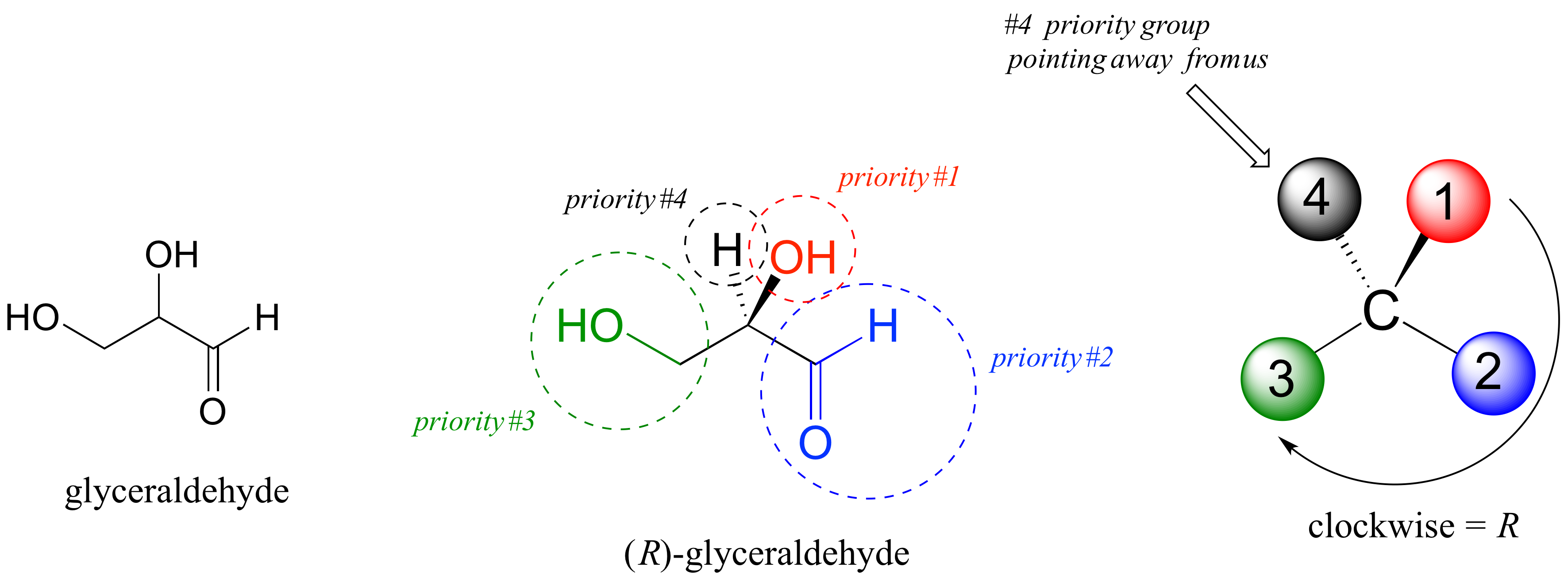
Usaremos el gliceraldehído de azúcar de 3 carbonos como nuestro primer ejemplo. Lo primero que debemos hacer es asignar una prioridad a cada uno de los cuatro sustituyentes unidos al centro quiral. Primero observamos los átomos que están unidos directamente al centro quiral: estos son H, O (en el hidroxilo), C (en el aldehído) y C (en el grupo CH 2 OH).
Dos prioridades son fáciles: el hidrógeno, con un número atómico de 1, es la prioridad más baja (#4), y el oxígeno hidroxilo, con número atómico 8, es la prioridad #1. El carbono tiene un número atómico de 6. ¿Cuál de los dos grupos 'C' es la prioridad #2, el aldehído o el CH 2 OH? Para determinar esto, alejamos un enlace más del centro quiral: para el aldehído tenemos un doble enlace a un oxígeno, mientras que en el grupo CH 2 OH tenemos un enlace sencillo a un oxígeno. Si el átomo es el mismo, los dobles enlaces tienen mayor prioridad que los enlaces simples. Por lo tanto, al grupo aldehído se le asigna prioridad #2 y al grupo CH 2 OH la prioridad #3.
Con nuestras prioridades asignadas, miramos a continuación al grupo prioritario #4 (el hidrógeno) y vemos que se apunta hacia atrás lejos de nosotros, al plano de la página - así se aplica el paso 4a del procedimiento anterior. Luego, trazamos un círculo definido por los grupos prioritarios #1, #2 y #3, en orden creciente. El círculo es en el sentido de las agujas del reloj, lo que mediante el paso 4a nos dice que este carbono tiene la configuración 'R', y que esta molécula es (R) -gliceraldehído. Su enantiómero, por definición, debe ser (S) -gliceraldehído.
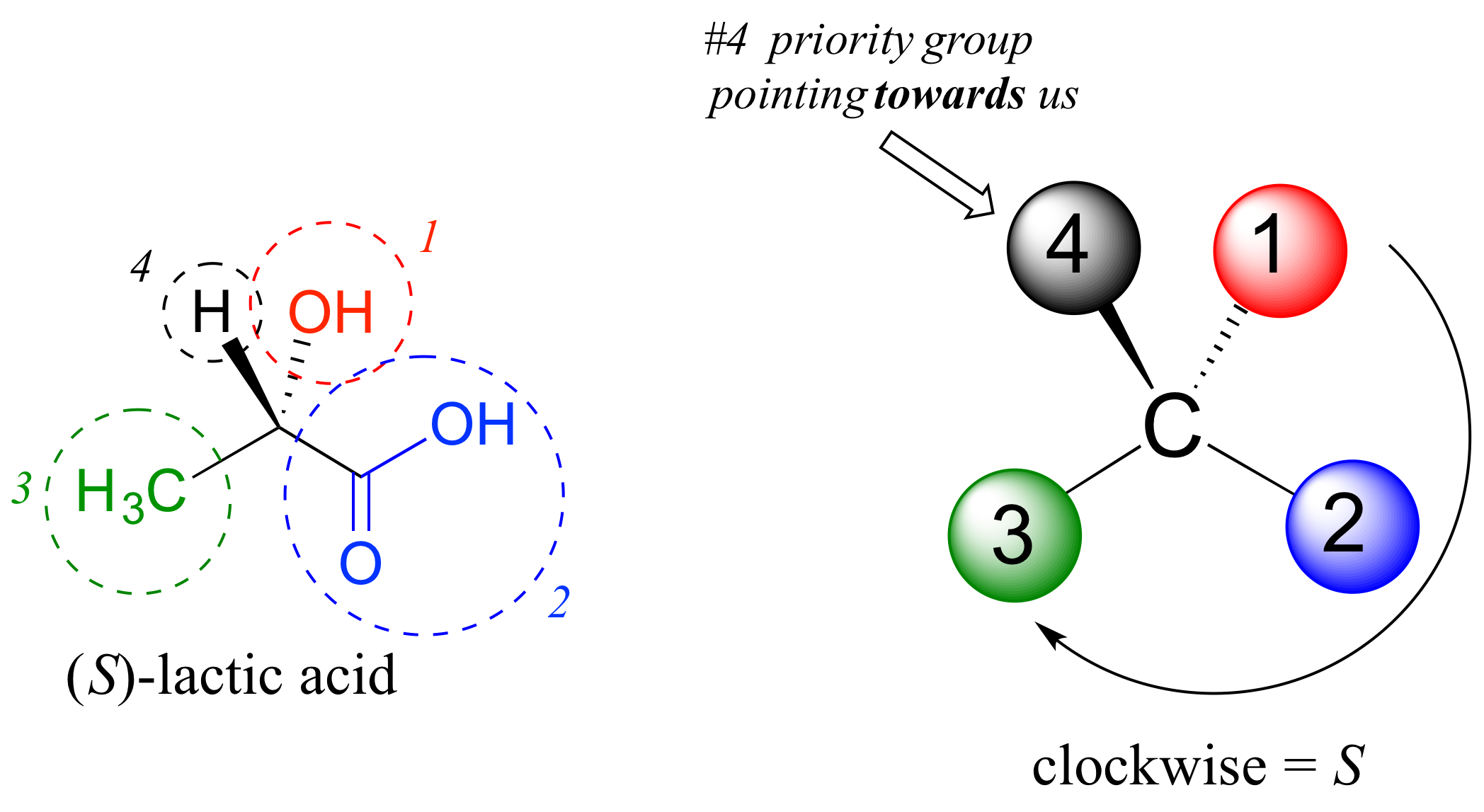
A continuación, veamos uno de los enantiómeros del ácido láctico y determinemos la configuración del centro quiral. Claramente, H es el sustituyente #4 y OH es #1. Debido a sus tres enlaces al oxígeno, el carbono en el grupo ácido tiene prioridad #2, y el grupo metilo toma #3. El grupo #4, hidrógeno, pasa a ser dibujado apuntando hacia nosotros (fuera del plano de la página) en esta figura, así que usamos el paso 4b: El círculo trazado de #1 a #2 a #3 es en sentido horario, lo que significa que el centro quiral tiene la configuración S.
Modelo interactivo de (S) -alanina
El fármaco talidomida es un estudio de caso interesante, pero trágico, sobre la importancia de la estereoquímica en el diseño de fármacos. Fabricado por primera vez por una compañía farmacéutica alemana y prescrita ampliamente en Europa y Australia a fines de la década de 1950 como sedante y remedio para las náuseas matutinas en mujeres embarazadas, la talidomida pronto se vio implicada como la causa de devastadores defectos congénitos en bebés nacidos de mujeres que la habían tomado. La talidomida contiene un centro quiral, y por lo tanto existe en dos formas enantioméricas. Se comercializó como una mezcla racémica: es decir, una mezcla 50:50 de ambos enantiómeros.
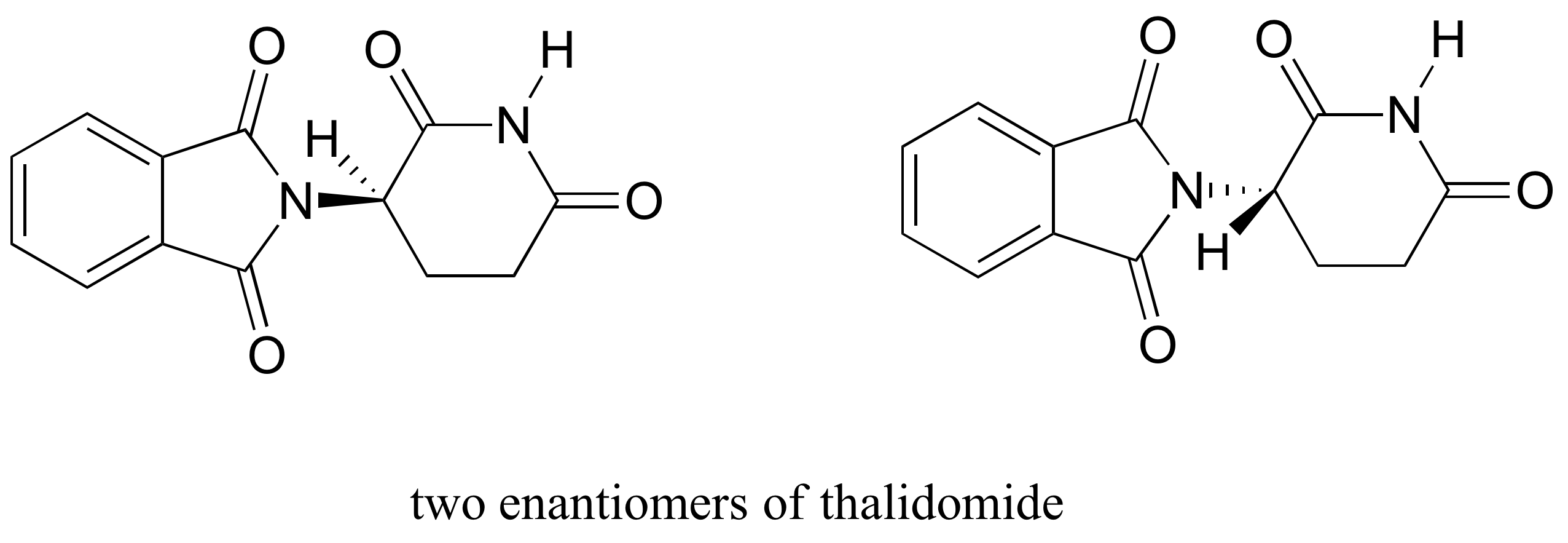
Tratemos de determinar la configuración estereoquímica del enantiómero de la izquierda. De los cuatro enlaces al centro quiral, la prioridad #4 es hidrógeno. El grupo nitrógeno es #1, el lado carbonilo del anillo es #2 y el lado —CH 2 del anillo es #3.
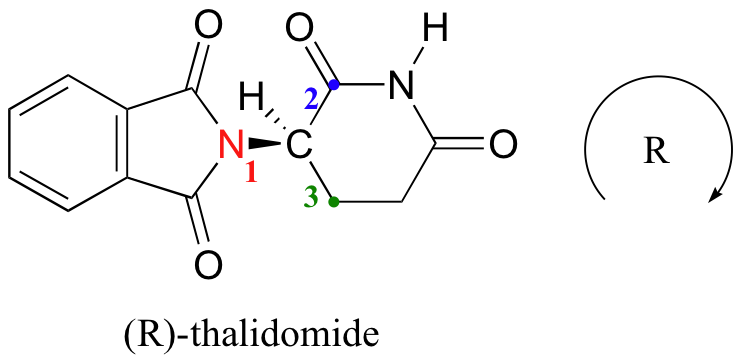
El hidrógeno se muestra apuntando lejos de nosotros, y los sustituyentes priorizados trazan un círculo en el sentido de las agujas del reloj: este es el enantiómero R de la talidomida. El otro enantiómero, por supuesto, debe tener la configuración S.
Aunque los científicos aún no están seguros hoy en día de cómo funciona la talidomida, la evidencia experimental sugiere que en realidad fue el enantiómero R el que tuvo los efectos médicos deseados, mientras que el enantiómero S causó los defectos congénitos. Aun con este conocimiento, sin embargo, la (R) -talidomida pura no es segura, porque las enzimas en el cuerpo se convierten rápidamente entre los dos enantiómeros -veremos cómo sucede eso en el capítulo 12.
Como nota histórica, la talidomida nunca fue aprobada para su uso en los Estados Unidos. Esto fue gracias en gran parte a los esfuerzos de la doctora Frances Kelsey, una oficial de Alimentos y Medicamentos que, en peligro para su carrera, bloqueó su aprobación debido a sus preocupaciones por la falta de estudios de seguridad adecuados, particularmente en lo que respecta a la capacidad del medicamento para ingresar al torrente sanguíneo de un feto en desarrollo. Desafortunadamente, sin embargo, en ese momento los ensayos clínicos de nuevos medicamentos involucraron una distribución generalizada y no regulada a los médicos y sus pacientes en todo el país, por lo que las familias en Estados Unidos no se libraron de los daños causados.
Muy recientemente se ha legalizado un derivado cercano de la talidomida para volver a recetar en Estados Unidos, con estrictas medidas de seguridad aplicadas, para el tratamiento de una forma de cáncer de la sangre llamada mieloma múltiple. En Brasil, la talidomida se utiliza en el tratamiento de la lepra, pero a pesar de las medidas de seguridad, los niños siguen naciendo con defectos relacionados con la talidomida.
Ejercicio 3.11
Determinar las configuraciones estereoquímicas de los centros quirales en las biomoléculas que se muestran a continuación.
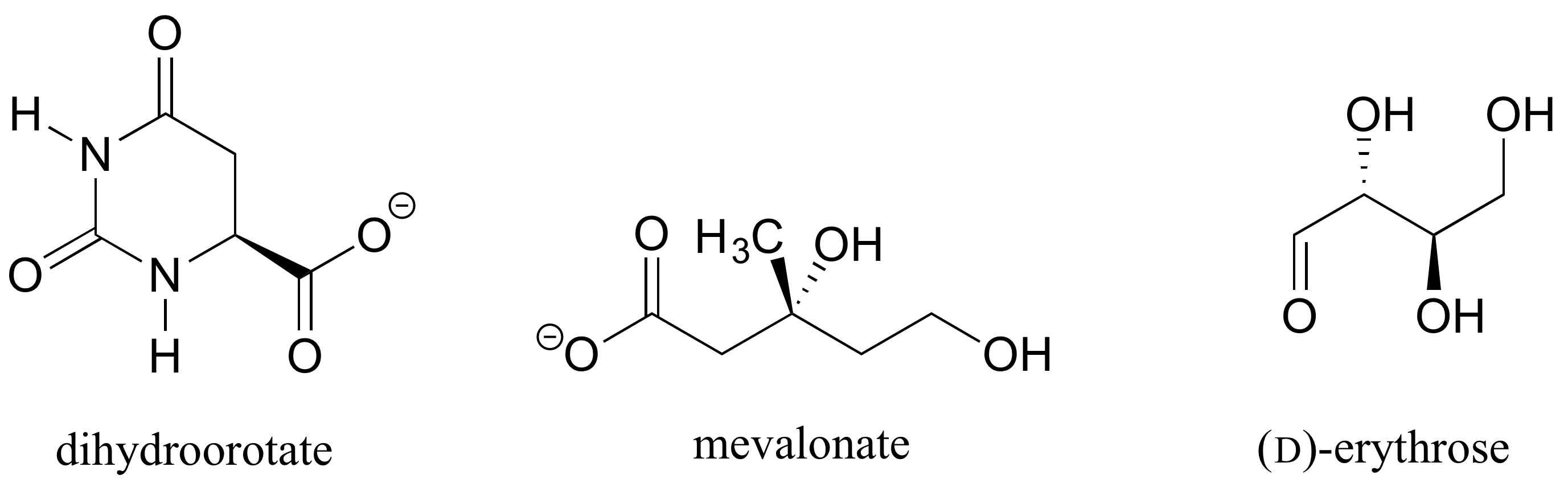
Ejercicio 3.12
¿Debe el enantiómero (R) del malato tener una cuña sólida o discontinua para el enlace C-O en la figura siguiente?
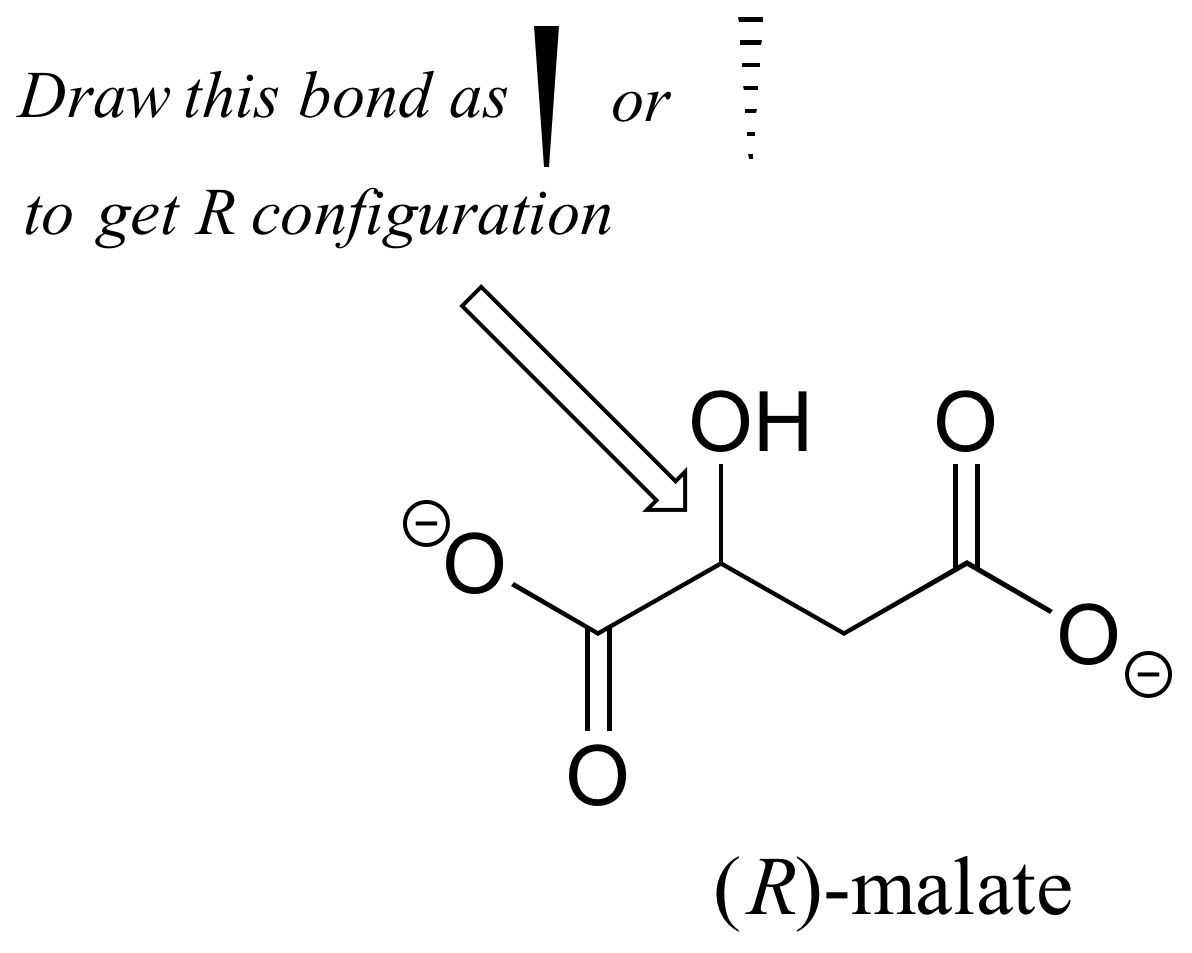
Ejercicio 3.13
Usando cuñas sólidas o discontinuas para mostrar estereoquímica, dibujar el enantiómero (R) del ibuprofeno y el enantiómero (S) del 2-metileritritol-4-fosfato (las estructuras se muestran anteriormente en este capítulo sin estereoquímica).
Soluciones a los ejercicios
Tutorial en video de Khan Academy sobre el sistema de nomenclatura R-S