3.7: Compuestos con múltiples centros quirales
- Page ID
- 72660
Hasta el momento, hemos estado analizando compuestos con un solo centro quiral. A continuación, dirigimos nuestra atención a aquellos que tienen múltiples centros quirales. Comenzaremos con algunos azúcares estereoisoméricos de cuatro carbonos con dos centros quirales.
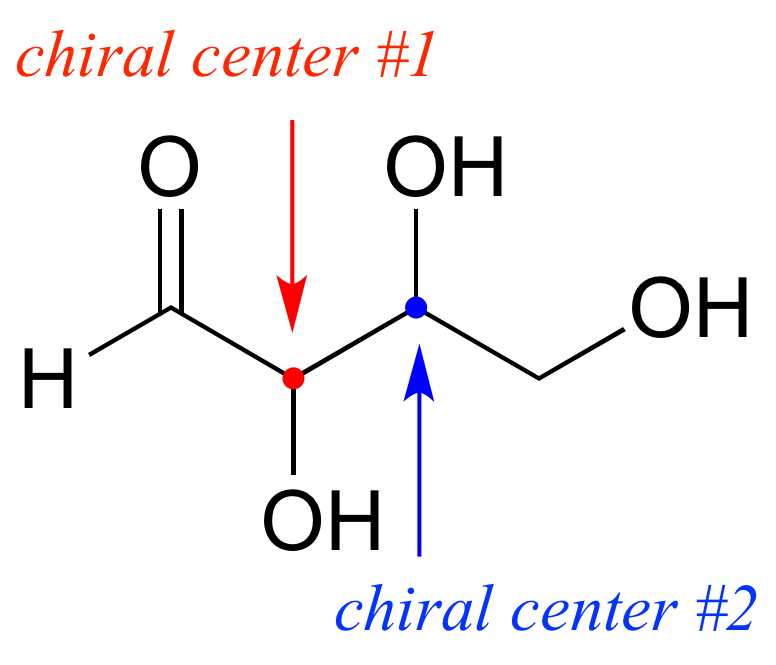
Para evitar confusiones, simplemente nos referiremos a los diferentes estereoisómeros por letras mayúsculas.
Mire primero el compuesto A a continuación. Ambos centros quirales en tienen la configuración R (¡debes confirmarlo tú mismo!). La imagen especular del Compuesto A es el compuesto B, que tiene la configuración S en ambos centros quirales. Si tuviéramos que recoger el compuesto A, darle la vuelta y ponerlo junto al compuesto B, veríamos que no son superponibles (de nuevo, ¡confirme esto usted mismo con sus modelos!). A y B son imágenes especulares no superponibles: en otras palabras, enantiómeros.
Ahora, mire el compuesto C, en el que la configuración es S en el centro quiral 1 y R en el centro quiral 2. Los compuestos A y C son estereoisómeros: tienen la misma fórmula molecular y la misma conectividad de enlace, pero una disposición diferente de átomos en el espacio (recordemos que esta es la definición del término 'estereoisómero). Sin embargo, no son imágenes especulares entre sí (¡confirma esto con tus modelos!) , y así no son enantiómeros. Por definición, son diastereómeros el uno del otro.
Observe que los compuestos C y B también tienen una relación diastereomérica, por la misma definición.
Entonces, los compuestos A y B son un par de enantiómeros, y el compuesto C es un diastereómero de ambos. ¿El compuesto C tiene su propio enantiómero? El compuesto D es la imagen especular del compuesto C, y los dos no son superponibles. Por lo tanto, C y D son un par de enantiómeros. El compuesto D es también un diastereómero de los compuestos A y B.
Esto también puede parecer muy confuso al principio, pero hay algunos atajos simples para analizar estereoisómeros:
Si todos los centros quirales son de configuración R/S opuesta entre dos estereoisómeros, son enantiómeros.
Si al menos uno, pero no todos los centros quirales son opuestos entre dos estereoisómeros, son diastereómeros.
(Nota: estos atajos para no tomar en cuenta la posibilidad de estereoisómeros adicionales debido a grupos alquenos: llegaremos a eso más adelante)
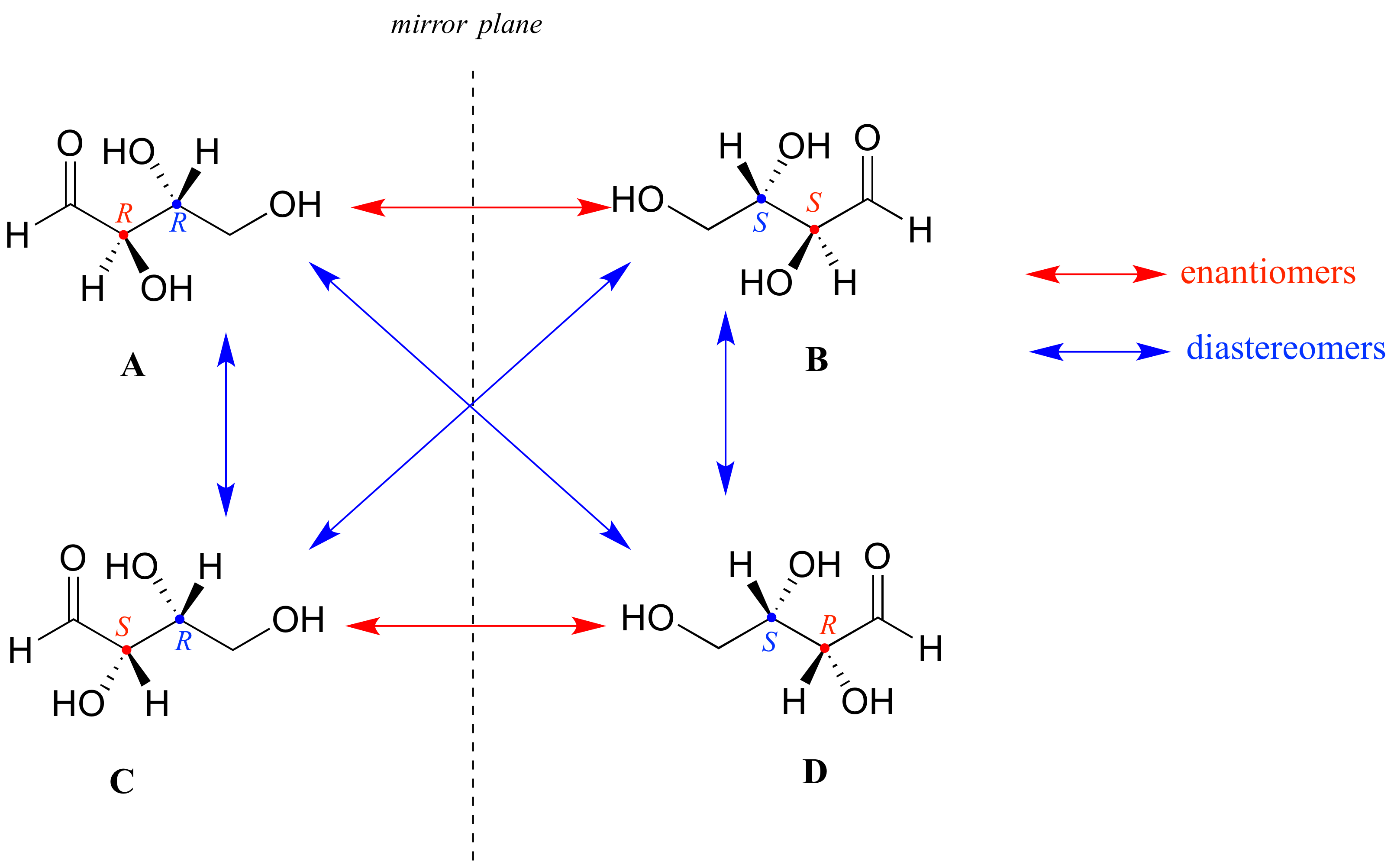
Aquí hay otra forma de observar los cuatro estereoisómeros, donde un centro quiral está asociado con el rojo y el otro azul. Pares de enantiómeros se apilan juntos.

Sabemos, usando el atajo anterior, que el enantiómero de R R debe ser S S - ambos centros quirales son diferentes. También sabemos que R S y S R son diastereómeros de R R, porque en cada caso uno -pero no ambos- centros quirales son diferentes.
Ahora, extendamos nuestro análisis a una molécula de azúcar con tres centros quirales. Pasando por todas las combinaciones posibles, se nos ocurren ocho estereoisómeros totales, cuatro pares de enantiómeros.

Dibujemos el estereoisómero R R R. Teniendo cuidado de dibujar correctamente los enlaces de cuña para que coincidan con las configuraciones R R R, obtenemos:
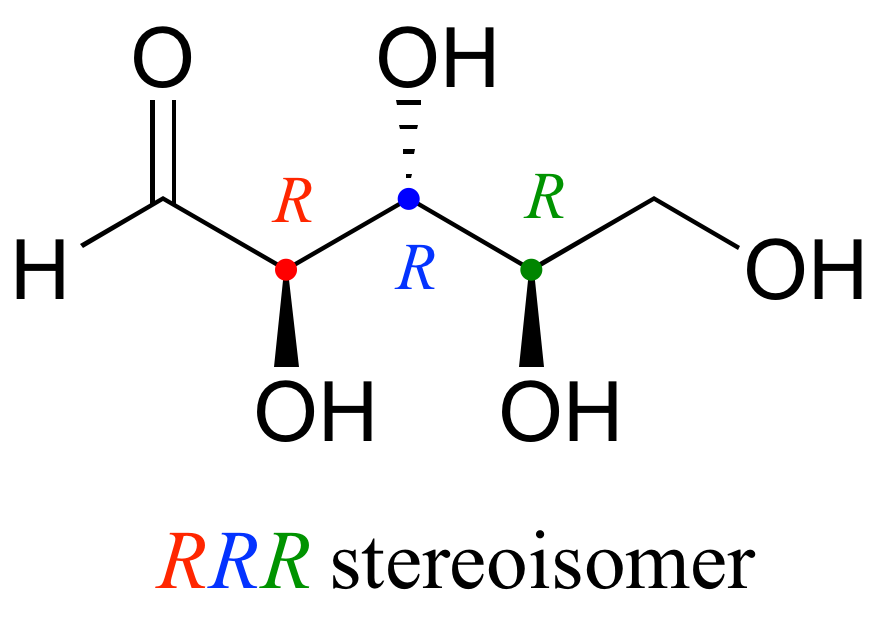
Ahora, usando el dibujo anterior como nuestro modelo, dibujar cualquier otro estereoisómero es fácil. Si queremos dibujar el enantiómero de R R R, no necesitamos intentar visualizar la imagen especular, solo comenzamos con la estructura R R R e invertimos la configuración en cada centro quiral para obtener S S S.
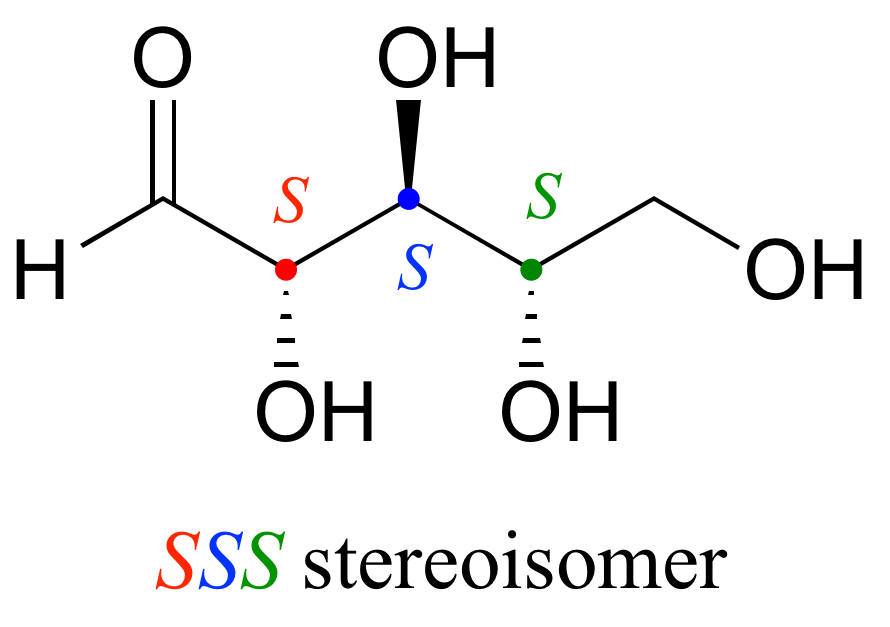
Intente hacer modelos de R R R y S S S y confirme que de hecho son imágenes especulares no superponibles entre sí.
Hay seis diastereómeros de R R R. Para dibujar uno de ellos, solo invertimos la configuración de al menos uno, pero no los tres, de los centros quirales. Invirtamos la configuración en el centro quiral 1 y 2, pero dejemos el centro quiral 3 sin cambios. Esto nos da la configuración S S R.
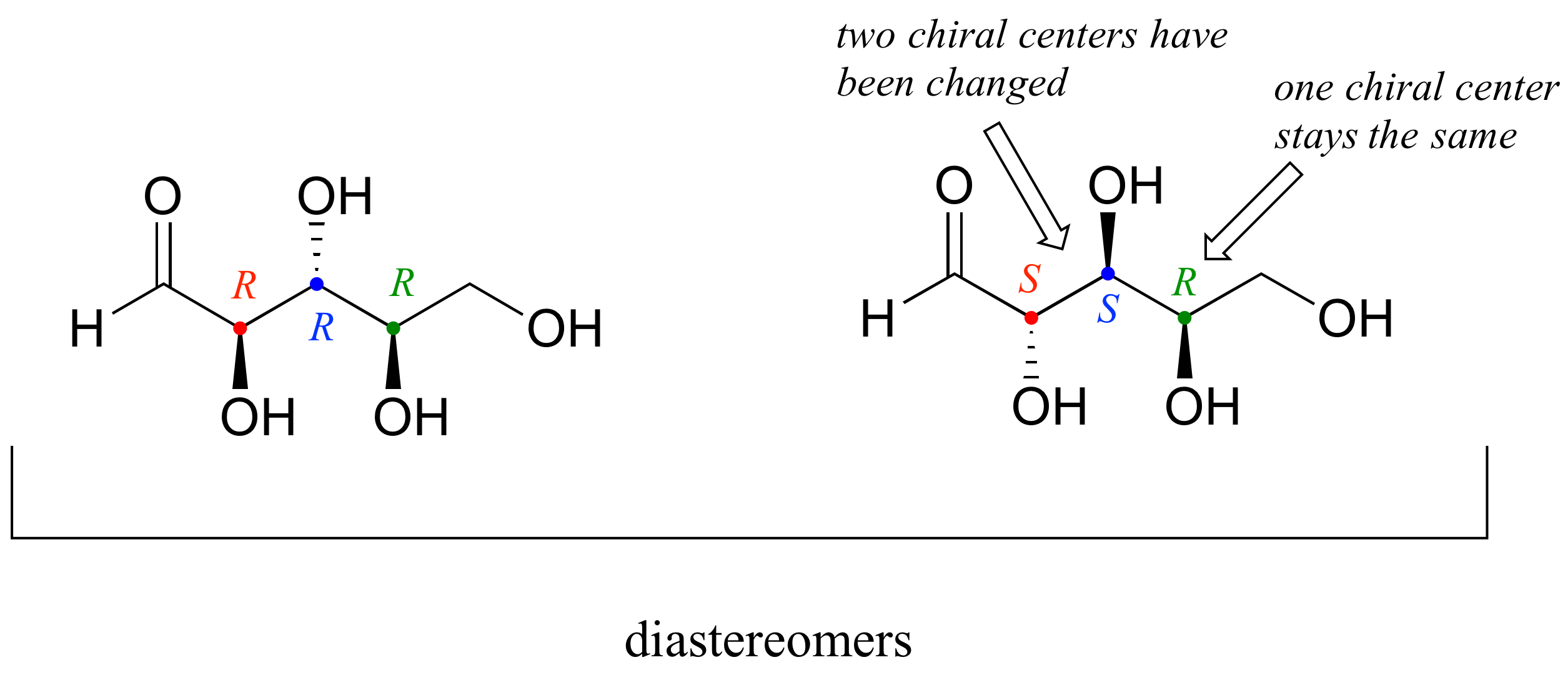
Una definición más en este punto: los diastereómeros que difieren en un solo centro quiral se denominan epímeros. Por ejemplo, R R R y S R R son epímeros :
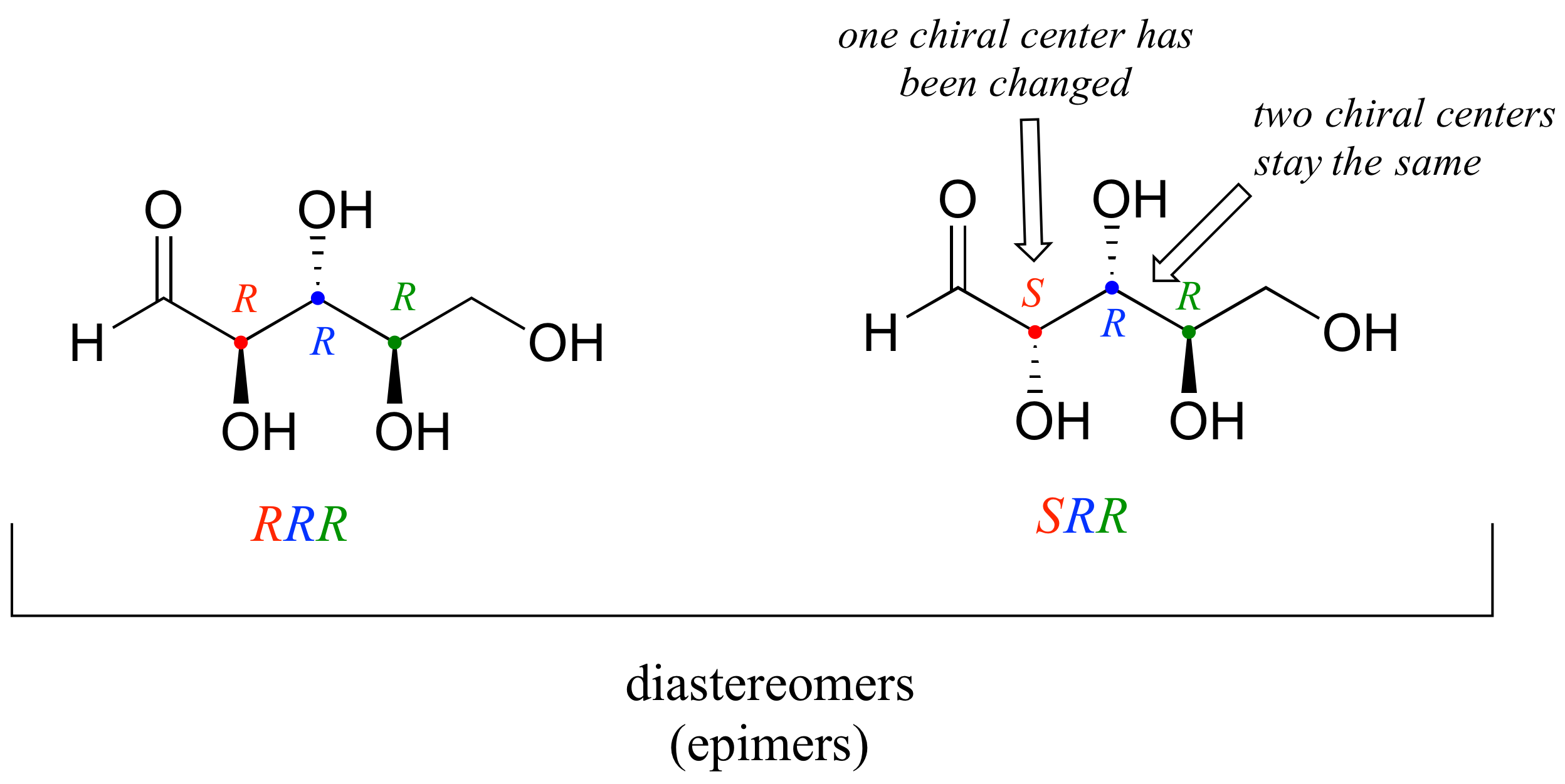
Los estereoisómeros R R y S S R mostrados anteriormente son diastereómeros pero no epímeros porque difieren en dos de los tres centros quirales.
a) Dibujar la estructura del enantiómero del estereoisómero S R S del azúcar utilizado en el ejemplo anterior.
b) Listar (usando el formato X X X, sin dibujar las estructuras) todos los epímeros de S R S.
c) Listar todos los estereoisómeros que son diastereómeros, pero no epímeros, de S R S.
Soluciones a ejercicios
El término epímero es útil porque en las vías bioquímicas, los compuestos con múltiples centros quirales son isomerizados en un centro específico por enzimas conocidas como epimerasas. A continuación se presentan dos ejemplos de reacciones catalizadas por epimera.
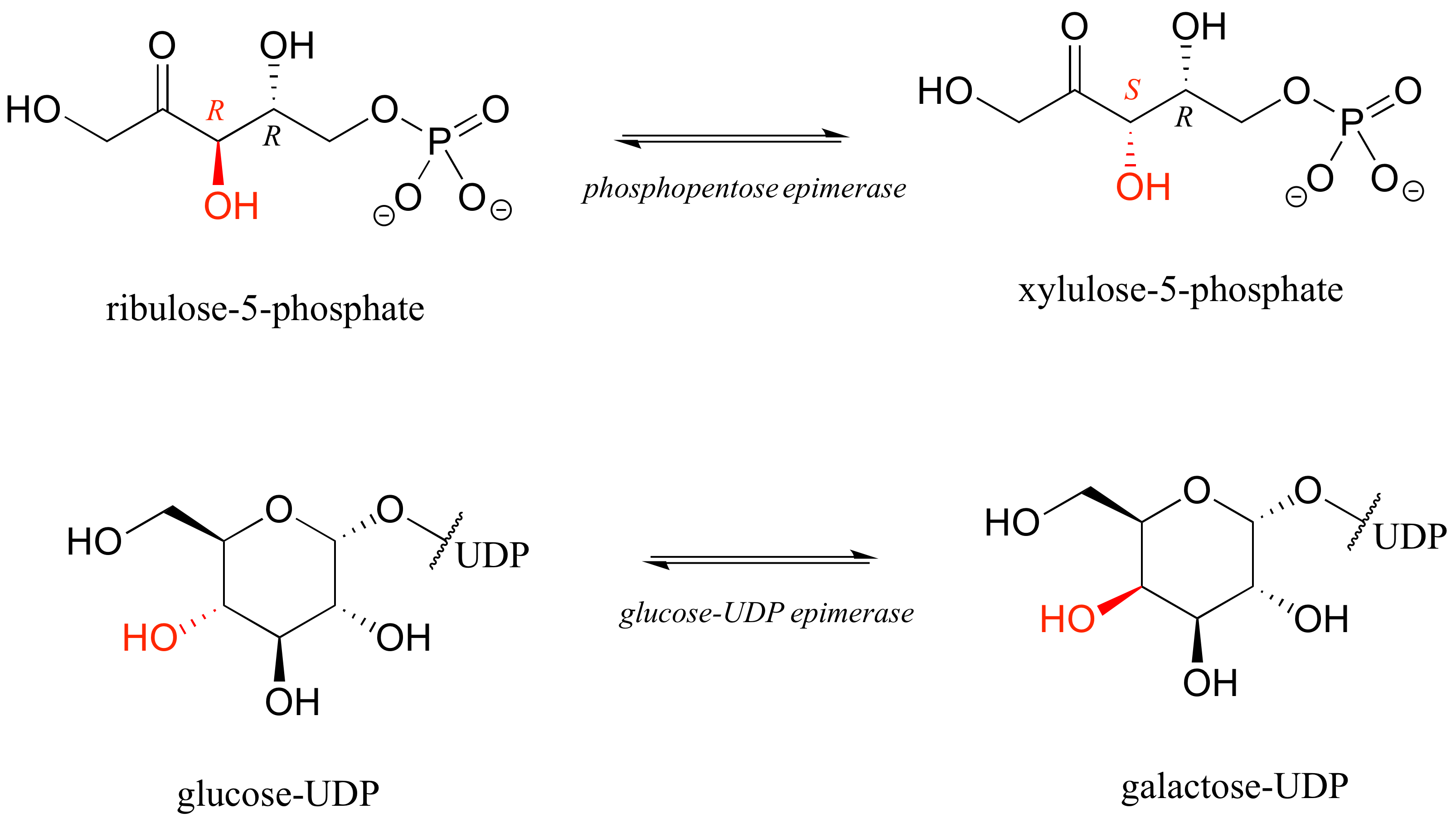
Sabemos que los enantiómeros tienen propiedades físicas idénticas y rotación específica de magnitud igual pero opuesta. Los diastereómeros, al menos en teoría, tienen diferentes propiedades físicas —estipulamos 'en teoría' porque a veces las propiedades físicas de dos o más diastereómeros son tan similares que es muy difícil distinguir entre ellos. Además, los valores específicos de rotación de los diastereómeros no están relacionados —podrían ser el mismo signo u signos opuestos, similares en magnitud o muy diferentes.
El azúcar a continuación es uno de los estereoisómeros que hemos estado discutiendo.
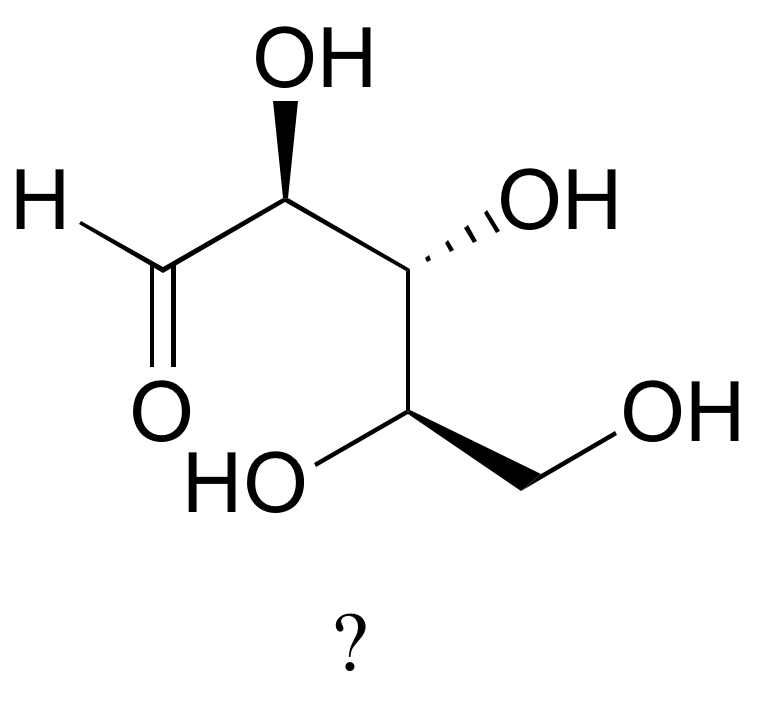
El único problema es que se dibuja con la columna vertebral de carbono en una orientación diferente a la que hemos visto. Determinar la configuración en cada centro quiral para determinar qué estereoisómero es.
Ejercicio 3.19
Dibujar el enantiómero de la estructura xilulosa-5-fosfato en la figura anterior.
Ejercicio 3.20
A continuación se muestra la estructura del aminoácido D-treonina, dibujado sin estereoquímica. La D-treonina tiene la configuración (S) en ambos centros quirales. Dibuja D-treonina, es enantiómero, y sus dos diastereómeros.
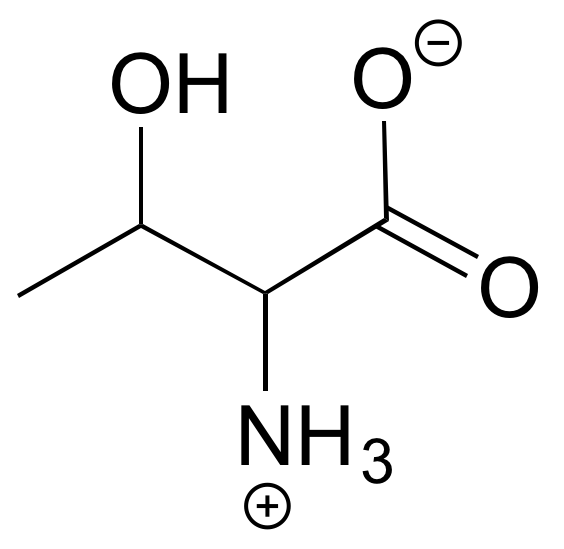
Soluciones a ejercicios
Aquí hay algo más de práctica en la identificación de relaciones isoméricas. La D-glucosa es el monosacárido que sirve como punto de entrada para la vía de la glucólisis y como bloque de construcción para los biopolímeros de carbohidratos almidón y celulosa. La 'D' en D-glucosa significa dextrarotatorio y forma parte del sistema de nomenclatura especializada para azúcares, del que no nos ocuparemos aquí. A continuación se muestra la estructura de cadena abierta del azúcar.
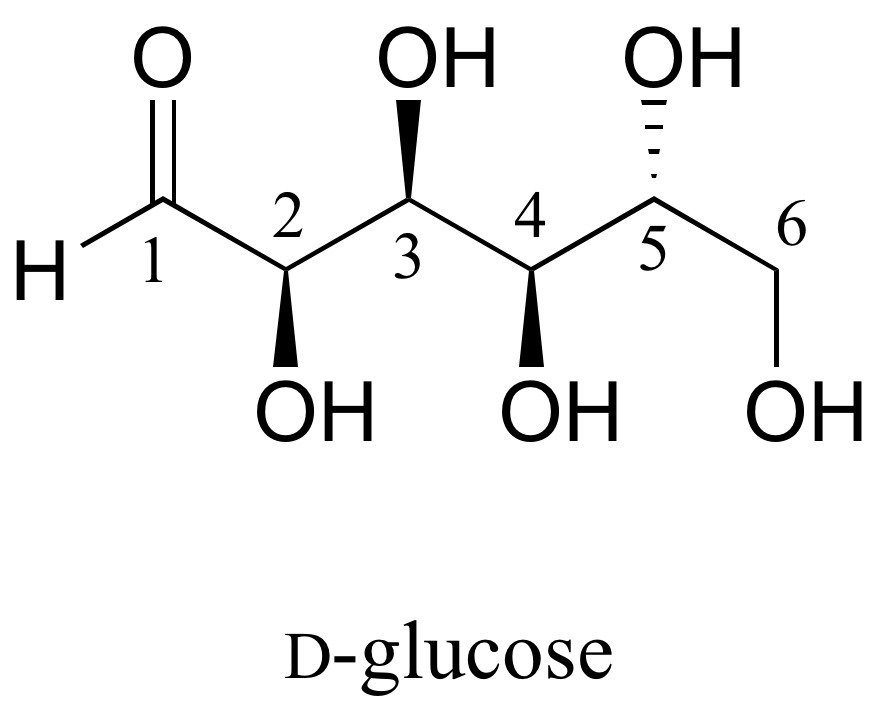
Debido a que la D-glucosa tiene cuatro centros quirales, puede existir en un total de 2 4 = 16 formas estereoisoméricas diferentes: tiene un enantiómero y 14 diastereómeros.
Ahora, comparemos las estructuras de los dos azúcares D-glucosa y D-gulosa, e intentemos determinar su relación.

Las dos estructuras tienen la misma fórmula molecular y la misma conectividad, por lo tanto deben ser estereoisómeros. Cada uno tiene cuatro centros quirales, y la configuración es diferente en dos de estos centros (en los carbonos #3 y #4). Son diastereómeros.
Ahora, mira las estructuras de D-glucosa y D-manosa.

Aquí, todo es igual a excepción de la configuración del centro quiral en el carbono #2. Los dos azúcares difieren en solo uno de los cuatro centros quirales, por lo que nuevamente son diastereómeros, y más específicamente son epímeros.
D-glucosa y L-glucosa son enantiómeros, ya que difieren en los cuatro centros quirales.
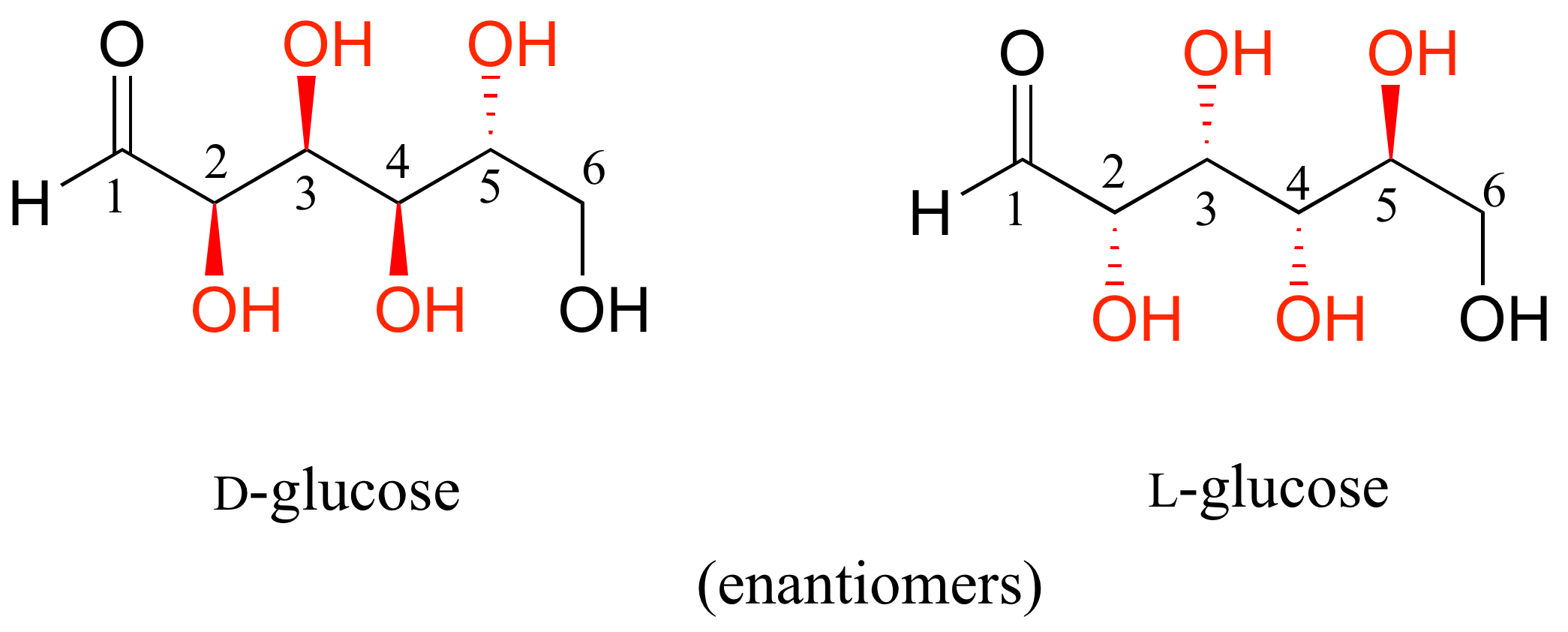
La D-glucosa es el enantiómero que se encuentra comúnmente en la naturaleza.
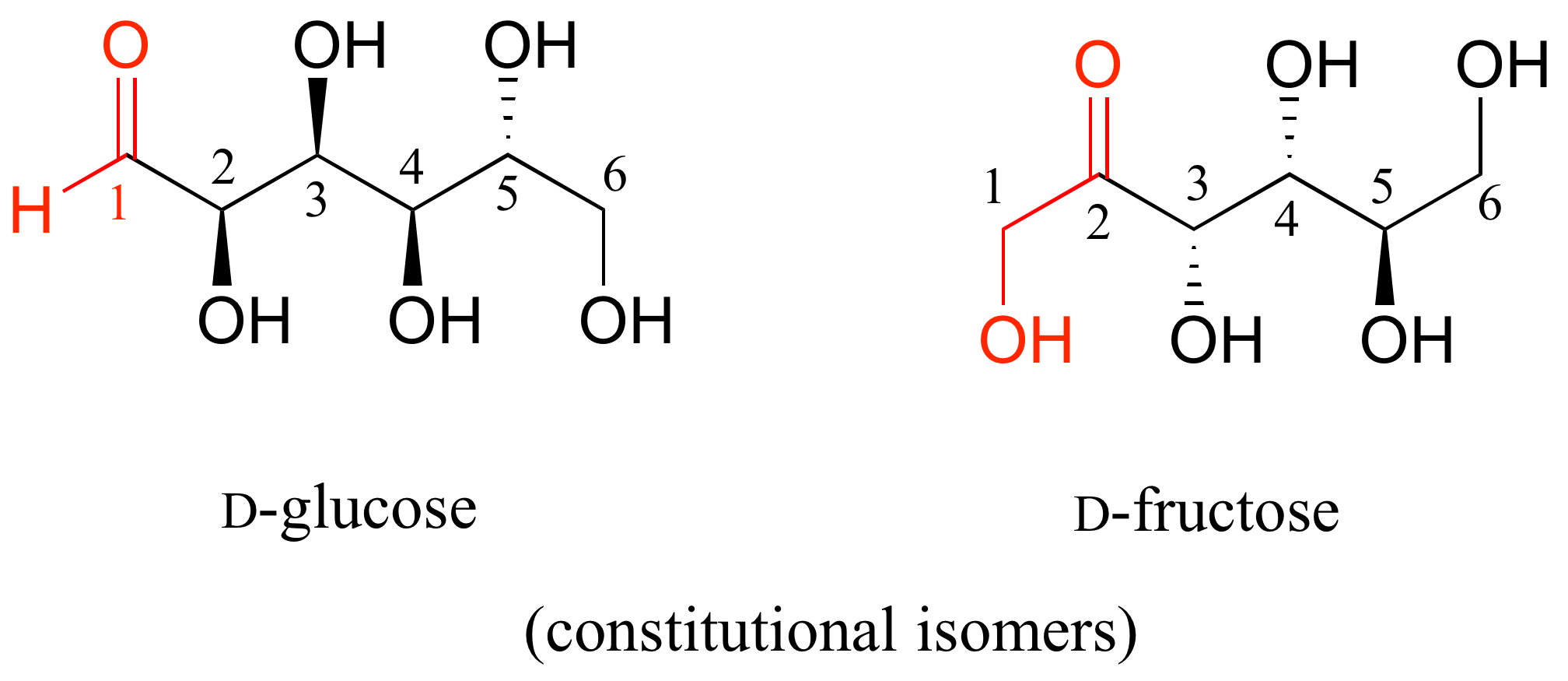
La D-glucosa y la D-fructosa no son estereoisómeros, porque tienen diferente conectividad de enlace: la glucosa tiene un grupo aldehído, mientras que la fructosa tiene una cetona. Sin embargo, los dos azúcares tienen la misma fórmula molecular, por lo que por definición son isómeros constitucionales.
La D-glucosa y la D-ribosa no son isómeros de ningún tipo, porque tienen diferentes fórmulas moleculares.
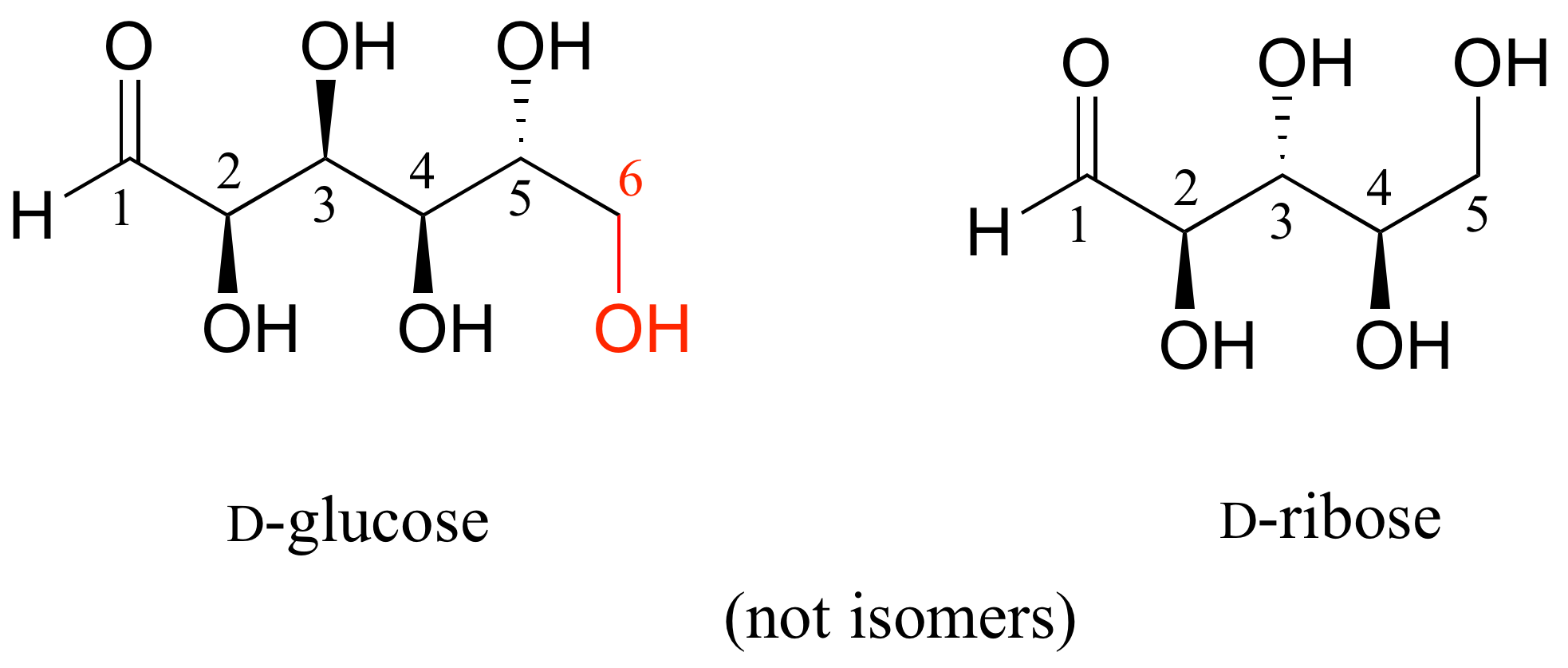
Identificar la relación entre cada par de estructuras. Sus opciones son: no isómeros, isómeros constitucionales, diastereómeros pero no epímeros, epímeros, enantiómeros o la misma molécula
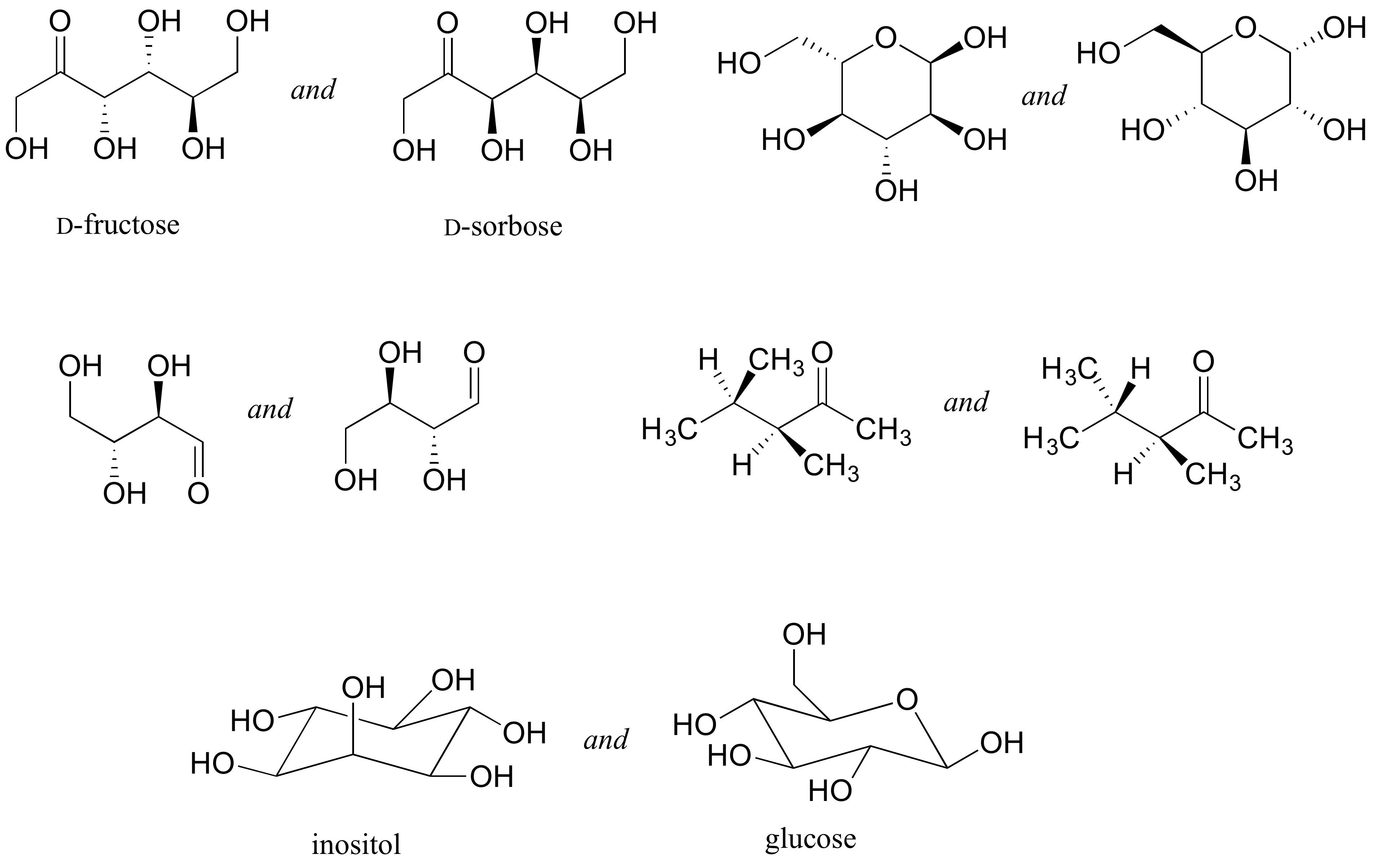
Ejercicio 3.22
Identificar la relación entre cada par de estructuras. Pista - averiguar la configuración de cada centro quiral.
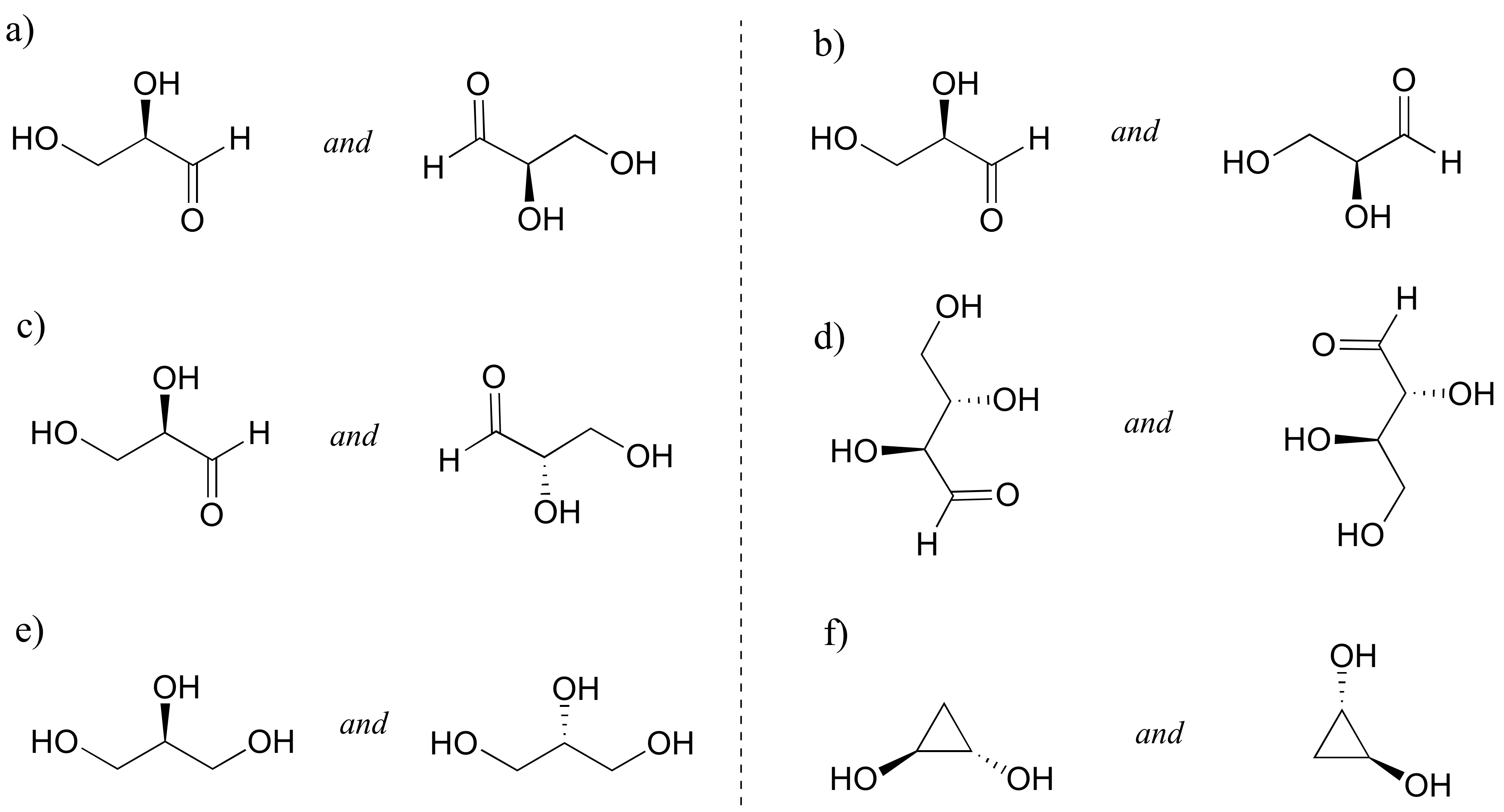
Soluciones a ejercicios
Video tutorial de Khan Academy sobre relaciones estereoisoméricas


