3.12: Proquiralidad
- Page ID
- 72547
Carbones proquirales
Cuando un carbono tetraédrico puede convertirse en un centro quiral cambiando solo uno de los grupos unidos, se le conoce como carbono 'proquiral'. Los dos hidrógenos en el carbono proquiral pueden describirse como 'hidrógeno proquirales'.
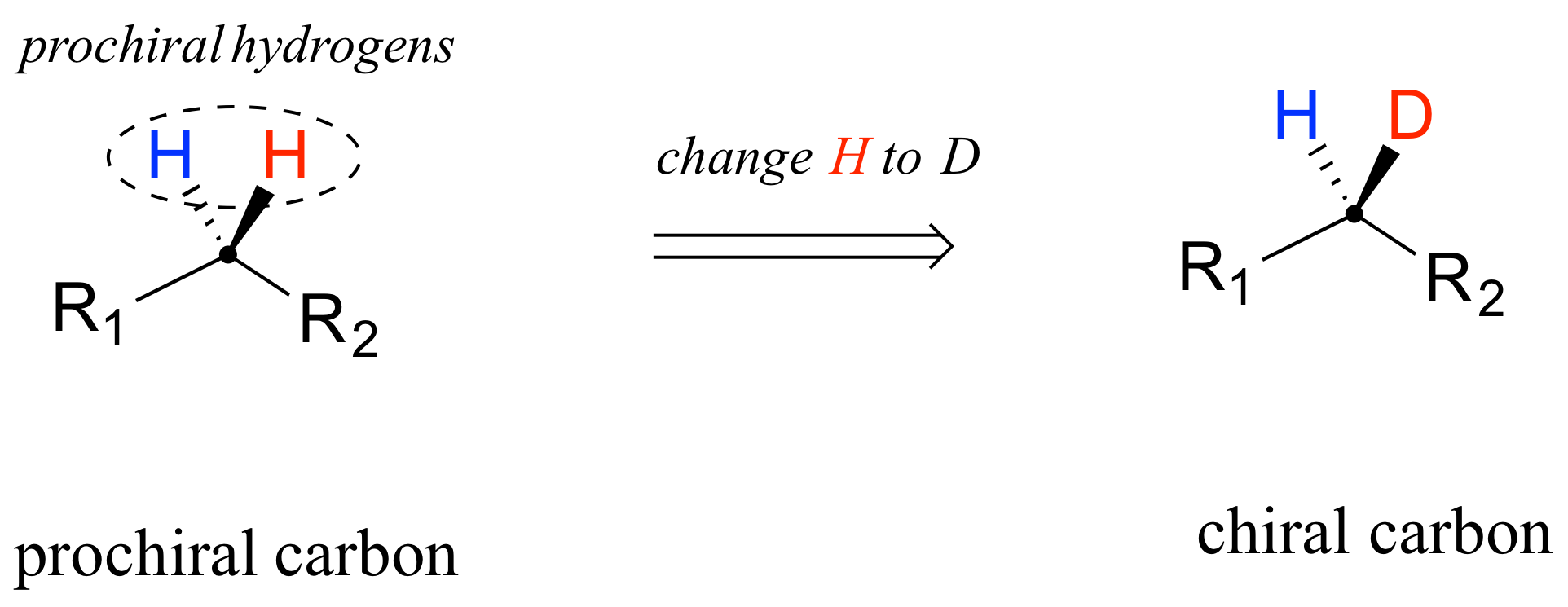
Nótese que si, en un 'experimento de pensamiento', cambiáramos cualquiera de los hidrógenos proquirales en un centro de carbono proquiral a un deuterio (el isótopo 2 H de hidrógeno), el carbono tendría ahora cuatro sustituyentes diferentes y por lo tanto sería un centro quiral.
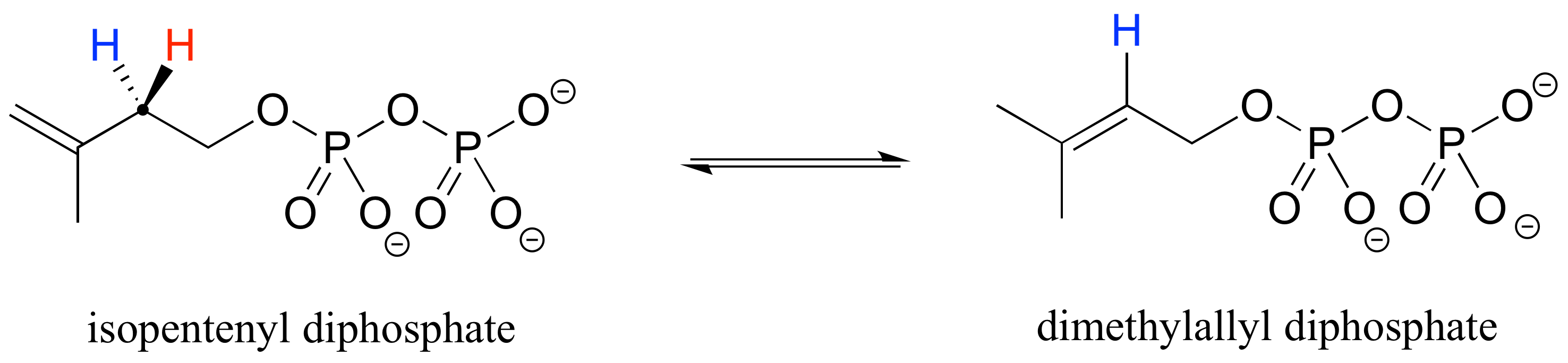
La proquiralidad es un concepto importante en la química biológica, ya que las enzimas pueden distinguir entre los dos grupos 'idénticos' unidos a un centro de carbono proquiral debido a que ocupan diferentes regiones en el espacio tridimensional. Considera la reacción de isomerización a continuación, que forma parte de la biosíntesis de compuestos isoprenoides. No necesitamos entender la reacción en sí (será cubierta en el capítulo 14); todo lo que necesitamos reconocer en este punto es que la enzima isomerasa es capaz de distinguir entre los hidrógenos proquirales 'rojo' y 'azul' en el sustrato de isopentenilo difosfato (IPP). En el transcurso de la reacción de izquierda a derecha, el IPP pierde específicamente el hidrógeno 'rojo' y mantiene el 'azul'.
Los hidrógenos proquirales se pueden designar sin ambigüedades usando una variación en el sistema R/S para marcar centros quirales. En aras de la claridad, veremos una molécula muy simple, el etanol, para explicar este sistema. Para nombrar a los hidrógenos proquirales 'rojos' y 'azules' en el etanol, necesitamos participar en un experimento mental. Si nosotros, en nuestra imaginación, cambiáramos arbitrariamente el H rojo a un deuterio, la molécula ahora sería quiral y el carbono quiral tendría la configuración R (D tiene una prioridad mayor que H).
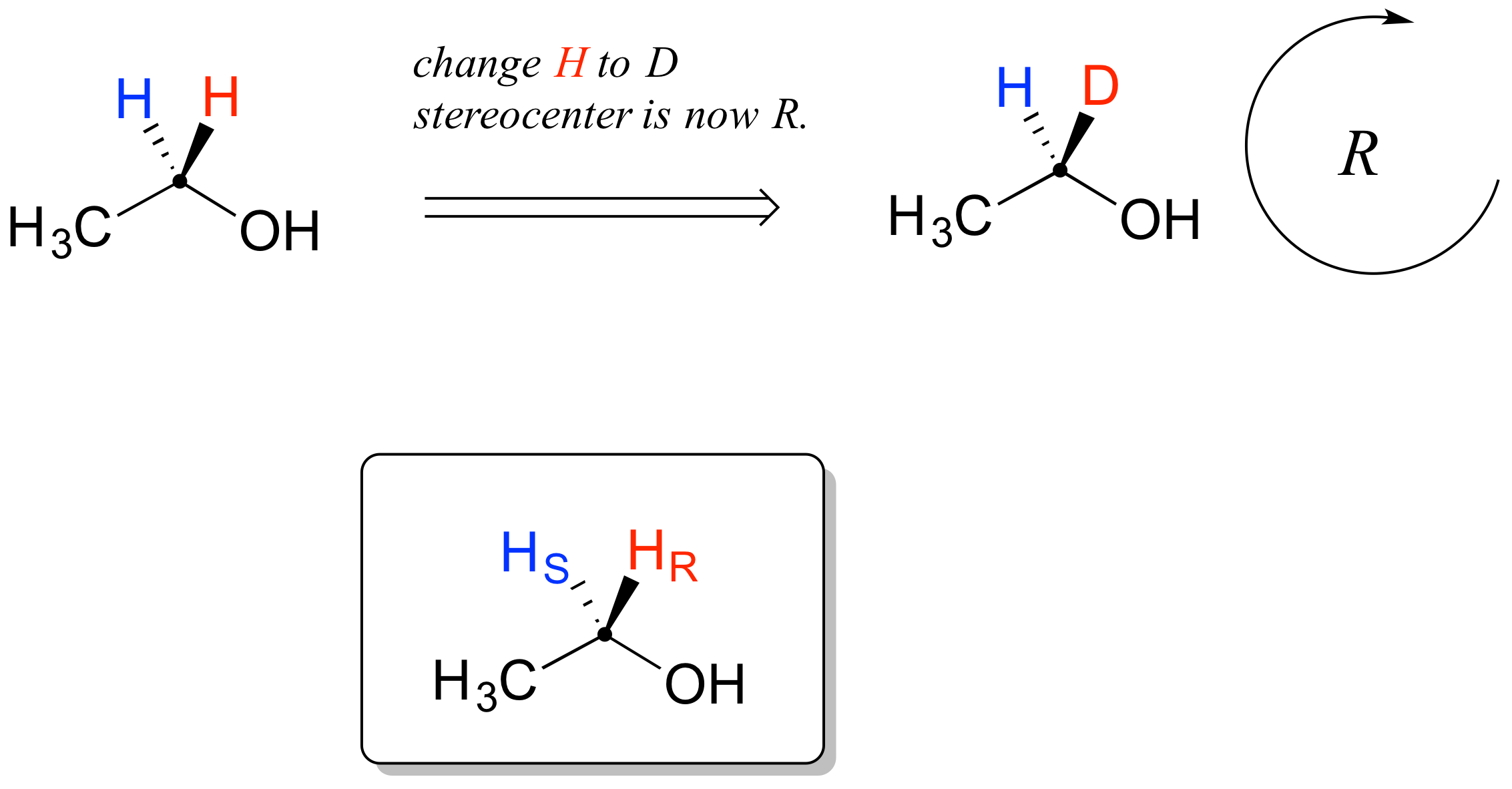
Por esta razón, podemos referirnos al H rojo como el hidrógeno pro-R del etanol, y etiquetarlo H R. Por el contrario, si cambiamos el H azul a D y dejamos el H rojo como hidrógeno, la configuración de la molécula sería S, por lo que podemos referirnos al azul H como el hidrógeno Pro-S del etanol, y etiquetarlo H S.
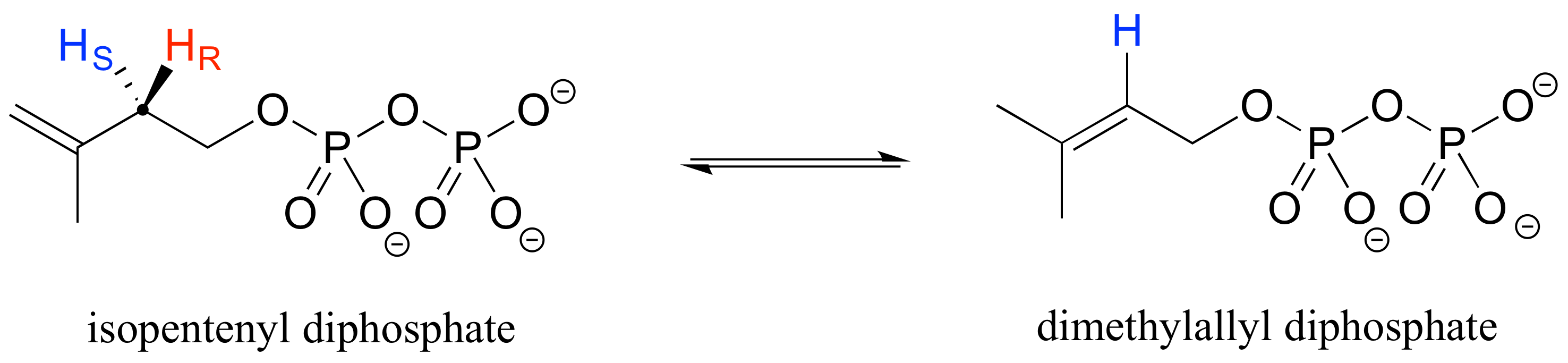
Mirando hacia atrás en nuestro ejemplo de biosíntesis de isoprenoides, vemos que es específicamente el hidrógeno pro-R el que pierde el sustrato de isopentenil difosfato en la reacción.
Los hidrógenos proquirales pueden designarse enantiotópicos o diastereotópicos. Si bien H R o H S en etanol fueran reemplazados por un deuterio, los dos isómeros resultantes serían enantiómeros (porque no hay otros estereocentros en ninguna parte de la molécula).
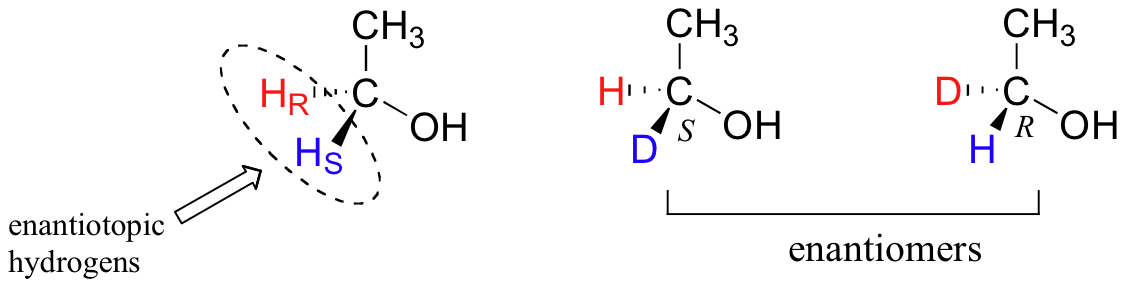
Así, estos dos hidrógenos se denominan enantiotópicos.
En (R) -gliceraldehído-3-fosfato ((R) -GAP), sin embargo, vemos algo diferente:
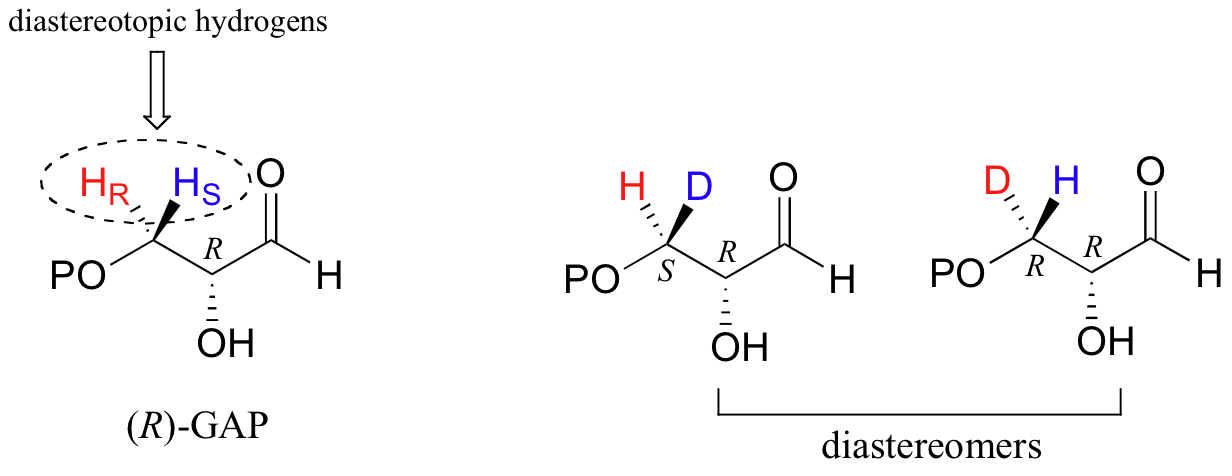
R) -GAP ya cuenta con un centro quiral. Si cualquiera de los hidrógenos proquirales H R o H S es reemplazado por un deuterio, se crea un segundo centro quiral, y las dos moléculas resultantes serán diastereómeros (una es S, R, una es R, R). Así, en esta molécula, H R y H S son referidos como hidrógenos diastereotópicos.
Finalmente, los hidrógenos que no pueden designarse ni enantiotópicos ni diastereotópicos se denominan homotópicos. Si un hidrógeno homotópico es reemplazado por deuterio, no se crea un centro quiral. Los tres átomos de hidrógeno en el grupo metilo (CH 3) del etanol (y en cualquier grupo metilo) son homotópicos.
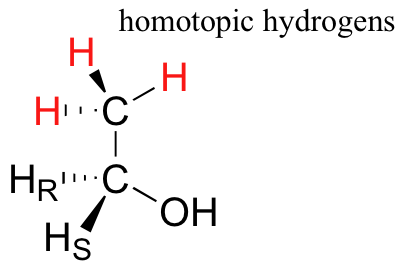
Una enzima no puede distinguir entre hidrógenos homotópicos.
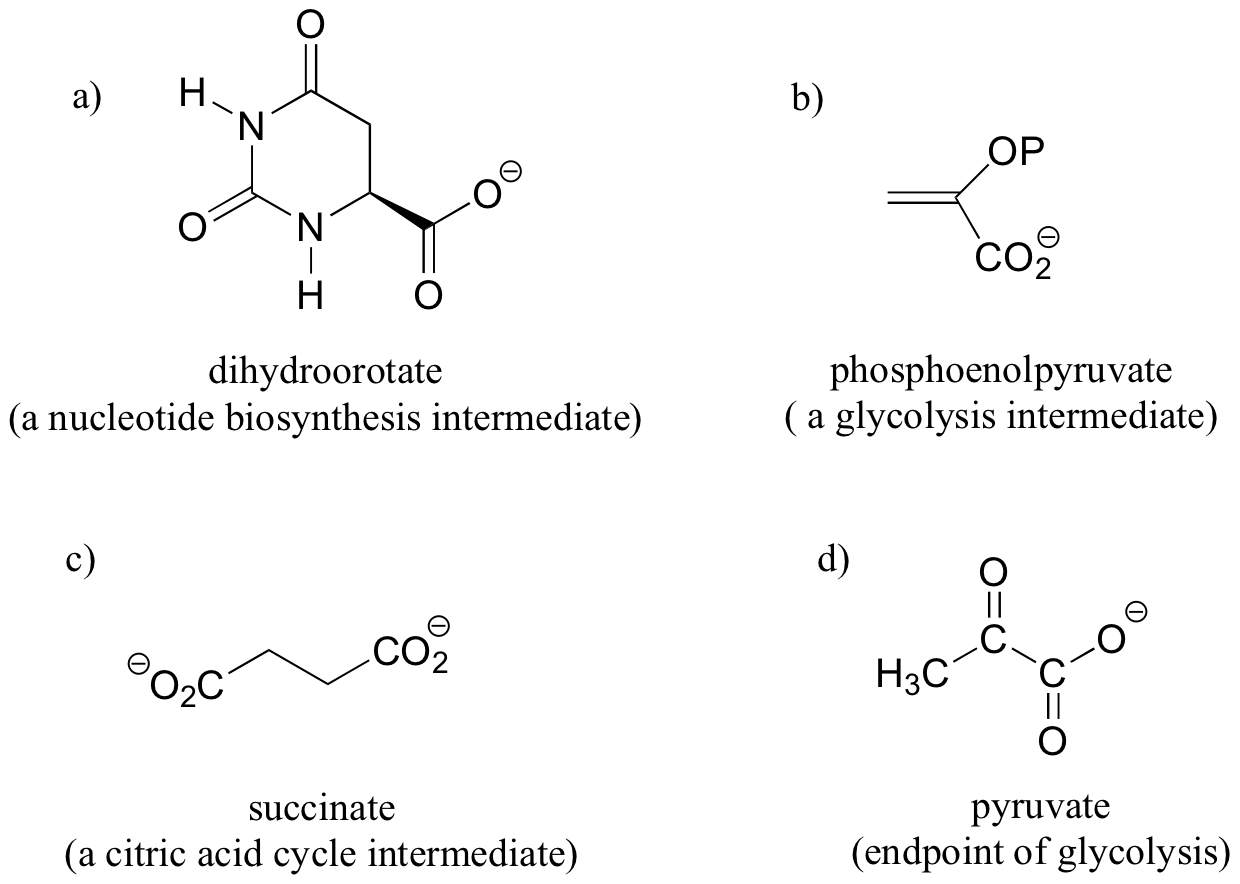
Identificar en las moléculas de abajo todos los pares/grupos de hidrógenos que son homotópicos, enantiotópicos o diastereotópicos. Cuando corresponda, etiquetar los hidrógenos proquirales como H R o H S.
Soluciones a los ejercicios
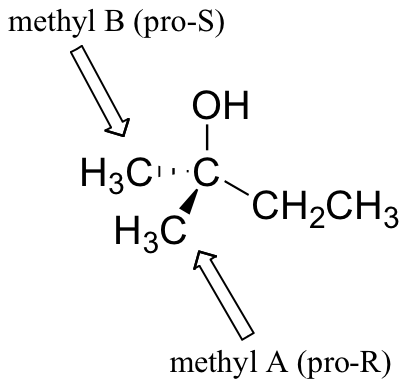
Grupos distintos de los hidrógenos pueden considerarse proquirales. El alcohol de abajo tiene dos grupos metilo proquirales: el rojo es Pro-R, el azul es Pro-S. ¿Cómo hacemos estas designaciones? Simple - solo asignarle arbitrariamente al metilo rojo una prioridad más alta que el azul, y el compuesto ahora tiene la configuración R - por lo tanto, el metilo rojo es pro-R.
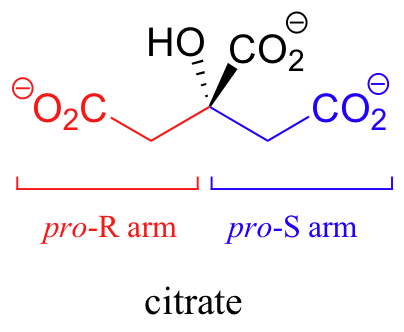
El citrato es otro ejemplo. El carbono central es un centro proquiral con dos 'brazos' que son idénticos excepto que uno puede designarse Pro-R y el otro Pro-S.
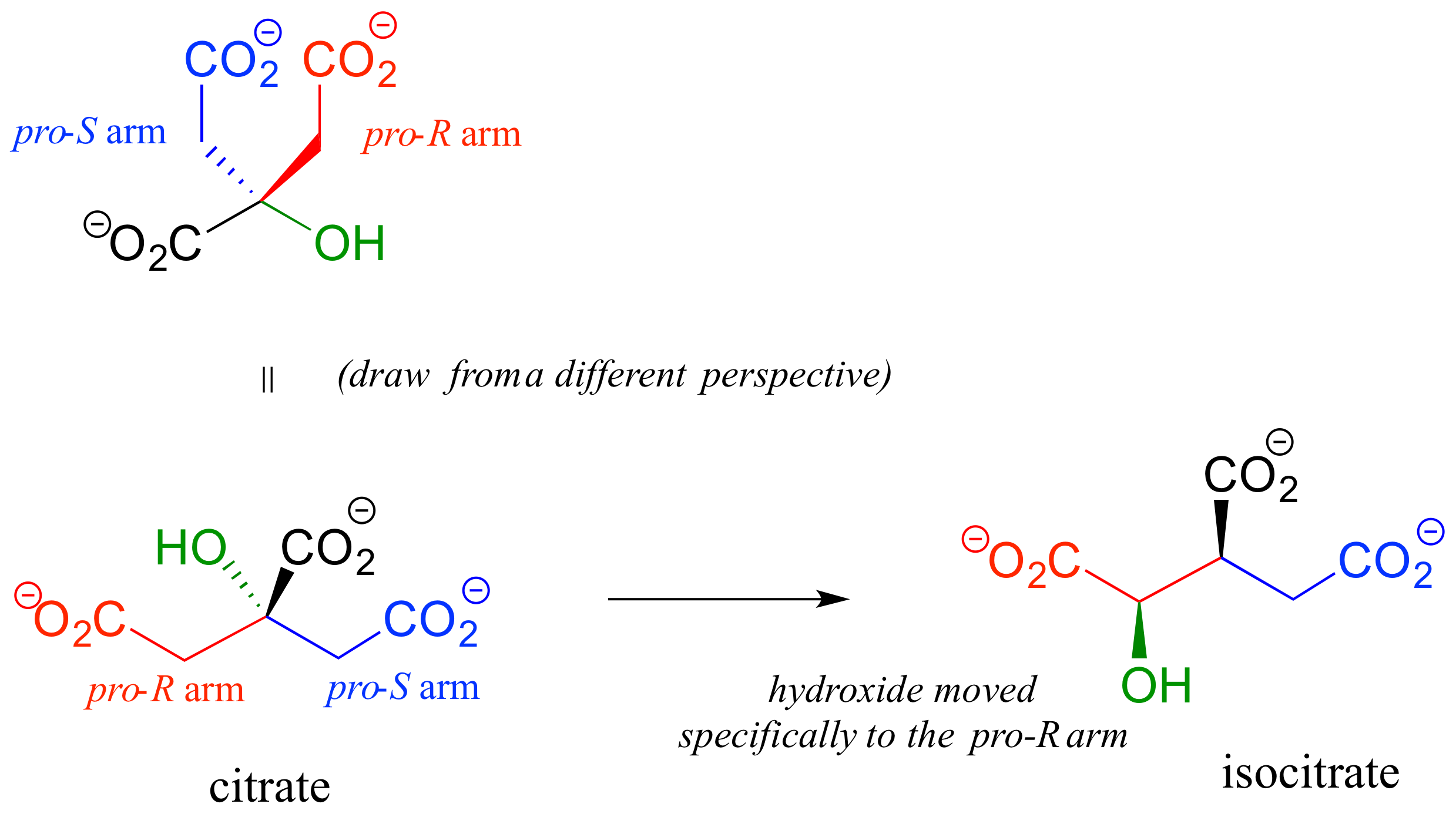
En una reacción de isomerización del ciclo del ácido cítrico (Krebs), un hidróxido se desplaza específicamente al brazo pro-R de citrato para formar isocitrato: nuevamente, la enzima que cataliza la reacción distingue entre los dos brazos proquirales del sustrato (estudiaremos esta reacción en el capítulo 13).
Asignar designaciones Pro-R y Pro-S a todos los grupos proquirales en el aminoácido leucina. (Pista: ¡hay dos pares de grupos proquirales!). ¿Estos grupos proquirales son diastereotópicos o enantiotópicos?

Soluciones a los ejercicios
Aunque un carbono alqueno unido a dos grupos idénticos no se considera un centro proquiral, estos dos grupos pueden ser diastereotópicos. H a y H b sobre el alqueno de abajo, por ejemplo, son diastereotópicos: si cambiamos uno, y luego el otro, de estos hidrógenos a deuterio, los compuestos resultantes son diastereómeros E y Z.
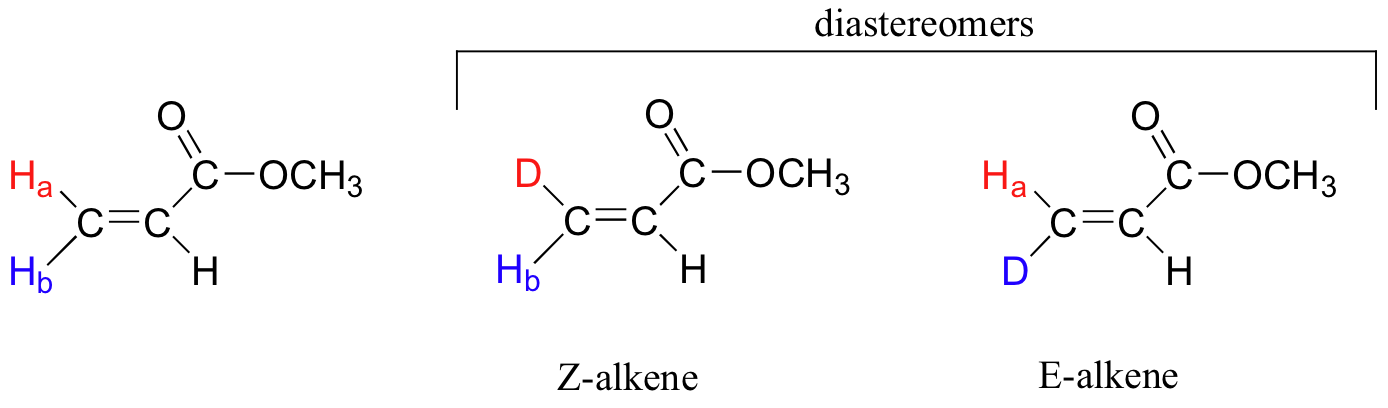
Grupos carbonilo e imina proquirales
Planos trigonales, los carbonos hibridados sp 2 no son, como bien sabemos, centros quirales, sino que pueden ser centros proquirales si están unidos a tres sustitutivos diferentes. Nosotros (y las enzimas que catalizan reacciones para las que son sustratos) podemos distinguir entre las dos 'caras' planas de un grupo proquiral sp 2 - hibridado. Estas caras son designadas por los términos re y si. Para determinar cuál es la re y cuál es la cara si de un grupo orgánico plano, simplemente usamos los mismos rankings de prioridad con los que estamos familiarizados del sistema R/S, y trazamos un círculo: re es en sentido horario y si es antihorario.
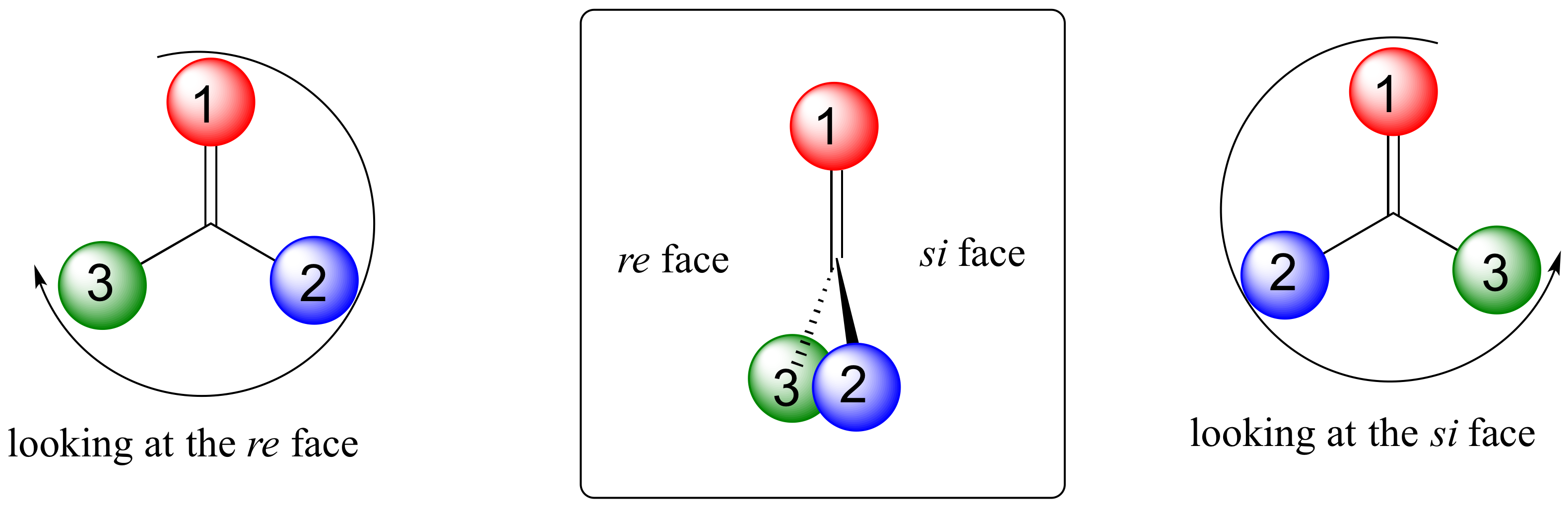
A continuación, por ejemplo, estamos mirando hacia abajo en la cara re del grupo cetona en el piruvato:
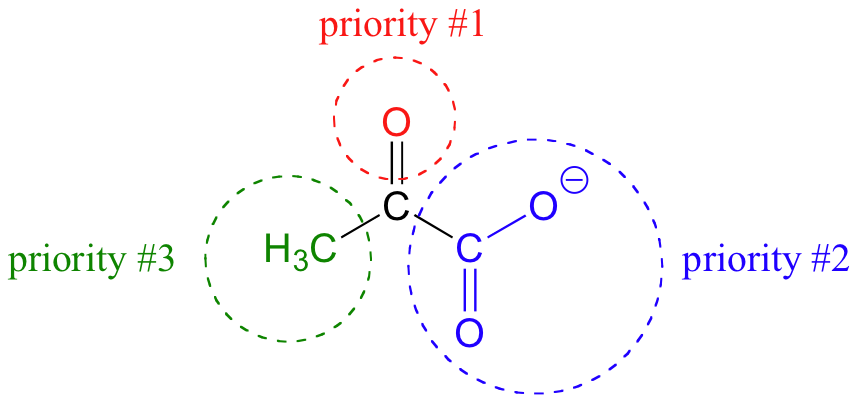
Si volteamos la molécula, estaríamos mirando la cara si del grupo cetona. Nótese que el grupo carboxilato no tiene caras re y si, debido a que dos de los tres sustituyentes en ese carbono son idénticos (cuando se toman en cuenta las dos formas de resonancia del carboxilato).
Como veremos en el capítulo 10, las enzimas que catalizan reacciones en los carbonos carbonílicos actúan específicamente de un lado o del otro.
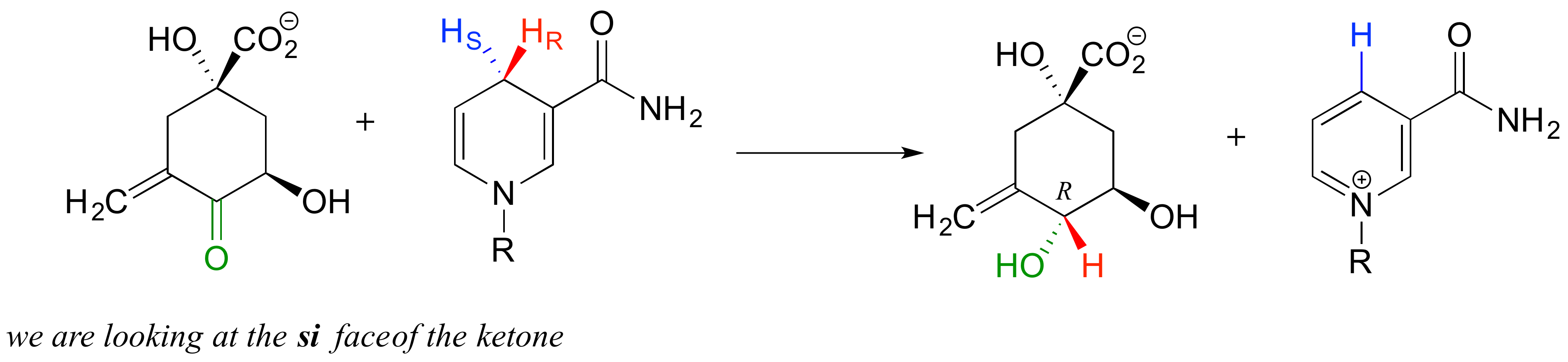
No hay que preocuparnos por comprender los detalles de la reacción que se muestra arriba en este punto, aparte de notar la estereoquímica involucrada. El hidrógeno pro-R (junto con los dos electrones en el enlace C-H) se transfiere a la cara si de la cetona (en verde), formando, en este ejemplo particular, un alcohol con la configuración R. Si la transferencia hubiera tenido lugar en la cara de re de la cetona, el resultado habría sido un alcohol con la configuración S.
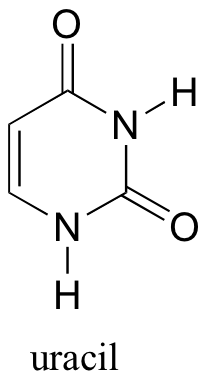
Para cada uno de los grupos carbonilo en uracilo, indique si estamos mirando la cara re o si en el dibujo estructural a continuación.
Soluciones a los ejercicios


