3.13: Soluciones a los ejercicios del Capítulo 3
- Page ID
- 72593
E3.1:

E3.2:

E3.3: Recuerda de tu curso de Química General que ΔG 0, el cambio estándar de Energía Libre de Gibbs de una reacción (o en este caso, un cambio conformacional) está relacionado con la constante de equilibrio K eq por:
ΔG 0 = rtlNK eq o K eq = e^ (-ΔG 0 /RT)
... donde R es la constante de gas 8.314 J mol -1 K -1
Usando T = 298K (25 o C) y ΔG 0 = -7.0 kJ/mol, calculamos K eq = 17.
Tenga en cuenta que ΔG 0 tiene un valor negativo porque el giro del anillo metil-axial a metil-ecuatorial es un proceso energéticamente descendente. Debido a que la conformación ecuatorial es más estable, tiene sentido que la constante de equilibrio para el giro del anillo sea mayor que 1.
E3.4: Obsérvese en (b) que uno de los sustituyentes debe estar en la posición axial. En la conformación de silla de menor energía, es el grupo metilo más pequeño el que asume la posición axial.
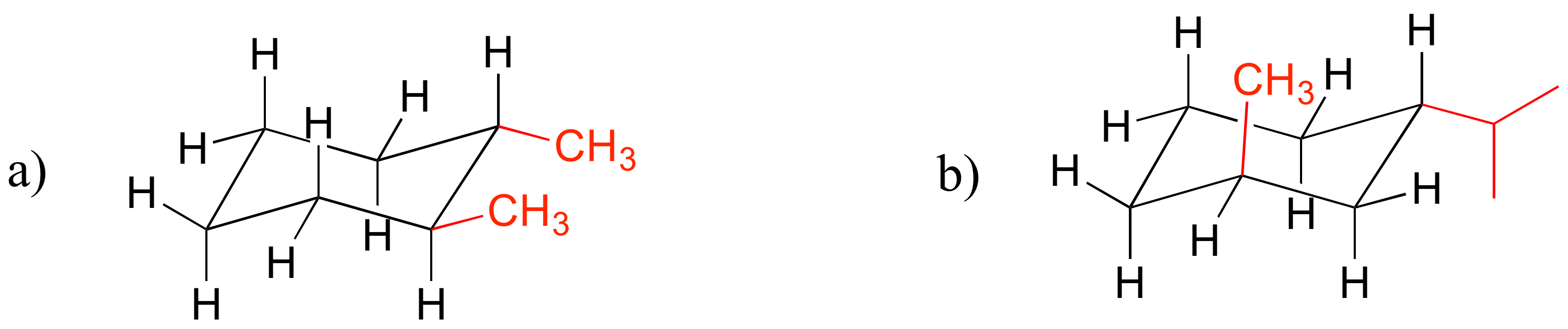
E3.5: Para responder a estas preguntas, querrá dibujar las conformaciones de silla de los compuestos especificados.
a) cis -1 ,3-dimetilciclohexano: los dos grupos metilo son ecuatoriales o ambos axiales. En cis-1,4-dimetilciclohexano, un grupo metilo es siempre axial y otro ecuatorial, por lo que las dos conformaciones tienen la misma energía.
b) trans-1,2-dimetilciclohexano: los dos grupos metilo son ecuatoriales o ambos axiales. En cis-1,2-dimetilciclohexano, un grupo metilo es siempre axial y otro ecuatorial, por lo que las dos conformaciones tienen la misma energía.
c) trans -1-isopropil-2-metilciclohexano: ambos compuestos son diaxiales o diecuatoriales, pero el sustituyente isopropílico mayor significa que la diferencia entre las conformaciones diaxial y diecuatorial es mayor.
E3.6: No. Para cambiar la relación de dos sustituyentes en un anillo de cis a trans, se necesitaría romper y reformar dos enlaces covalentes. Los volteos de anillo implican solo la rotación de enlaces simples
E3.7:
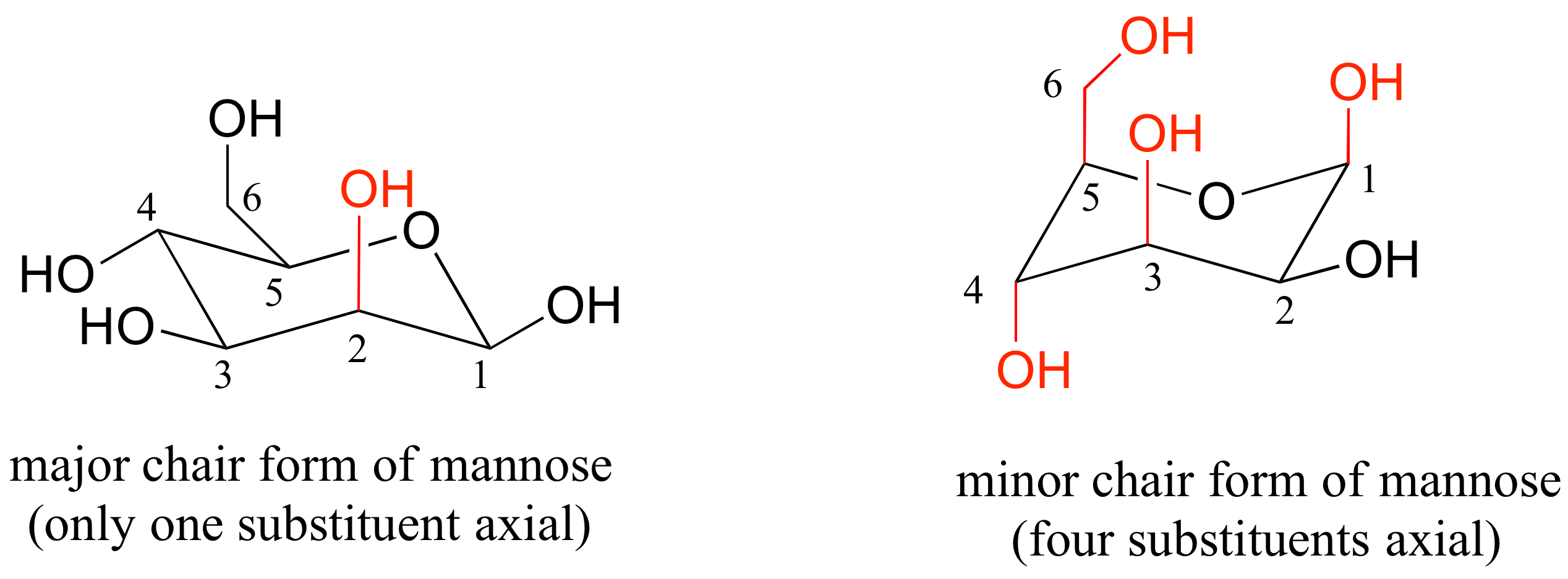
E3.8: Los centros quirales se designan con un punto.
E3.9: (hay otras formas en que los dos enantiómeros se pueden dibujar correctamente - revisa tu dibujo con tu instructor o tutor)
a)
b) No, las dos estructuras son idénticas. En ambos dibujos, el vínculo con el OH está apuntando fuera del plano de la página, no importa si la cuña sólida apunta hacia la izquierda o hacia la derecha. Haz modelos de los dos dibujos y verás que son exactamente iguales.
E3.10:

E3.11:

E3.12: El enlace C-O debe dibujarse como un guión para obtener la configuración R.
E3.13:

E3.14: El valor de c es 7.50 g/100 mL, por lo que usando la definición de rotación específica, se espera que la rotación observada sea (11.5) (7.5) = 86.3 o.
E3.15: La rotación observada de la mezcla es levorotaria (negativa, antihoraria), y la rotación específica del enantiómero R puro se da como dextrorotario (positivo, en sentido horario), lo que significa que el enantiómero S puro debe ser levorotario, y la mezcla debe contener más del enantiómero S que del enantiómero R.
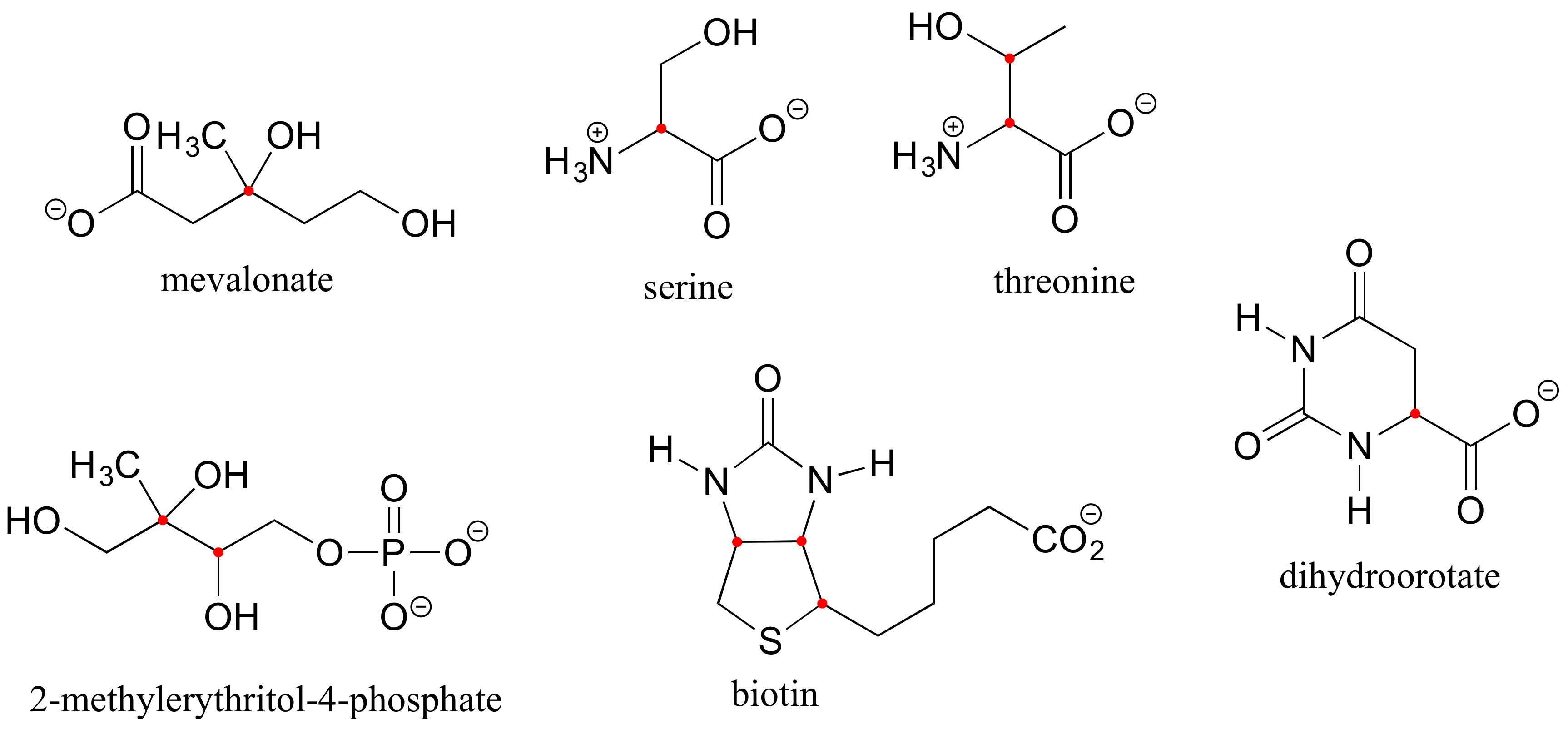
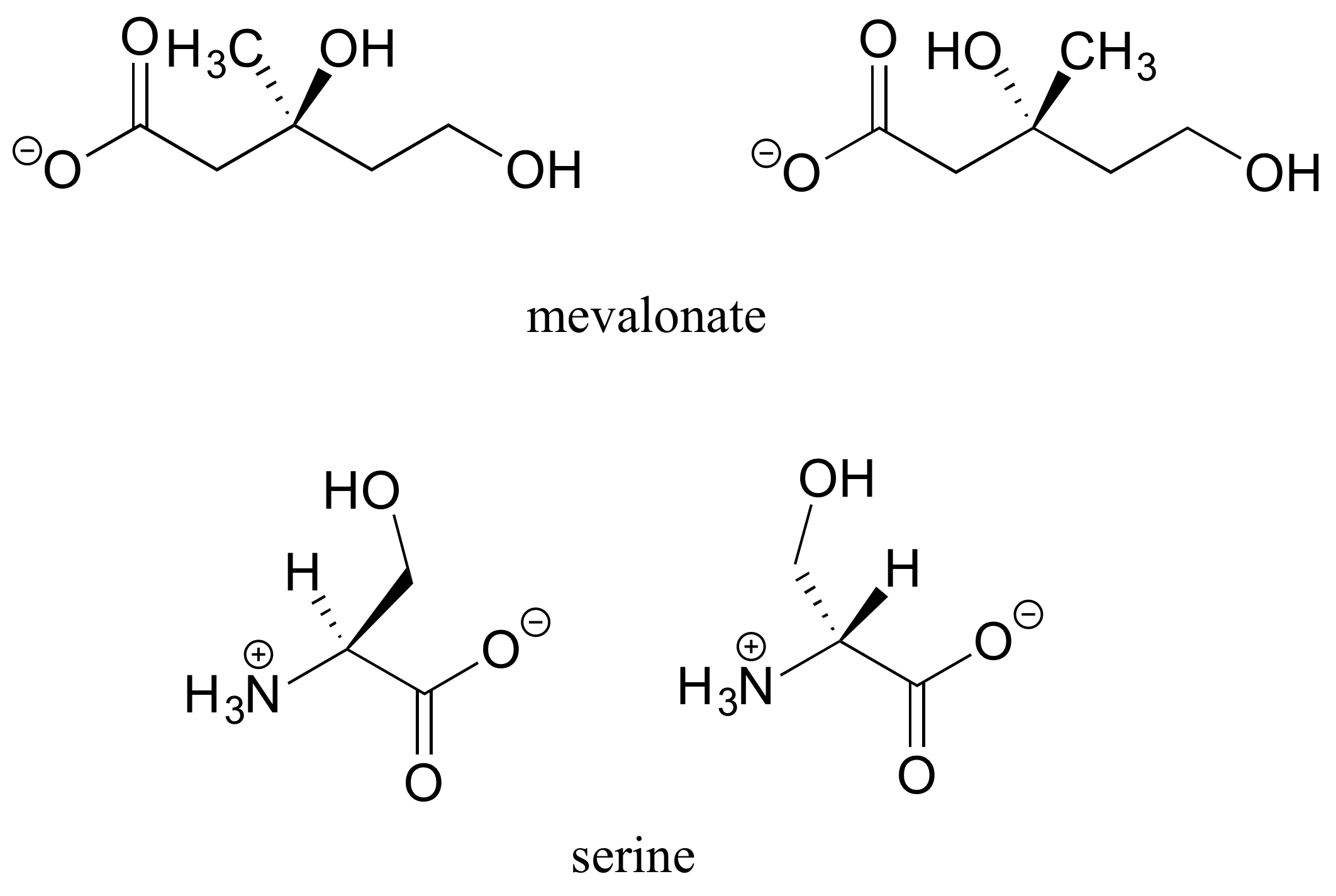
E3.16: La cisteína es el único L-aminoácido común con configuración S. Esto se debe únicamente a las reglas del sistema de nomenclatura: el carbono de la cadena lateral -que está directamente unido a un azufre- tiene mayor prioridad que el carbono carboxilato. En los otros 19 aminoácidos, el carbono carboxilato tiene prioridad #2, y el carbono de la cadena lateral tiene prioridad #3.
E3.17:
a) Comenzando con el estereoisómero RRR (que se da en el ejemplo), volteamos el primer y tercer centro quiral para obtener SRS. El enantiómero del estereoisómero SRS es aquel en el que los tres centros quirales están volteados: el estereoismero RSR.
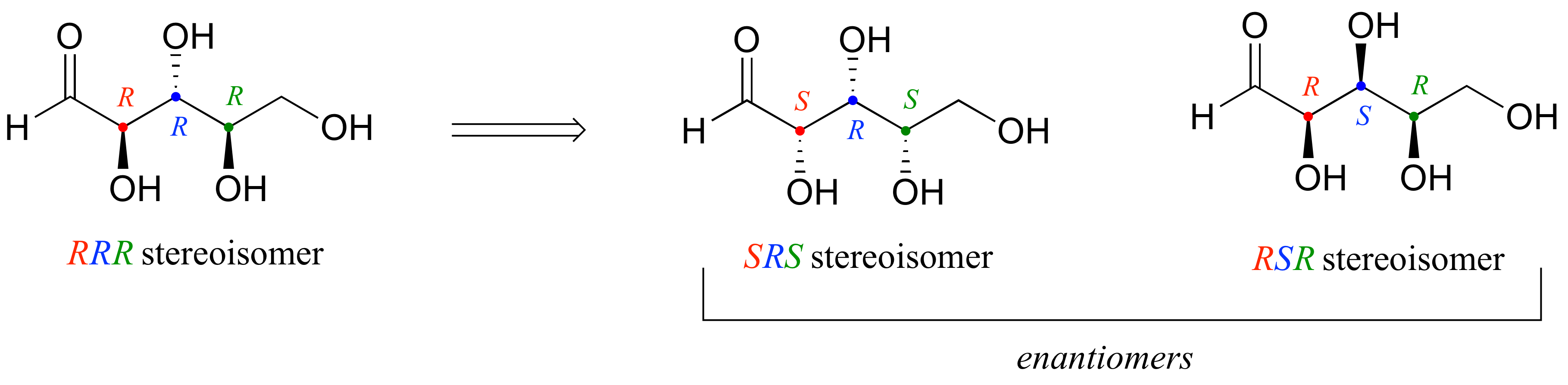
b) Los epímeros del estereoismero SRS son RRS, SSS y SRR (en cada caso, uno de los tres centros quirales ha sido volteado)
c) ¿Cómo encontrar los compuestos que son diastereómeros del estereoisómero SRS, pero no epímeros? Comienza con la lista de los ocho posibles estereoisómeros dados en el ejemplo. Tocar SRS en sí, y su enantiómero RSR (determinado en la parte (a) anterior). Después tachar los tres epímeros que encontramos en la parte (b). Nos quedan tres isómeros: RRR, SSR y RSS. Cada uno de estos tiene un centro quiral en común con SRS, y dos que están volteados.

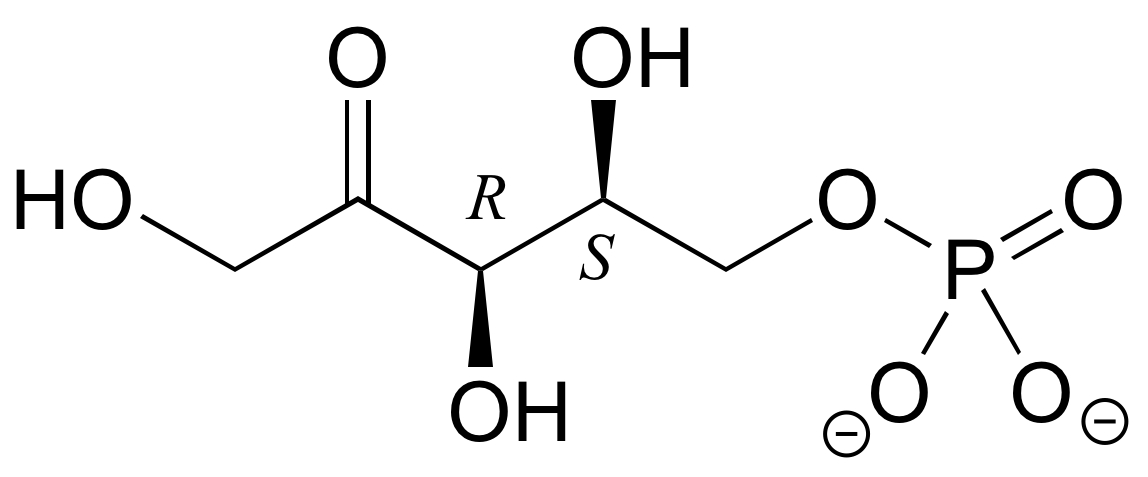
E3.18: Este es el estereoisómero SRR:

E3.19:
E3.20:
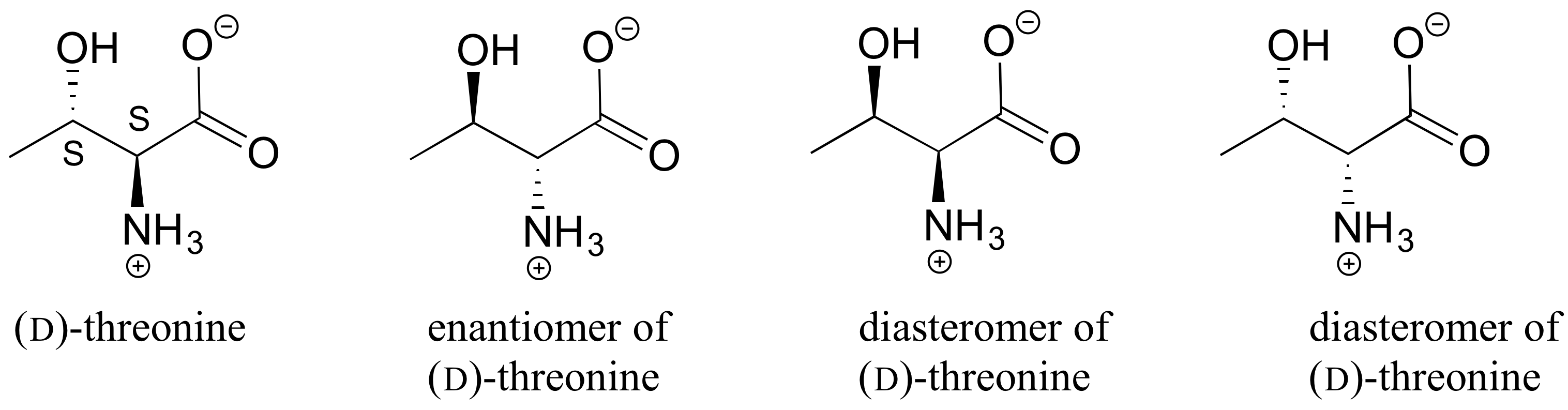
E3.21: Ir de izquierda a derecha, de arriba a abajo:
Diastereómeros (dos centros quirales están volteados).
Enantiómeros (los cinco centros quirales están volteados).
Idénticos (el dibujo se voltea verticalmente pero son de la misma estructura).
Idéntico (el carbono que parece estar volteado en el dibujo no es un centro quiral).
Isómeros constitucionales (misma fórmula molecular, pero notan que el inositol no tiene un anillo de oxígeno. No es un monosacárido, es un ciclohexano con seis sustituyentes hidroxilo).
E3.22:
a) Idéntico. Tienen la misma fórmula molecular y conectividad; solo hay un centro quiral, que es R en ambas estructuras.
b) Enantiómeros. El compuesto de la izquierda es R, el compuesto a la derecha es S.
c) Enantiómeros. El compuesto de la izquierda es R, el compuesto a la derecha es S.
d) Enantiómeros. El compuesto de la izquierda es SS, el compuesto a la derecha es RR.
e) Idéntico. Las estructuras son ambas glicerol, que no es quiral (los 'brazos' izquierdo y derecho son los mismos, por lo que el carbono medio no es un centro quiral)
f) Idéntico. Ambas estructuras son SS. Además, observe que si gira la estructura del lado derecho 120 grados en el sentido de las agujas del reloj, se vuelve exactamente igual que la estructura del lado izquierdo.
E3.23:
a) No meso b) Meso. c) No meso
d) Meso e) No meso f) Meso
E3.24:
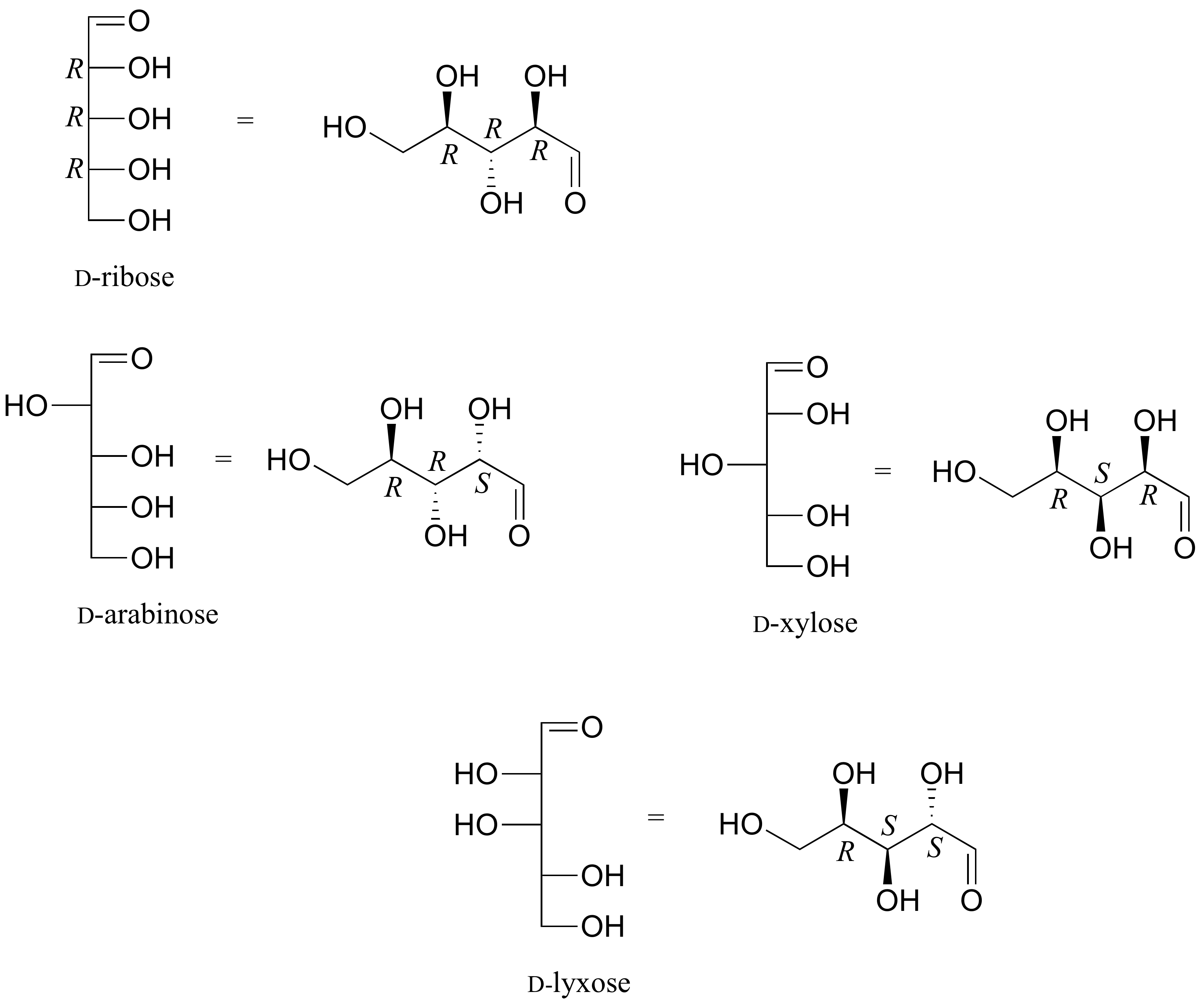
E3.25:
a) E b) N c) Z d) E
E3.26:
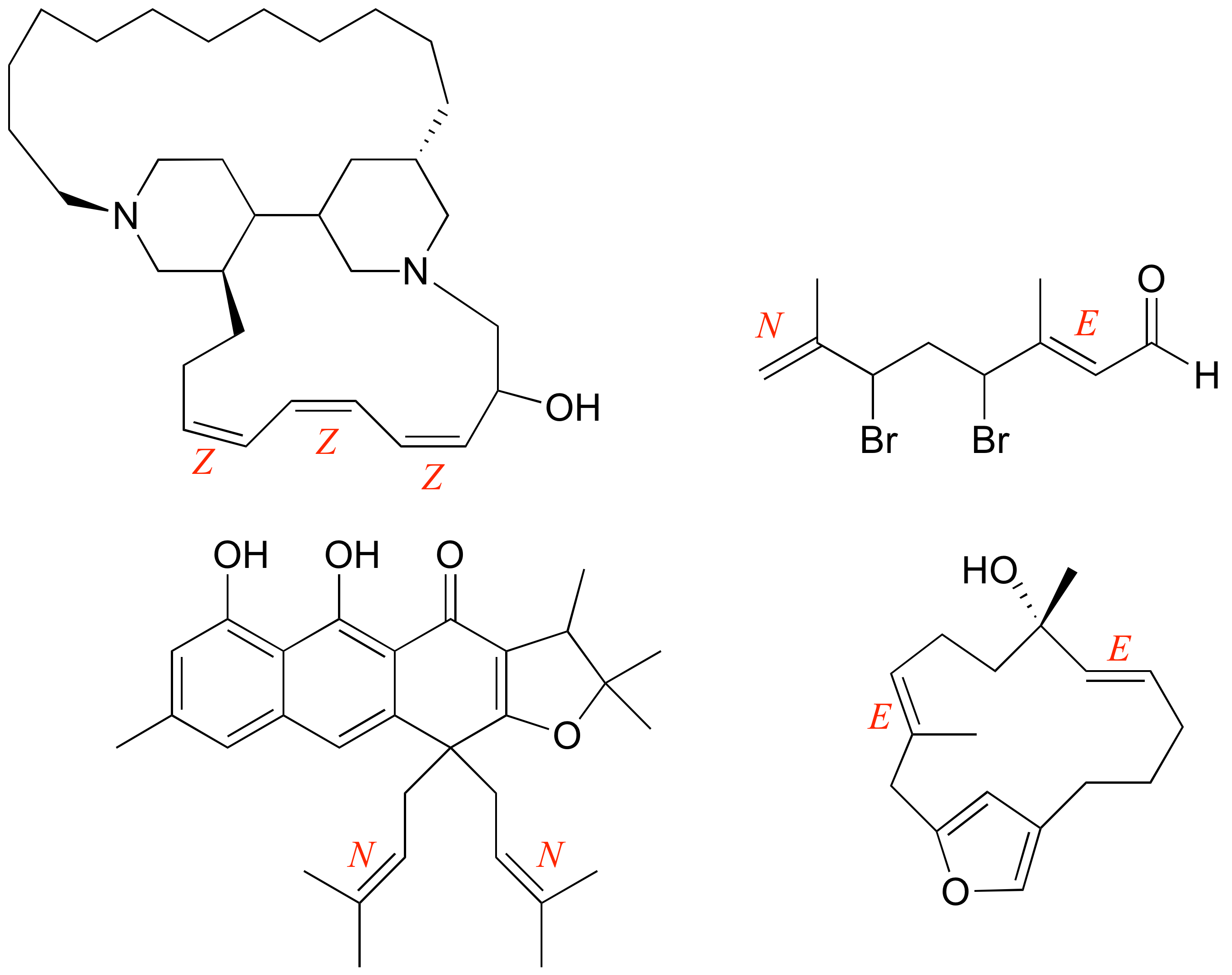
E3.27: Los enantiómeros de los compuestos mostrados están a continuación. Tenga en cuenta que los centros quirales están volteados, pero los alquenos estereogénicos no lo son.

E3.28:
La efedrina y la pseudoefedrina son diastereómeros (epímeros). Hay dos centros quirales, y uno de ellos (el OH) está volteado.
La metanfetamina y la levo-metanfetamina son enantiómeros (solo un centro quiral, y se voltea). La metanfetamina técnicamente debería llamarse dextro -metanfetamina.
E3.29:
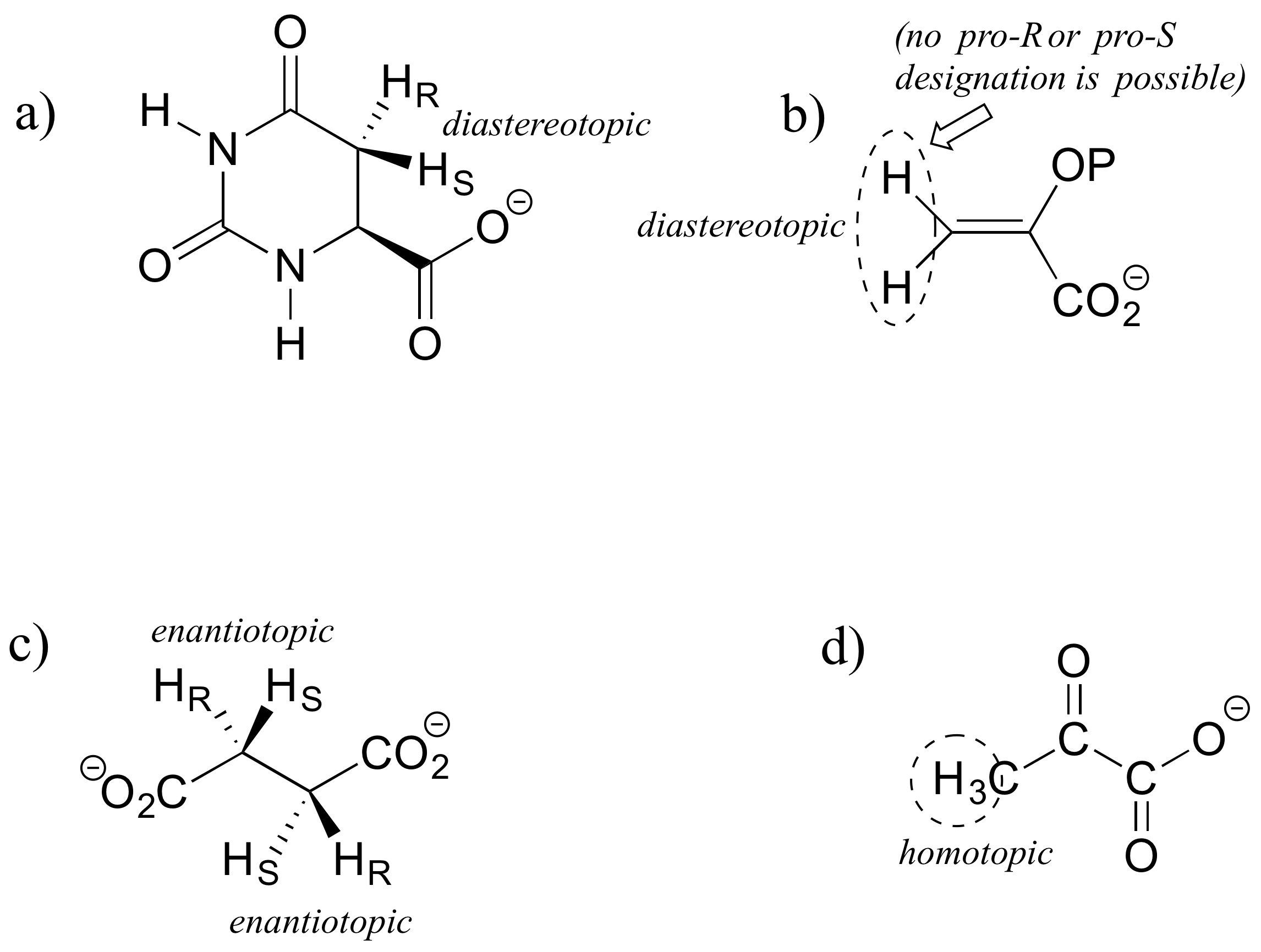
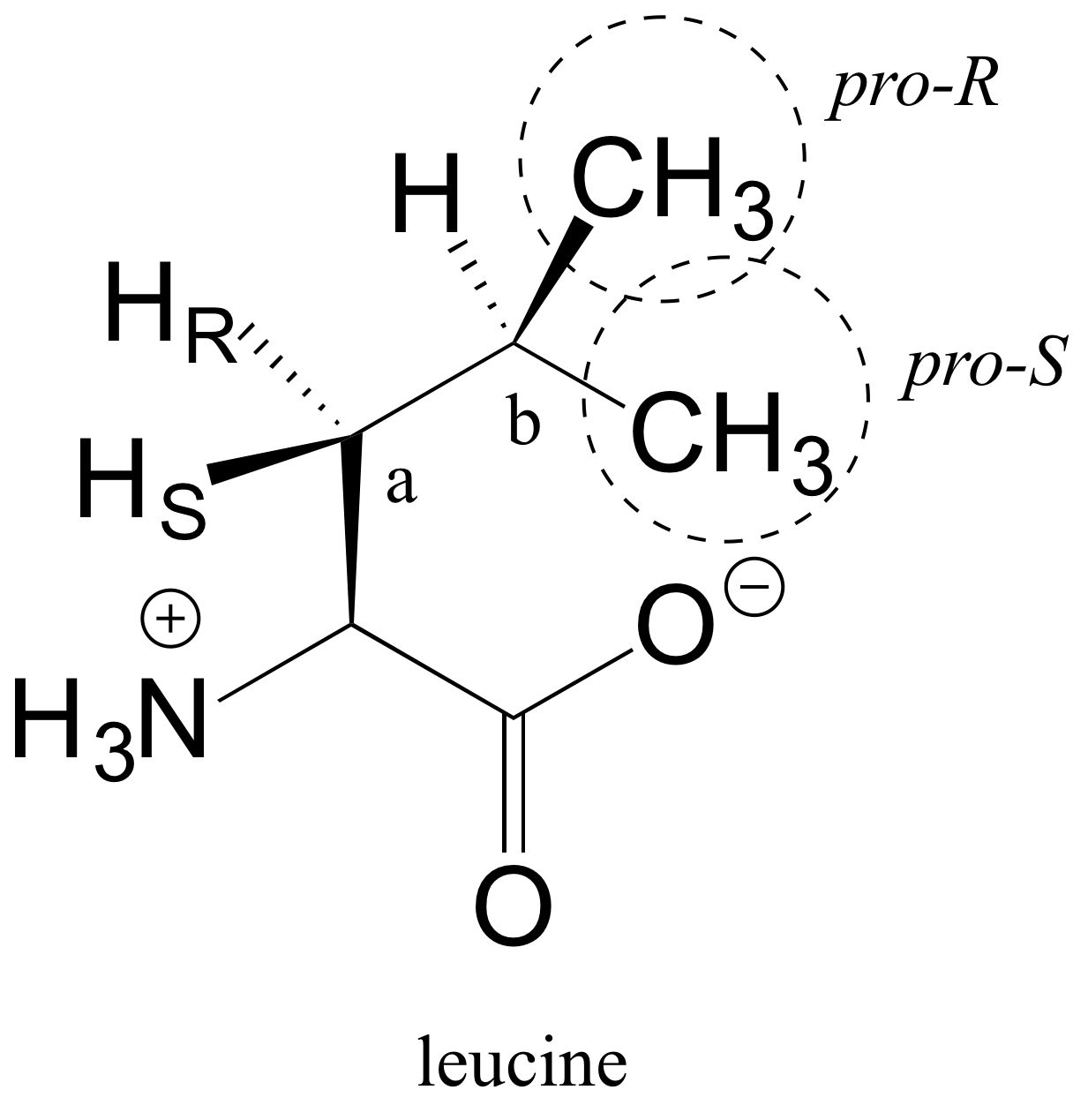
E3.30:
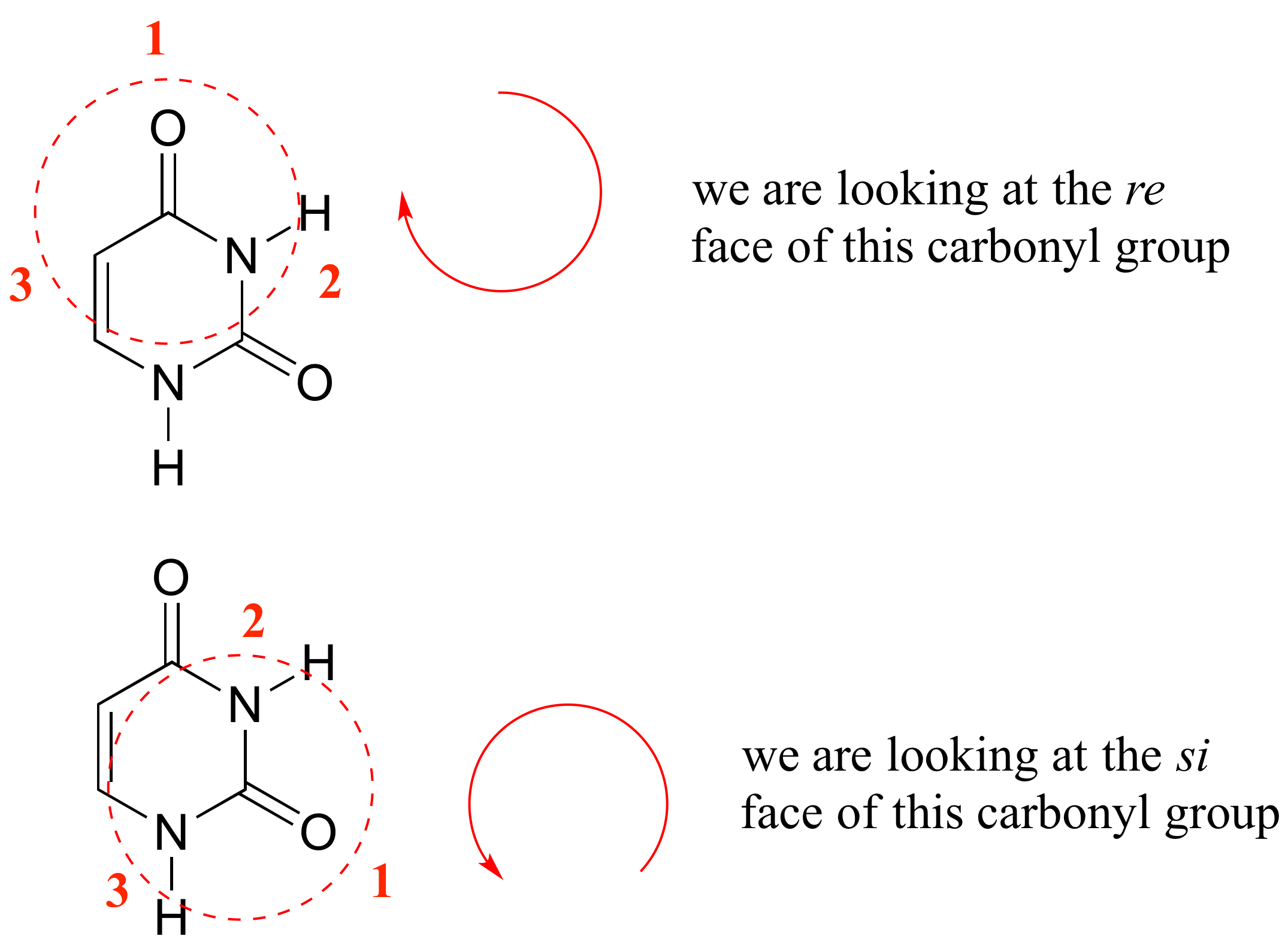
E3.31:
Colaboradores y Atribuciones
- Template:Soderberg
- Layne Morsch (University of Illinois Springfield)


