3.11: Estereoquímica en biología y medicina
- Page ID
- 72574
Si bien son desafiantes de entender y visualizar, los conceptos de estereoquímica que hemos explorado en este capítulo son parte integral del estudio de los seres vivos. La gran mayoría de las moléculas biológicas contienen centros quirales y/o grupos alquenos estereogénicos. Lo más importante es que las proteínas son quirales, lo que por supuesto incluye todas las enzimas que catalizan las reacciones químicas de una célula, los receptores que transmiten información dentro o entre las células, y los anticuerpos que se unen específicamente a invasores potencialmente dañinos. Sabes por tus clases de biología que las proteínas, debido a que se pliegan en una forma tridimensional específica, son capaces de reconocer muy específicamente y unirse a otras moléculas orgánicas. El ligando o sustrato unido por una proteína particular podría ser una molécula orgánica pequeña tal como piruvato hasta un biopolímero grande tal como una región específica de ADN, ARN u otra proteína. Debido a que son moléculas quirales, las proteínas son muy sensibles a la estereoquímica de sus ligandos: una proteína puede unirse específicamente al (R) -gliceraldehído, por ejemplo, pero no unirse al (S) -gliceraldehído, así como tu mano derecha no encajará en una pelota de béisbol zurda guante (ver final de capítulo para un enlace a una animación que ilustra este concepto).
El analgésico de venta libre ibuprofeno se vende actualmente como una mezcla racémica, pero solo el enantiómero S es efectivo, debido a la forma específica en que es capaz de unirse e inhibir la acción de la prostaglandina H 2 sintasa, una enzima en el proceso de respuesta a la inflamación del cuerpo.
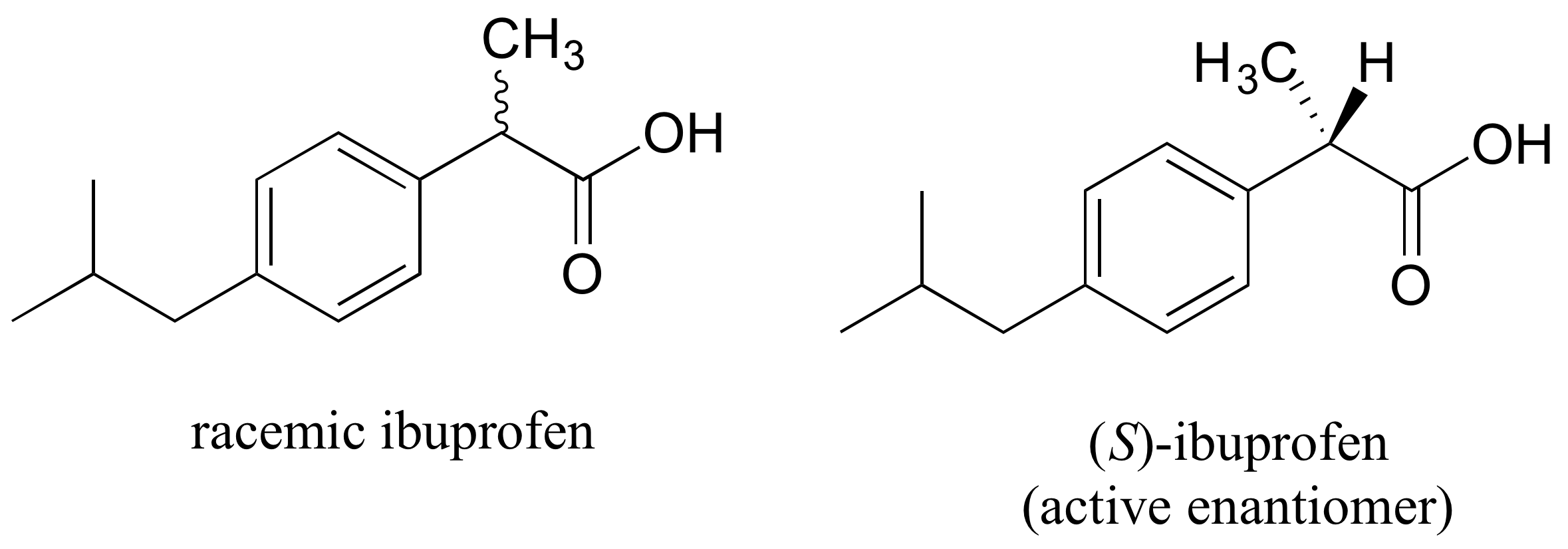
El enantiómero R del ibuprofeno no se une a la prostaglandina H 2 sintasa de la misma manera que el enantiómero S, y como consecuencia no ejerce el mismo efecto inhibidor sobre la acción de la enzima (ver Nature Chemical Biology 2011, 7, 803 para más detalles). Afortunadamente, el (R) -ibuprofeno aparentemente no causa ningún efecto secundario dañino, y de hecho es isomerizado gradualmente por una enzima en el cuerpo a (S) -ibuprofeno.
Anteriormente en este capítulo discutimos el trágico caso de la talidomida, y mencionamos que parece que es específicamente el enantiómero S el que causó defectos congénitos. En las últimas décadas se han hecho muchas propuestas diferentes para tratar de explicar el efecto teratogénico (causante de defectos de nacimiento) de la droga, pero una comprensión clara aún evade a la comunidad científica. En 2010, sin embargo, un equipo en Japón reportó evidencia de que la talidomida se une específicamente a una proteína llamada 'thereblon'. Además, cuando se bloquea la producción del mismo en peces cebra hembra, se producen defectos de desarrollo en su descendencia que son muy similares a los defectos causados por la administración de talidomida, señalando la probabilidad de que la unión de talidomida inactive de alguna manera la proteína, iniciando así la efecto teratogénico. (http://news.sciencemag.org/2010/03/t... -socio-crimen)
Puedes, con un viaje rápido a la tienda de abarrotes, experimentar directamente la importancia biológica del estereoisomería. La carvona es una molécula quiral derivada de plantas que contribuye al olor de la menta verde en forma R y a la comino (una especia) en la forma S.
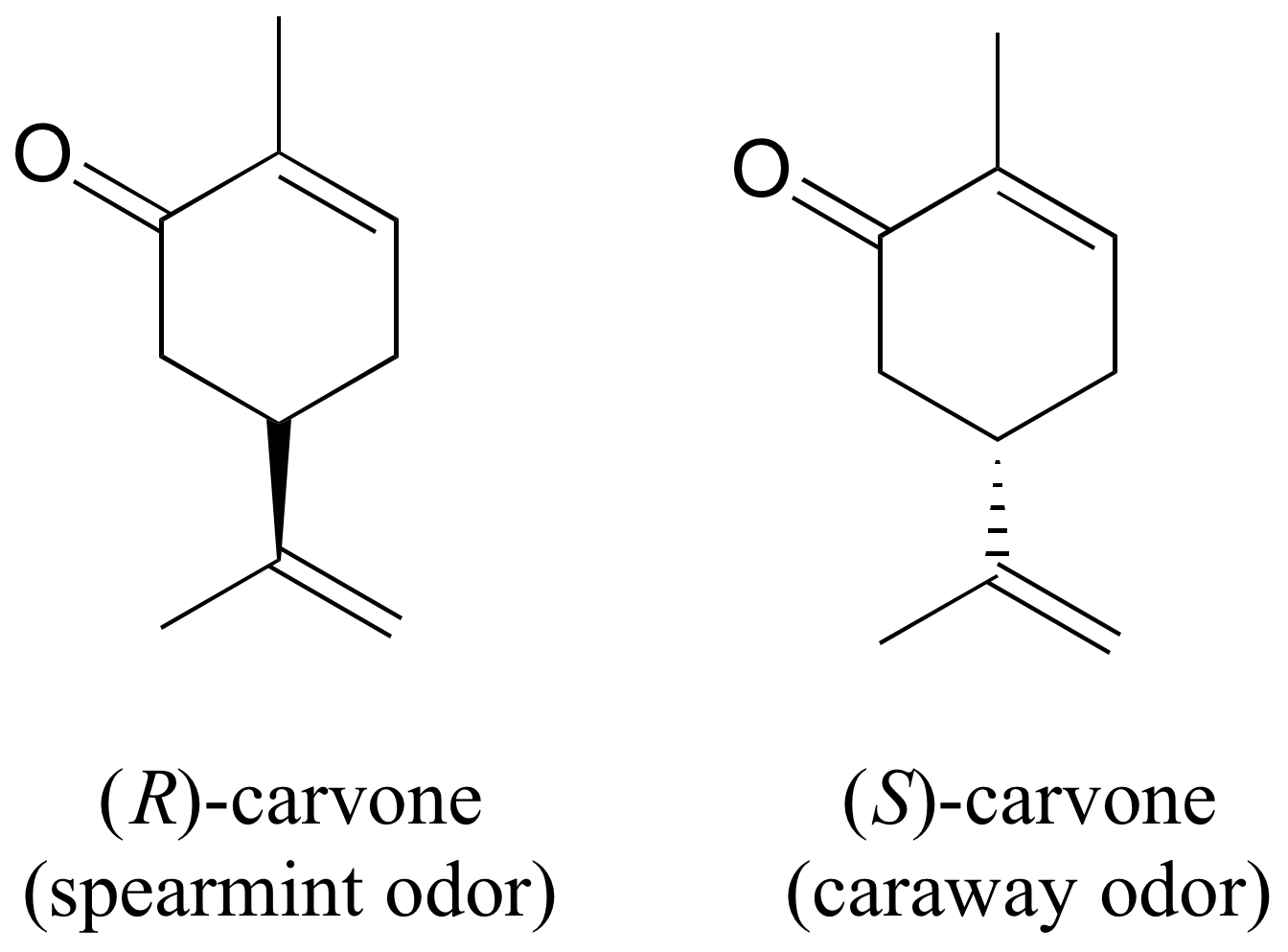
Aunque no se conocen los detalles, los dos enantiómeros presumiblemente interactúan de manera diferente con una o más proteínas receptoras del olfato en tu nariz, generando la transmisión de diferentes señales químicas al centro olfativo de tu cerebro.
La efedrina, que se encuentra en la medicina tradicional china ma huang, es un estimulante y supresor del apetito. Tanto la pseudoefedrina como la levometanfetamina son ingredientes activos en los descongestionantes nasales de venta libre. La metanfetamina es un estimulante altamente adictivo e ilegal, y generalmente se prepara en “laboratorios de metanfetamina” ilícitos utilizando pseudoefedrina como punto de partida.
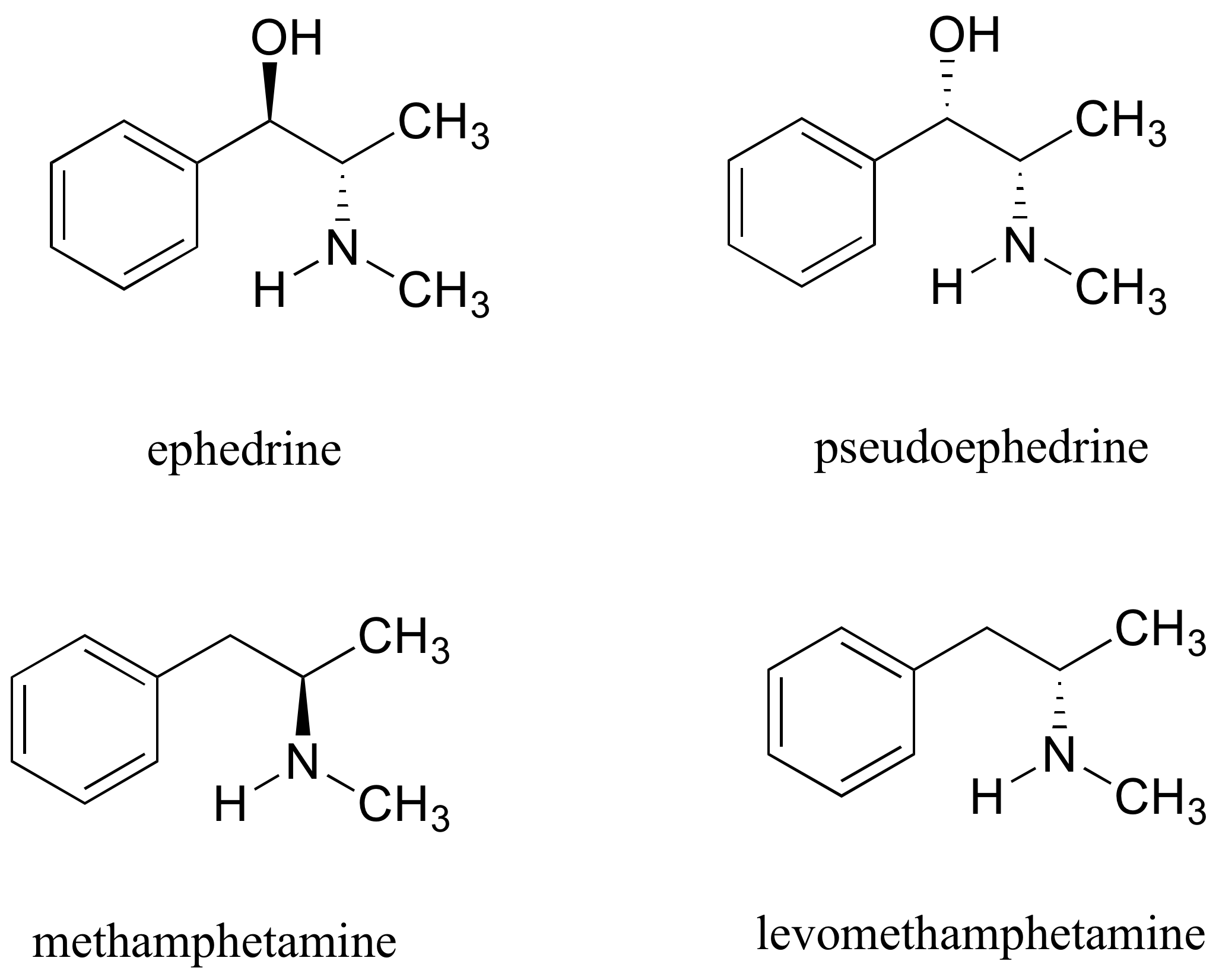
¿Cuál es la relación entre efedrina y pseudoefedrina? ¿Entre metanfetamina y levometanfetamina? ¿Entre pseudoefedrina y metanfetamina? Sus opciones son: no isómeros, isómeros constitucionales, diastereómeros, enantiómeros, o la misma molécula.
Soluciones a los ejercicios
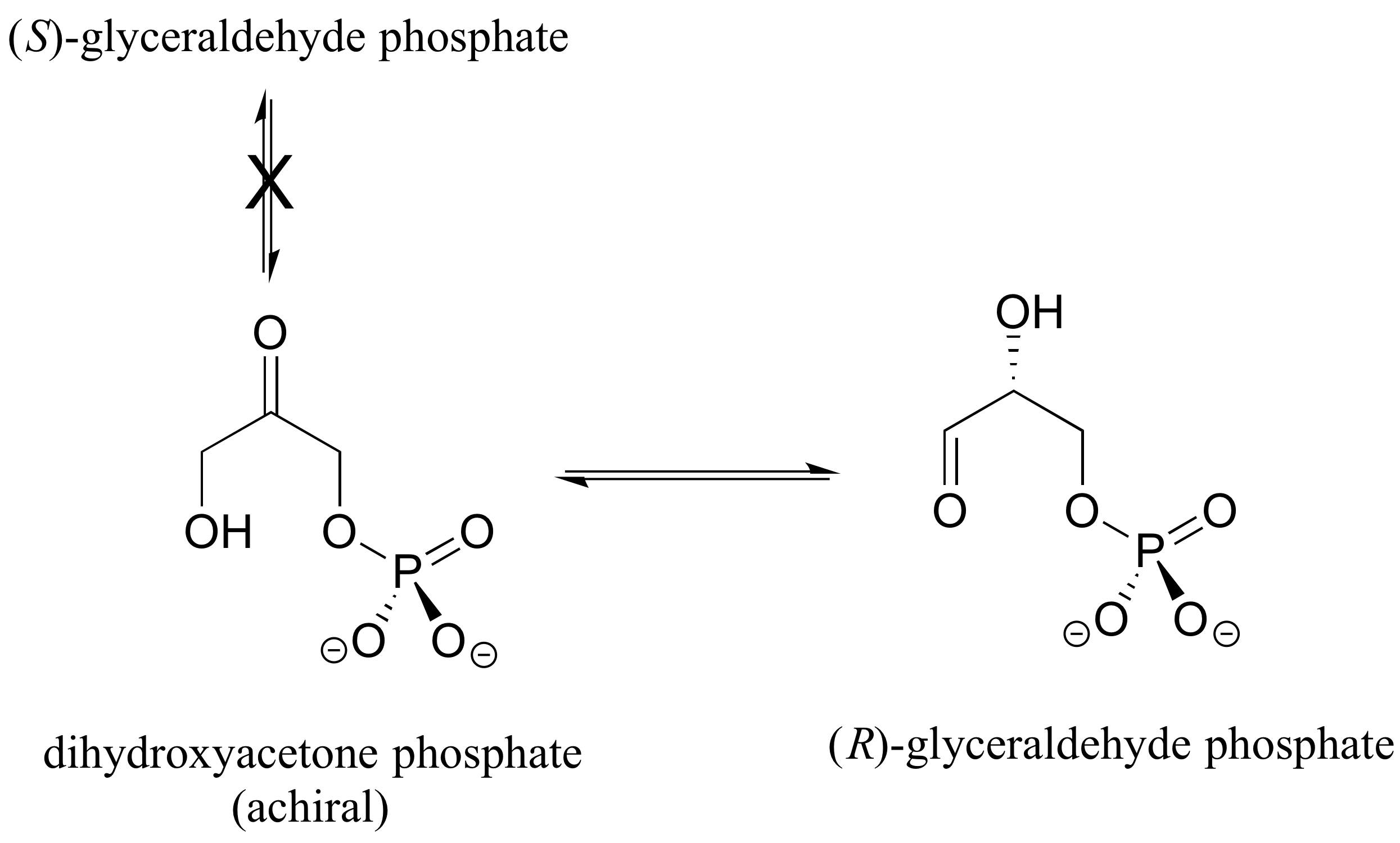
Las enzimas son muy específicas con respecto a la estereoquímica de las reacciones que catalizan. Cuando el producto de una reacción bioquímica contiene un centro quiral o un alqueno estereogénico, con muy pocas excepciones solo se forma un estereoisómero del producto. En la vía de la glucólisis, por ejemplo, la enzima triosa-fosfato isomerasa cataliza la interconversión reversible entre dihidroxiacetona (que es aquiral) y (R) -gliceraldehído fosfato. El enantiómero (S) -gliceraldehído no está formado por esta enzima en la reacción de izquierda a derecha, y no se usa como compuesto de partida en la reacción de derecha a izquierda, no 'encaja' en el sitio activo de la enzima.
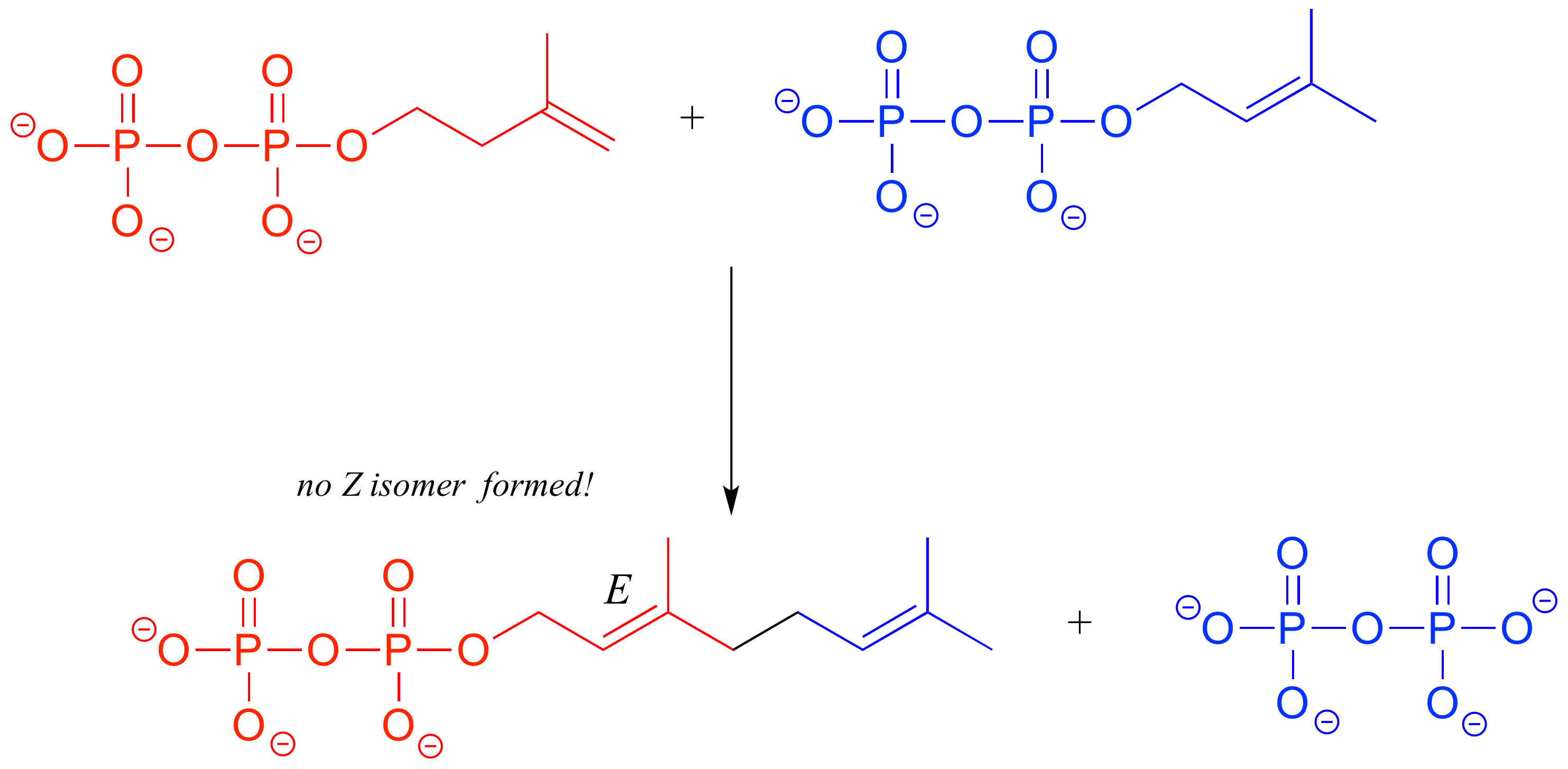
En la ruta de biosíntesis de isoprenoides, dos moléculas de bloque de construcción de cinco carbonos se combinan para formar una cadena de diez carbonos que contiene un grupo E-alqueno. La enzima no cataliza la formación del diastereómero Z.
En los capítulos 9-17 de este libro, y continuando en su estudio de la química biológica y orgánica, aprenderá cómo las enzimas son capaces de lograr estas hazañas de especificidad estereoquímica. Si tomas una clase más avanzada en síntesis orgánica, también aprenderás cómo los químicos de laboratorio están descubriendo formas ingeniosas de ejercer control sobre los resultados estereoquímicos de las reacciones no enzimáticas, un área de la química que es particularmente importante en la industria farmacéutica.


