4.4: Espectroscopia infrarroja
- Page ID
- 72053
Los enlaces covalentes en las moléculas orgánicas no son barras rígidas, sino que se comportan más como resortes. A temperatura ambiente, las moléculas orgánicas están siempre en movimiento, ya que sus enlaces se estiran, doblan y tuercen. Estas vibraciones complejas se pueden desglosar matemáticamente en modos vibratorios individuales, algunos de los cuales se ilustran a continuación.
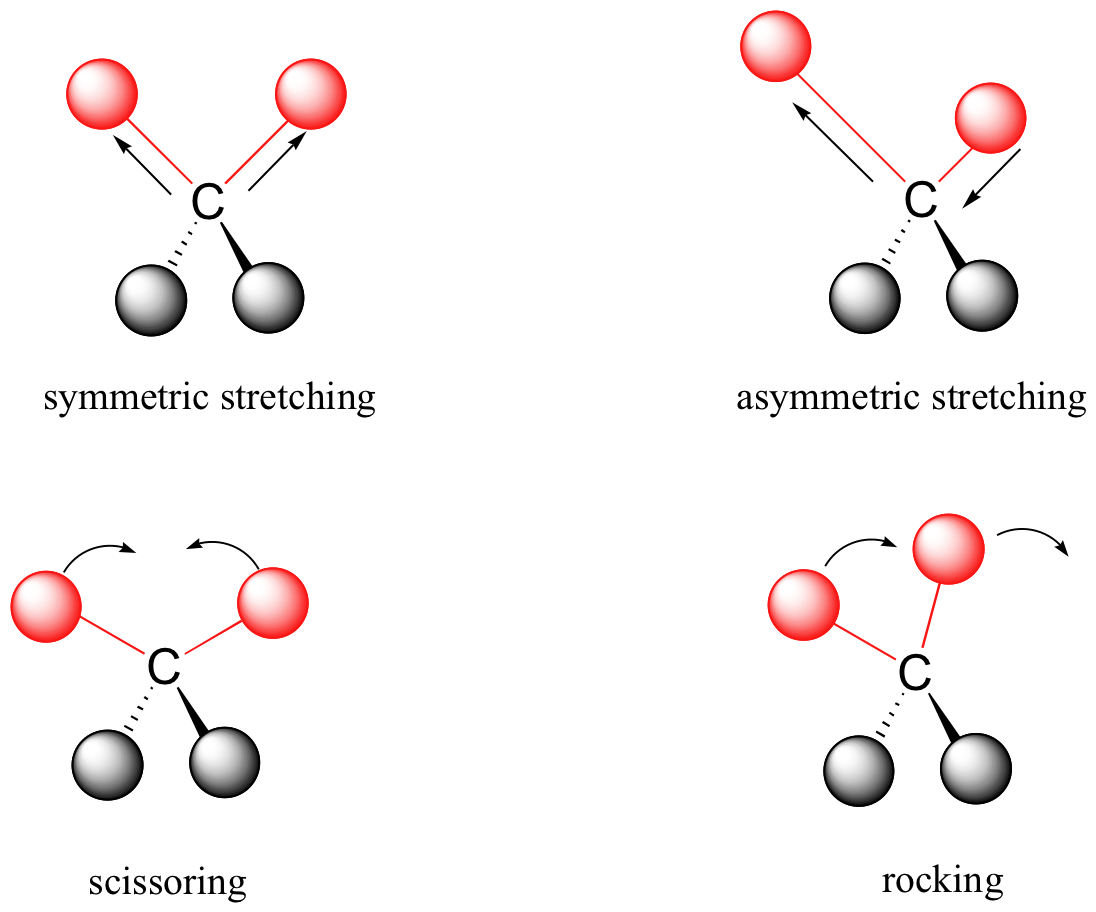
La energía de la vibración molecular se cuantifica en lugar de continua, lo que significa que una molécula solo puede estirarse y doblarse a ciertas frecuencias 'permitidas'. Si una molécula se expone a radiación electromagnética que coincide con la frecuencia de uno de sus modos vibracionales, en la mayoría de los casos absorberá energía de la radiación y saltará a un estado de energía vibracional más alto, lo que esto significa es que la amplitud de la vibración aumentará, pero la la frecuencia vibracional seguirá siendo la misma. La diferencia de energía entre los dos estados vibracionales es igual a la energía asociada a la longitud de onda de radiación que se absorbió. Resulta que es la región infrarroja del espectro electromagnético la que contiene frecuencias correspondientes a las frecuencias vibracionales de los enlaces orgánicos.
Tomemos como ejemplo la 2-hexanona. Imagínese el enlace carbonilo del grupo cetona como un resorte que constantemente rebota de un lado a otro, estirando y comprimiendo, separando más los átomos de carbono y oxígeno y luego uniéndolos. Este es el modo de estiramiento del enlace carbonilo. En el espacio de un segundo, el resorte 'rebota' hacia adelante y hacia atrás 5.15 x 10 13 veces - en otras palabras, la frecuencia en estado fundamental del estiramiento de carbonilo para un grupo cetona es de aproximadamente 5.15 x 10 13 Hz.
Si nuestra muestra de cetonas es irradiada con luz infrarroja, el enlace carbonilo absorberá específicamente la luz con esta misma frecuencia, que por las ecuaciones 4.1 y 4.2 corresponde a una longitud de onda de 5.83 x 10 -6 m y una energía de 4.91 kcal/mol. Cuando el enlace carbonilo absorbe esta energía, salta hasta un estado vibratorio excitado.
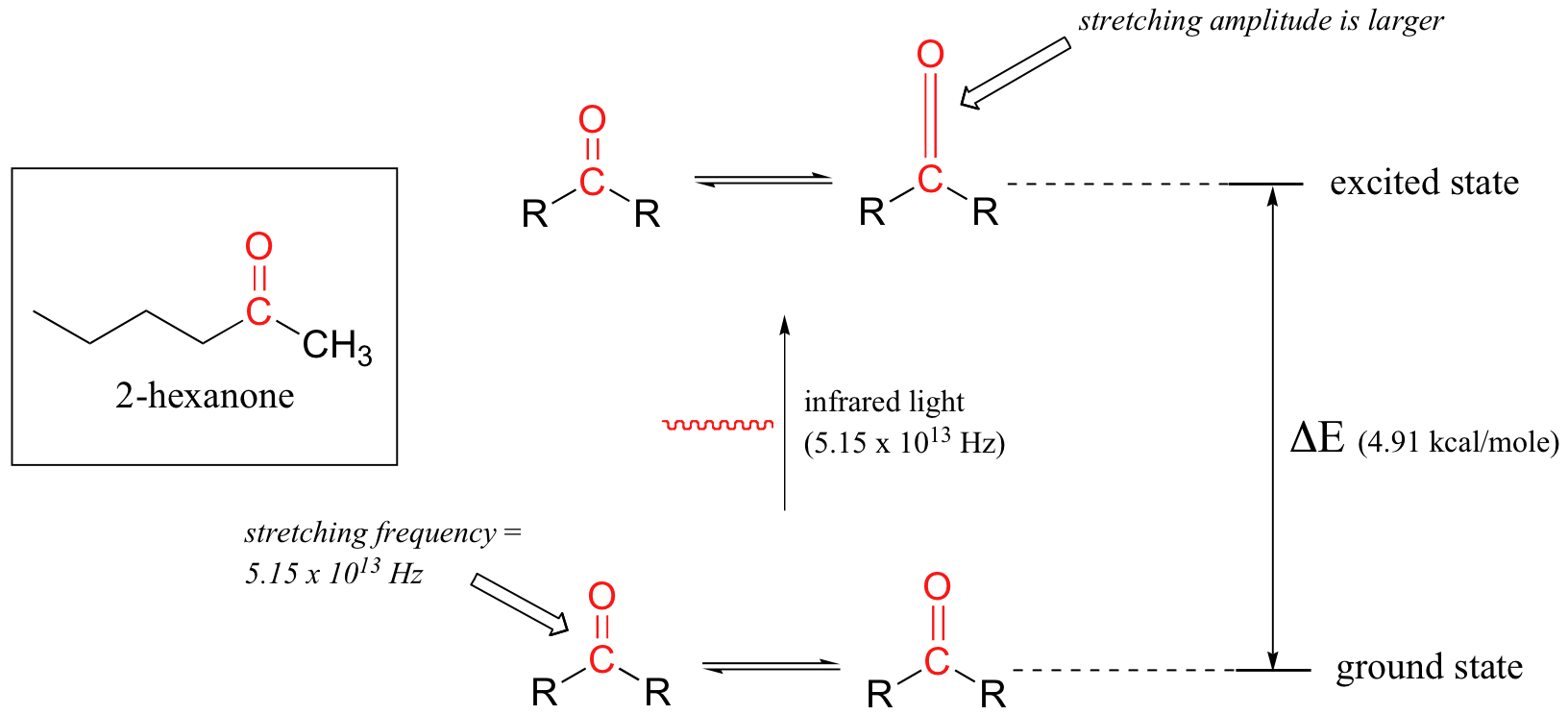
El valor de Δ E - la diferencia de energía entre los estados vibracionales de baja energía (tierra) y alta energía (excitada) - es igual a 4.91 kcal/mol, lo mismo que la energía asociada a la frecuencia de luz absorbida. La molécula no permanece en su estado vibratorio excitado por mucho tiempo, sino que libera rápidamente energía al ambiente circundante en forma de calor, y regresa al estado fundamental.
Con un instrumento llamado espectrofotómetro infrarrojo, podemos 'ver' esta transición vibracional. En el espectrofotómetro, la luz infrarroja con frecuencias que van desde aproximadamente 10 13 a 10 14 Hz se pasa a través de nuestra muestra de ciclohexano. La mayoría de las frecuencias pasan a través de la muestra y son registradas por un detector en el otro lado.
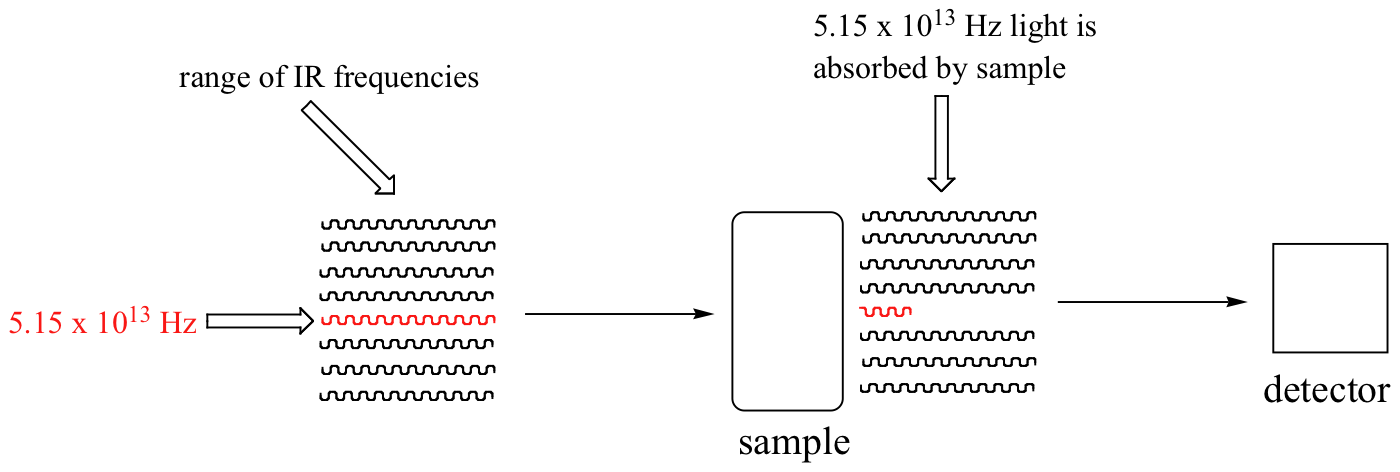
Nuestra frecuencia de estiramiento de carbonilo de 5.15 x 10 13 Hz, sin embargo, es absorbida por la muestra de 2-hexanona, por lo que el detector registra que la intensidad de esta frecuencia, después de haber pasado por la muestra, es algo menor que el 100% de su intensidad inicial.
Las vibraciones de una molécula de 2-hexanona no se limitan, por supuesto, al simple estiramiento del enlace carbonilo. Los diversos enlaces carbono-carbono también se estiran y se doblan, al igual que los enlaces carbono-hidrógeno, y todos estos modos vibracionales también absorben diferentes frecuencias de luz infrarroja.
El poder de la espectroscopia infrarroja surge de la observación de que diferentes grupos funcionales tienen diferentes frecuencias de absorción características. El enlace carbonilo en una cetona, como vimos con nuestro ejemplo de 2-hexanona, normalmente absorbe en el rango de 5.11 - 5.18 x 10 13 Hz, dependiendo de la molécula. El triple enlace carbono-carbono de un alquino, por otro lado, absorbe en el rango 6.30 - 6.80 x 10 13 Hz. Por lo tanto, la técnica es muy útil como medio para identificar qué grupos funcionales están presentes en una molécula de interés. Si pasamos luz infrarroja a través de una muestra desconocida y encontramos que absorbe en el rango de frecuencia carbonilo pero no en el rango de alquino, podemos inferir que la molécula contiene un grupo carbonilo pero no un alquino.
Algunos enlaces absorben la luz infrarroja con más fuerza que otros, y algunos enlaces no absorben en absoluto. Para que un modo vibracional absorba la luz infrarroja, debe resultar en un cambio periódico en el momento dipolar de la molécula. Se dice que tales vibraciones son activas por infrarrojos. En general, cuanto mayor es la polaridad del enlace, más fuerte es su absorción IR. El enlace carbonilo es muy polar, y absorbe muy fuertemente. El triple enlace carbono-carbono en la mayoría de los alquinos, en contraste, es mucho menos polar, y por lo tanto una vibración de estiramiento no da como resultado un gran cambio en el momento dipolar general de la molécula. Los grupos alquinos absorben bastante débilmente en comparación con los carbonilos.
Algunos tipos de vibraciones son inactivas por infrarrojos. Las vibraciones de estiramiento de dobles y triples enlaces completamente simétricos, por ejemplo, no dan como resultado un cambio en el momento dipolar, y por lo tanto no resultan en ninguna absorción de luz (pero otros enlaces y modos vibratorios en estas moléculas sí absorben la luz IR).
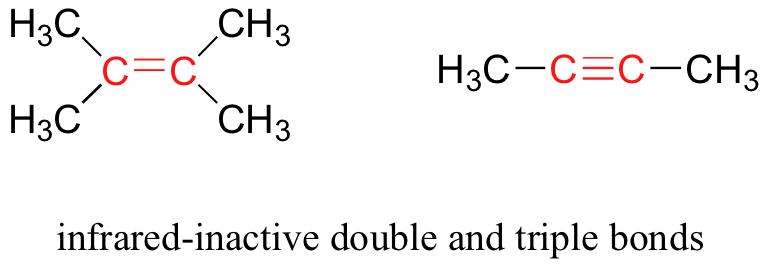
Ahora, veamos algunos resultados reales de experimentos de espectroscopia IR. A continuación se muestra el espectro IR para 2-hexanona.
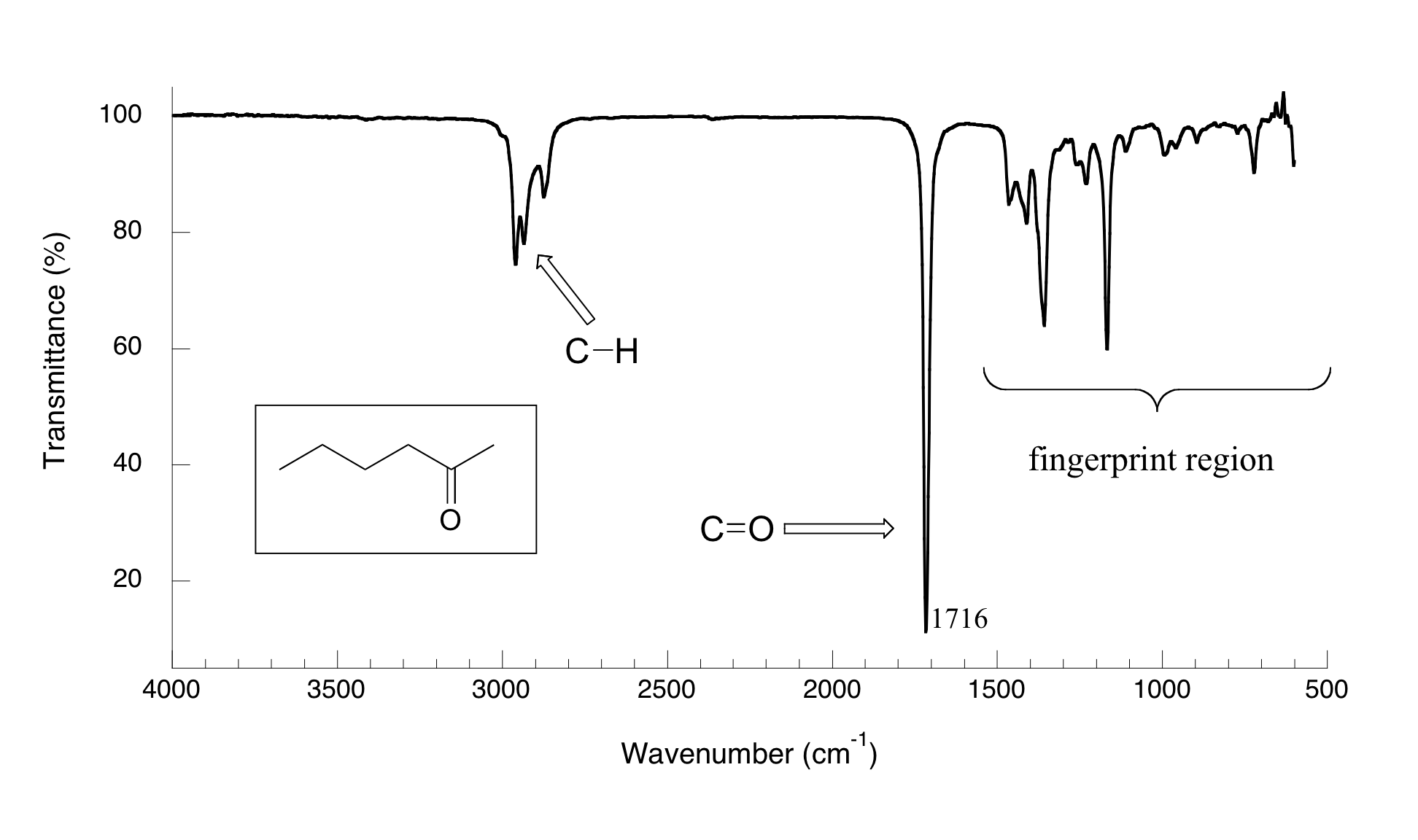
Hay una serie de cosas que hay que explicar para que entiendas qué es lo que estamos viendo. En el eje horizontal vemos longitudes de onda IR expresadas en términos de una unidad llamada número de onda (cm -1), que nos dice cuántas ondas caben en un centímetro. En el eje vertical vemos '% transmitancia', lo que nos dice con qué intensidad se absorbió la luz en cada frecuencia (100% de transmitancia significa que no se produjo absorción a esa frecuencia). La línea continua traza los valores de% de transmitancia para cada longitud de onda: los 'picos' (que en realidad apuntan hacia abajo) muestran regiones de fuerte absorción. Por alguna razón, es típico en la espectroscopia IR reportar valores de número de onda en lugar de longitud de onda (en metros) o frecuencia (en Hz). El eje vertical “al revés”, con picos de absorbancia apuntando hacia abajo en lugar de hacia arriba, es también una curiosa convención en espectroscopia IR. ¡No queremos facilitarte las cosas!
El pico clave de absorción en este espectro es el del doble enlace carbonilo, a 1716 cm -1 (correspondiente a una longitud de onda de 5.86 mm, una frecuencia de 5.15 x 10 13 Hz y un valor Δ E de 4.91 kcal/mol). Observe lo fuerte que es este pico, en relación con los demás en el espectro: un pico fuerte en la región de 1650-1750 cm -1 es un regalo muerto por la presencia de un grupo carbonilo. Dentro de ese rango, los ácidos carboxílicos, ésteres, cetonas y aldehídos tienden a absorber en el extremo de longitud de onda más corta (1700-1750 cm-1), mientras que las cetonas y amidas insaturadas conjugadas tienden a absorber en el extremo de longitud de onda más larga (1650-1700 cm -1).
El pico dentado a aproximadamente 2900-3000 cm -1 es característico de los enlaces carbono-hidrógeno tetraédricos. Este pico no es terriblemente útil, ya que casi todas las moléculas orgánicas que tendrás ocasión de analizar tienen estos vínculos. Sin embargo, puede servir como un punto de referencia familiar para orientarse en un espectro.
Notará que hay muchos picos adicionales en este espectro en la región de longitud de onda más larga de 400 -1400 cm -1. Esta parte del espectro se llama región de huella digital. Si bien suele ser muy difícil seleccionar alguna identificación específica de grupos funcionales de esta región, sí, sin embargo, contiene información valiosa. La razón de esto lo sugiere el nombre: al igual que una huella humana, el patrón de picos de absorbancia en la región de la huella dactilar es único para cada molécula, lo que significa que los datos de una muestra desconocida pueden compararse con los espectros IR de estándares conocidos para hacer una identificación positiva. Fue la región de huellas IR de la sospechosa pintura amarilla la que permitió su identificación como un pigmento que posiblemente no pudo haber sido utilizado por el supuesto artista, William Aiken Walker.
Ahora, echemos un vistazo al espectro IR para 1-hexanol.
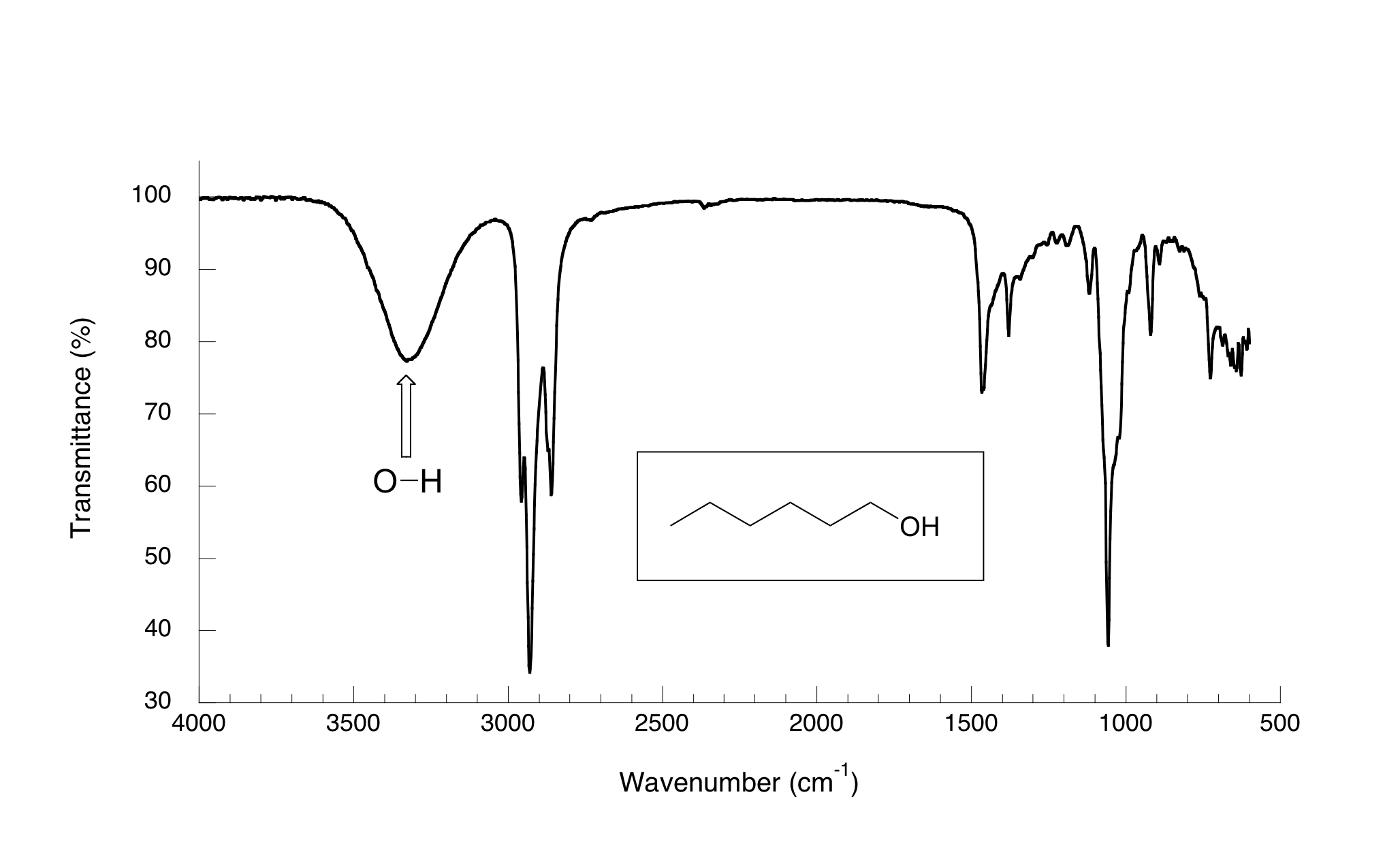
Como se puede ver, el pico de carbonilo se ha ido, y en su lugar se encuentra una 'montaña' muy ancha centrada a unos 3400 cm -1. Esta señal es característica del modo de estiramiento O-H de los alcoholes, y es un regalo muerto por la presencia de un grupo alcohol. La amplitud de esta señal es consecuencia del enlace de hidrógeno entre las moléculas.
En el espectro del ácido octanoico vemos, como era de esperar, el pico característico de carbonilo, esta vez a 1709 cm -1.
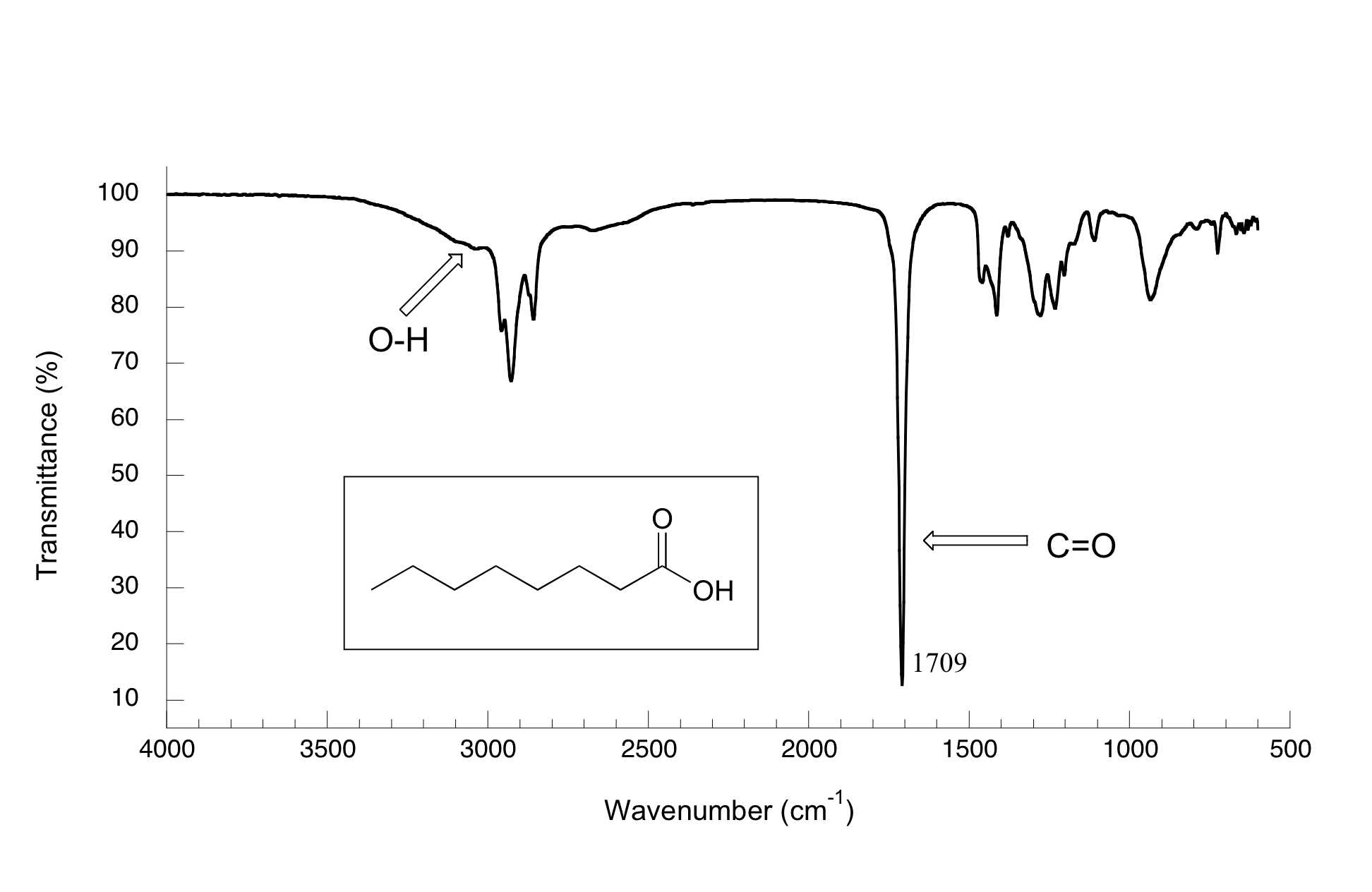
También vemos una banda de absorbancia baja y amplia que parece un alcohol, excepto que se desplaza ligeramente hacia el lado derecho (longitud de onda larga) del espectro, lo que hace que se superponga en cierta medida con la región C-H. Esta es la absorbancia característica de estiramiento de enlace sencillo O-H de ácido carboxílico.
El espectro para 1-octeno muestra dos picos que son característicos de los alquenos: el de 1642 cm -1 se debe al estiramiento del doble enlace carbono-carbono, y el de 3079 cm-1 se debe al estiramiento del enlace s entre los carbonos alquenos y sus hidrógenos unidos.
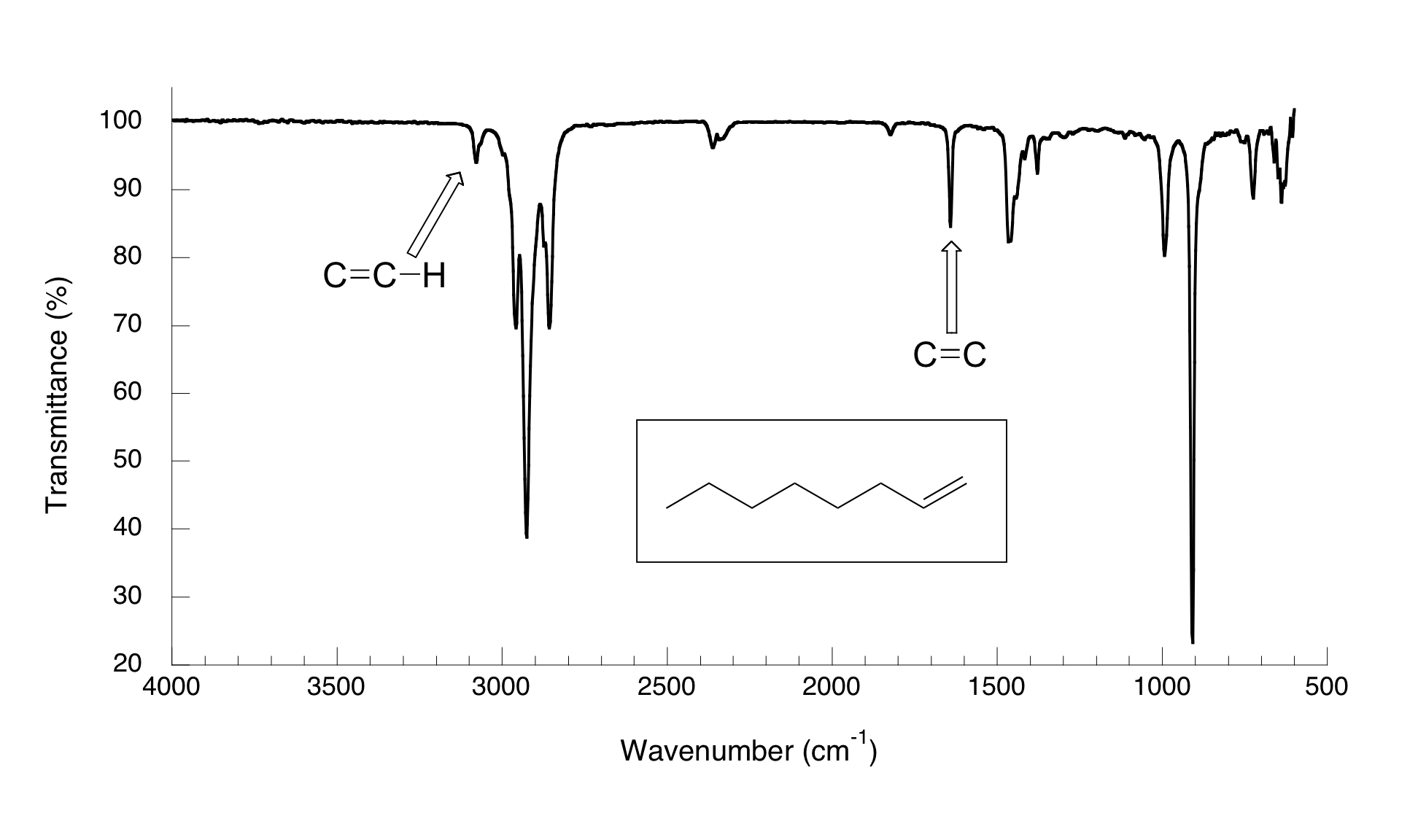
Los alquinos tienen picos característicos de absorbancia IR en el rango de 2100-2250 cm -1 debido al estiramiento del triple enlace carbono-carbono, y los alquenos terminales pueden identificarse por su absorbancia a aproximadamente 3300 cm-1, debido al estiramiento del enlace entre el carbono hibridado SP y el hidrógeno terminal.
Explique cómo podría usar las frecuencias de estiramiento C-C y C-H en los espectros IR para distinguir entre cuatro isómeros constitucionales: 1,2-dimetilciclohexeno, 1,3-octadieno, 3-octina y 1-octina.
Ejercicio 4.7
Usando la base de datos espectral en línea para compuestos orgánicos, busque los espectros IR para los siguientes compuestos e identifique las bandas de absorbancia correspondientes a las enumeradas en la tabla anterior. Enumere las frecuencias reales para cada señal a la unidad cm -1 más cercana, utilizando la información en las tablas proporcionadas en el sitio.
a) 1-metilciclohexanol
b) 4-metilciclohexeno
c) 1-hexino
d) 2-hexino
e) 3-hexino-2,5-diol
Ejercicio 4.8
Un enlace simple carbono-carbono absorbe en la región de la huella dactilar, y ya hemos visto las longitudes de onda de absorción características de los dobles y triples enlaces carbono-carbono. Racionalizar la tendencia en longitudes de onda. (Pista - recuerda, estamos pensando en los vínculos como resortes, y mirando la frecuencia a la que 'rebotan').
Soluciones
Es posible identificar otros grupos funcionales como aminas y éteres, pero los picos característicos para estos grupos son considerablemente más sutiles y/o variables, y a menudo se superponen con picos de la región de la huella dactilar. Por esta razón, limitaremos nuestra discusión aquí a los grupos funcionales más fácilmente reconocidos, los cuales se resumen en la tabla 1 en la sección de tablas al final del texto.
Como puedes imaginar, obtener un espectro IR para un compuesto no nos permitirá averiguar la estructura completa ni siquiera de una molécula simple, a menos que tengamos un espectro de referencia para la comparación. En conjunto con otros métodos analíticos, sin embargo, la espectroscopia IR puede resultar una herramienta muy valiosa, dada la información que proporciona sobre la presencia o ausencia de grupos funcionales clave. IR también puede ser una forma rápida y conveniente para que un químico verifique si una reacción ha procedido según lo planeado. Si tuviéramos que ejecutar una reacción en la que quisiéramos convertir la ciclohexanona en ciclohexanol, por ejemplo, una comparación rápida de los espectros IR del compuesto de partida y del producto nos indicaría si habíamos convertido con éxito el grupo cetona en un alcohol (este tipo de reacción se discute en detalle en el capítulo 15.
Tutoriales en video de Khan Academy sobre espectroscopia infrarroja


