8.5: Grupos de salida
- Page ID
- 72720
A continuación, investigamos qué hace que un buen grupo se vaya. Es realmente bastante sencillo: todo lo que aprendimos en el capítulo 7 sobre la evaluación de la fuerza base se aplicará a los grupos que abandonan:
Las bases más débiles son mejores dejando grupos
En nuestra discusión general sobre las reacciones de sustitución nucleofílica, hasta ahora hemos estado usando el ion cloruro como nuestro grupo de salida común. Los cloruros de alquilo son efectivamente reactivos comunes en las reacciones de sustitución nucleofílica de laboratorio, al igual que los bromuros de alquilo y los yoduros de alquilo. El yoduro, que es el menos básico de los cuatro haluros comunes (\(F\)\(Cl\),\(Br\), y\(I\)), es el mejor grupo de salida entre ellos. El fluoruro es el grupo de salida menos efectivo entre los haluros, ya que el anión fluoruro es el más básico. Esta regla se aplica a ambos\(S_N2\) y\(S_N1\) reacciones, ya que en ambos casos el paso determinante de la velocidad implica la pérdida del grupo de salida.
mejor grupo de salida\(I\) - >\(Br\) - >\(Cl\) - >\(F\) - peor grupo que sale
Esta tendencia es evidente cuando se comparan las tasas relativas de\(S_N2\) reacciones de cuatro halometanos con un nucleófilo común y disolvente: el yodometano reacciona más rápido, el fluorometano el más lento.
\(S_N2\)reacción más rápida\(CH_3I\)\(CH_3Br\) > >\(CH_3Cl\) >\(SN_2\) reacción\(CH_3F\) más lenta
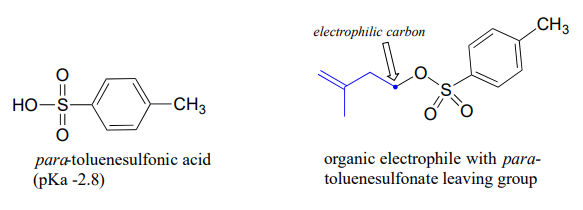
La base conjugada del ácido toluensulfónico es un grupo lábil comúnmente utilizado en el laboratorio de síntesis orgánica. El ácido toluensulfónico es un ácido orgánico fuerte con un\(pK_a\) de -2.8, por lo que su base conjugada es una base débil y un excelente grupo lábil.
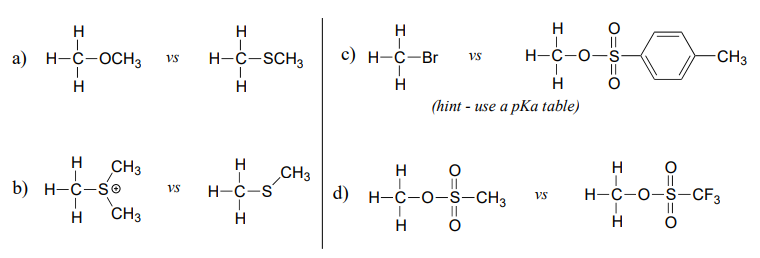
En cada par (A y B) a continuación, ¿qué electrófilo se esperaría que reaccionara más rápidamente con nucleófilo de ion cianuro en solvente de acetona? Explica tu razonamiento.
Comenzando más adelante en este capítulo y a lo largo del resto de nuestro estudio de la reactividad orgánica, veremos ejemplos de 'activación' del grupo de salida: en otras palabras, la conversión de una base fuerte/grupo de salida pobre en una base débil/grupo de salida bueno. En algunos casos esto es tan simple como la protonación: un grupo ácido puede posicionarse en el sitio activo con el fin de protonar un grupo saliente pobre (por ejemplo, ion hidróxido en el caso de un alcohol) a medida que sale, convirtiéndolo así en una base débil y un buen grupo lábil. En muchas otras reacciones enzimáticas, los alcoholes se convierten en fosfatos, que pueden ser excelentes grupos de partida bioquímicos. Aprenderemos mucho más sobre la estructura y reacciones de los compuestos orgánicos de fosfato en el capítulo 9.


