10.2: Adiciones nucleofílicas a aldehídos y cetonas - Una visión general
- Page ID
- 72375
Los grupos funcionales aldehído y cetona
Recordemos del capítulo 1 que el grupo funcional cetona está formado por un carbonilo unido a dos carbonos, mientras que en un aldehído uno (o ambos) de los átomos vecinos es un hidrógeno.
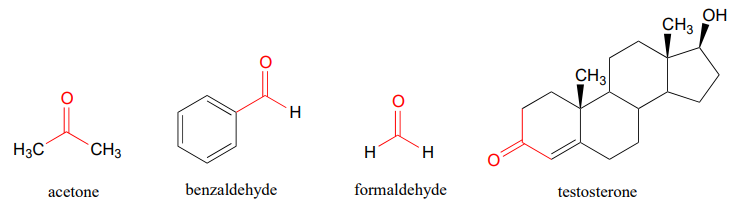
Probablemente esté familiarizado con los ejemplos que se muestran a continuación: la acetona, el compuesto cetónico más simple, es el disolvente en el quitaesmalte de uñas, el benzaldehído es el aromatizante en las cerezas al marrasquino, y el formaldehído (un caso especial en el que el carbono carbonílico está unido a hidrógenos por ambos lados) es el maloliente cosas que se usaron para preservar la desafortunada rana que diseccionaste en la clase de biología de secundaria. La hormona sexual masculina testosterona contiene un grupo cetona además de grupos alcohol y alqueno.
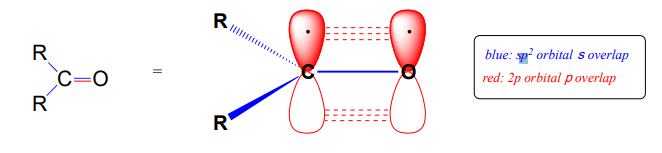
Recordemos del capítulo 2 la imagen de unión en una cetona o aldehído: el carbono carbonilo se\(sp^2\) hibrida, con sus tres\(sp^2\) orbitales planos trigonales formando\(s\) enlaces con orbitales en el oxígeno y en los dos átomos de carbono o hidrógeno. El\(2p\) orbital restante no hibridado es perpendicular al plano formado por los\(sp^2\) orbitales, y forma un\(p\) enlace a través de un solapamiento lado a lado con un\(2p\) orbital en el oxígeno. Los\(p\) enlaces\(s\) y entre el carbono y el oxígeno se combinan para hacer el\(C=O\) doble enlace que define la funcionalidad carbonilo.
Adición nucleofílica
El doble enlace carbono-oxígeno es polar: el oxígeno es más electronegativo que el carbono, por lo que la densidad de electrones es mayor en el extremo de oxígeno del enlace y menor en el extremo de carbono. Recordemos que la polaridad del enlace se puede representar con una flecha dipolo (A en la figura siguiente), o mostrando el oxígeno como portador de una carga negativa parcial y el carbono carbonilo una carga positiva parcial (B).
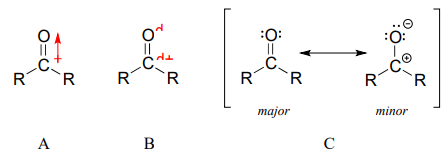
Una tercera forma de ilustrar el dipolo carbono-oxígeno (C en la figura anterior) es considerar los dos principales contribuyentes de resonancia: la forma principal, que es lo que normalmente se ve dibujado en las estructuras de Lewis, y un contribuyente menor pero muy importante en el que ambos electrones en el enlace p se localizan en el oxígeno, dándole una carga negativa completa. Esta última representación muestra el carbono con un\(2p\) orbital vacío y una carga positiva completa.
Sin embargo se representa la polaridad del enlace, el resultado final es que el carbono carbonilo es pobre en electrones, es decir, es un electrófilo. Además, la geometría plana trigonal significa que el grupo carbonilo está libre de obstáculos). Por lo tanto, es una excelente diana para el ataque de un grupo nucleofílico rico en electrones, un paso mecanicista llamado adición nucleofílica:
Adición nucleofílica a un aldehído o cetona (enzimática)
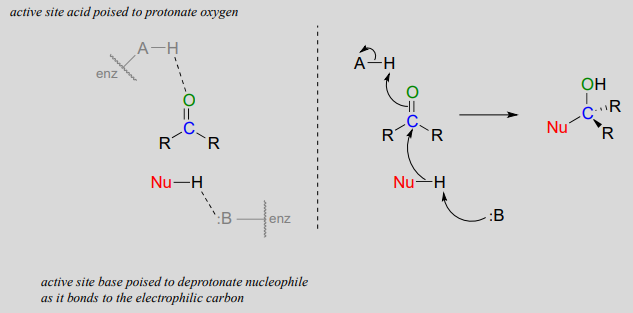
Observe la catálisis ácido-base que está ocurriendo en este mecanismo de generalización: en el sitio activo de la enzima, un grupo básico está preparado para desprotonar al nucleófilo (potenciando así su nucleofilia) ya que comienza a atacar el carbono carbonílico, mientras que al mismo tiempo un protón ácido en otro grupo de sitio activo es colocado justo por encima del oxígeno carbonílico (mejorando así la electrofilicidad del carbono), listo para protonar el oxígeno y neutralizar cualquier carga negativa que se acueste.
Estereoquímica de la adición nucleofílica a un carbonilo
Recordemos de la sección 3.11B que cuando los dos grupos adyacentes a un carbonilo no son iguales, podemos distinguir entre las 'caras' re y si de la estructura plana.
El concepto de un grupo plano trigonal con dos caras distintas entra en juego cuando consideramos el resultado estereoquímico de una reacción de adición nucleofílica. Observe que en el curso de una reacción de adición de carbonilo, la hibridación del carbono carbonilo cambia de sp2 a sp3, lo que significa que la geometría del enlace cambia de plano trigonal a tetraédrico. Si los dos grupos R no son equivalentes, entonces se crea un centro quiral tras la adición del nucleófilo. La configuración del nuevo centro quiral depende de qué lado del plano carbonilo ataca el nucleófilo.
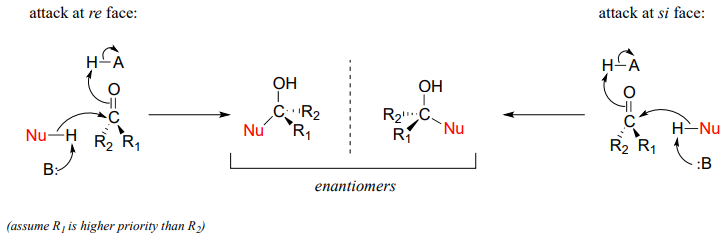
Si la reacción es catalizada por una enzima, la estereoquímica de la adición está (como era de esperar) estrechamente controlada, y conduce a un estereoisómero exclusivamente- los sustratos nucleofílico y electrófilo están unidos en posiciones específicas dentro del sitio activo, por lo que el ataque debe ocurrir específicamente de uno lado y no el otro. Las reacciones no enzimáticas de este tipo a menudo dan como resultado una mezcla 50:50 de estereoisómeros, pero también es posible que un estereoisómero pueda ser más abundante, dependiendo de la estructura de los reactivos y las condiciones en las que se lleve a cabo la reacción. Veremos algunos ejemplos de este fenómeno pronto cuando veamos formas cíclicas de moléculas de azúcar.


