11.E: Reacciones de Sustitución Nucleofílica de Acilo (Ejercicios)
- Page ID
- 72112
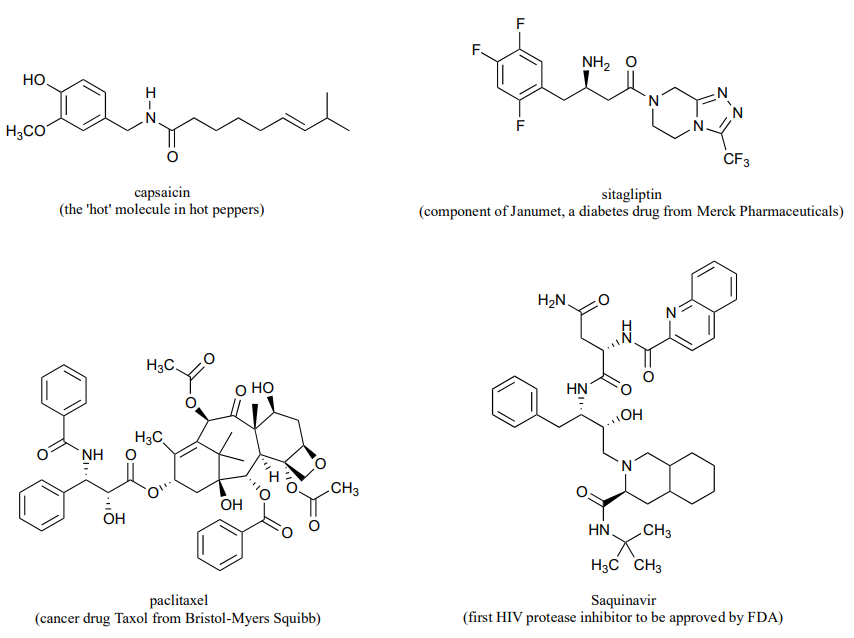
P11.1: Aquí hay alguna práctica en el reconocimiento de grupos funcionales derivados de ácido carboxílico en moléculas biológicas grandes y complejas. Hay siete grupos amida y cuatro grupos éster en las moléculas a continuación - mira si puedes encontrarlos todos.
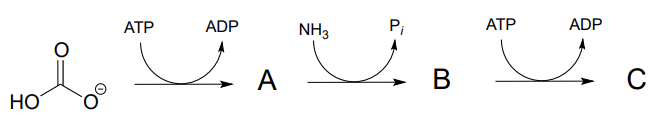
P11.2 : (
- a) Predecir las estructuras de los compuestos intermedios A, B y C en la reacción siguiente (EC 6.3.4.16). El compuesto C contiene una funcionalidad carboxilato activada. Utilice las abreviaturas según corresponda.
- Dibujar un mecanismo razonable para el paso A a B
P11.3: Imagínese que la acetilcolina se combina con acetilcolinesterasa (sección 11.6) en un tampón hecho\(^{18}O\) de agua marcada. ¿Dónde esperarías encontrar la\(^{18}O\) etiqueta en los productos?
P11.4: Predecir los productos de esta reacción de hidrólisis (EC 3.5.1.18):
P11.5: La descomposición de la grasa en nuestro cuerpo comienza con la acción de las enzimas lipasa, que catalizan la escisión de los ácidos grasos de la cadena principal de glicerol del triacilglicerol (ver sección 1.3 para un recordatorio de la estructura del triacilglicerol). Un residuo de serina en el sitio activo de la lipasa juega un papel nucleofílico clave en la reacción. Dibujar el único paso mecanicista en el que se rompe el enlace covalente entre un ácido graso y la cadena principal de glicerilo, utilizando notación de flecha curva y abreviatura apropiada.
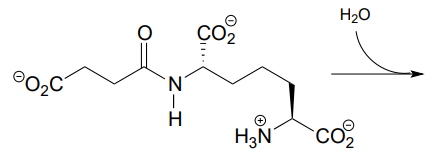
P11.6: Antes de que los ácidos grasos de cadena larga se transporten a través de la membrana mitocondrial interna, se transfieren temporalmente de la Coenzima A a una molécula de transporte llamada carnitina, a la que están unidos por un grupo éster (EC 2.3.1.21).
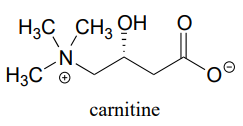
Dibujar la estructura de la acil carnitina grasa (usar R para denotar la cadena hidrocarbonada del ácido graso)
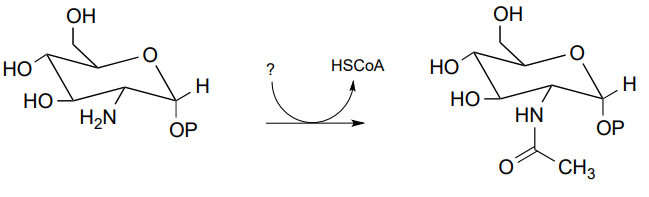
P11.7: A continuación se muestra una reacción del metabolismo de carbohidratos (EC 2.3.1.157). Identificar el compuesto designado con un signo de interrogación.
P11.8: Proponer el producto de hidrólisis enzimática más probable del sustrato a continuación (pista - ¡piense en la electrofilicidad al considerar los resultados regioquímicos!) (EC 3.5.2.2) J. Biol. Chem. 2006, 281, 13762 esquema 2)
P11.9: La coenzima tetrahidrofolato (\(THF\)) participa en reacciones de transferencia de carbono único. Un derivado de\(THF\), llamado 10-formyl-\(THF\) (estructura abreviada que se muestra a continuación), transfiere un grupo formilo temprano en la biosíntesis de ribonucleótidos de purina a ribonucleótido de glicinamida.
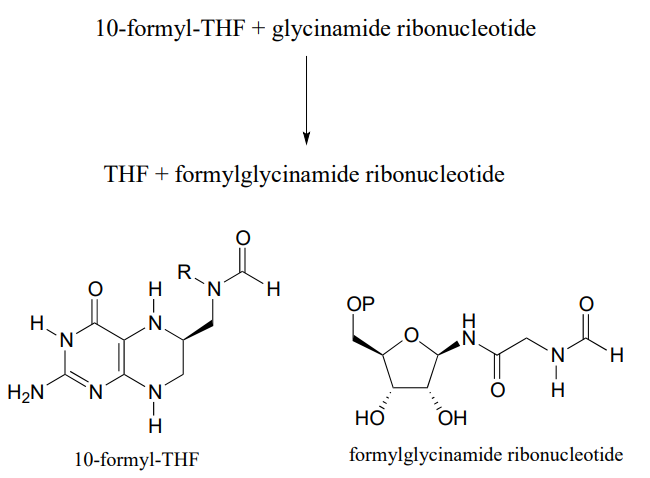
Dibujar una etapa de ataque nucleofílico para esta reacción (supongamos que la transferencia de acilo entre los dos sustratos es directa, sin que se formen intermedios covalentes enzima-sustrato).
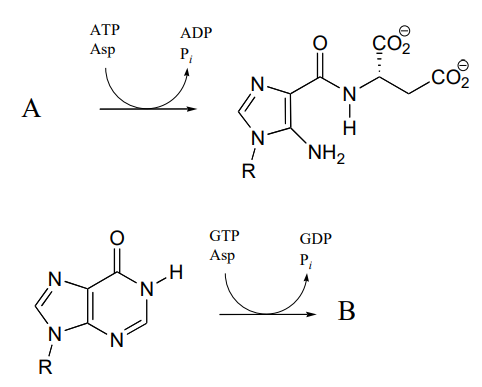
P11.10: A continuación se muestra uno de los pasos clave en la biosíntesis de nucleótidos de purina (guanosina y adenosina) en arqueas.
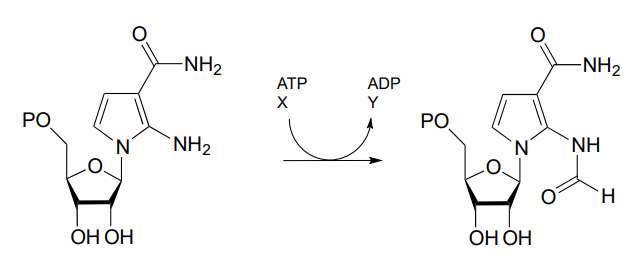
Identificar los compuestos X e Y faltantes en la figura anterior, y dibujar la estructura de un intermedio de fosfato de acilo.
P11.11: Las reacciones a continuación son parte de la biosíntesis de nucleótidos. Predecir las estructuras de los compuestos A y B. El compuesto A contiene un grupo carboxilato, y la reacción que forma el compuesto B es del tipo discutido en la sección 11.8, en la que un grupo amina sustituye a una amida activada para formar un grupo amidina/amidinio.
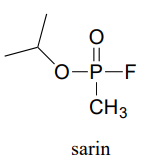
P11.12: Recordemos de la sección 11.6 que la acetilcolinesterasa cataliza la hidrólisis del grupo éster en la acetilcolina, pasando por un intermedio en el que el grupo acetilo en el sustrato se transfiere a una serina en la enzima mediante una reacción de transesterificación. El gas nervioso sarín actúa bloqueando esta etapa inicial de transesterificación: el fármaco ingresa al sitio activo y se adhiere a la serina del sitio activo. Dada la estructura del sarín a continuación, proponer un mecanismo de cómo sucede esto.
P11.13: Proponer un mecanismo para la siguiente reacción a partir de la biosíntesis de histidina (EC 3.5.4.19).
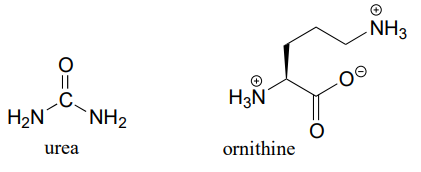
P11.14 (¡Desafiante!) En la etapa final del ciclo de la urea (una fase de vías de degradación de aminoácidos), el aminoácido arginina se hidroliza a urea y ornitina (EC 3.5.3.1). Proponer un mecanismo razonable.
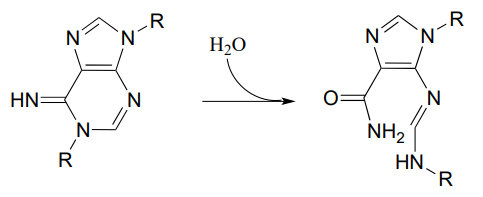
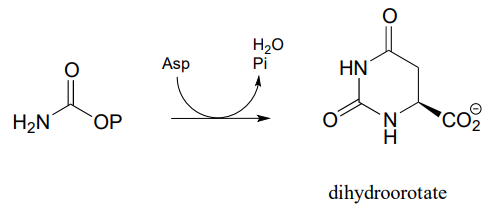
P11.15: En la vía biosintética para las bases ADN/ARN uridina y citidina, se produce una reacción en la que el fosfato de carbamoílo se condensa con aspartato, y el intermedio resultante se cicla para formar dihidroorotato. Proponer un mecanismo para esta transformación. Consejo: en una etapa muy inusual, un grupo carboxilato se somete en un momento del proceso directamente a una reacción de transferencia de acilo, sin activación previa por fosforilación. La enzima logra esto con la ayuda de dos iones bo.und zinc, que sirven para estabilizar la carga negativa en un grupo eliminable de hidróxido. (EC 3.5.2.3) (Bioquímica 2001, 40, 6989, Esquema 2)
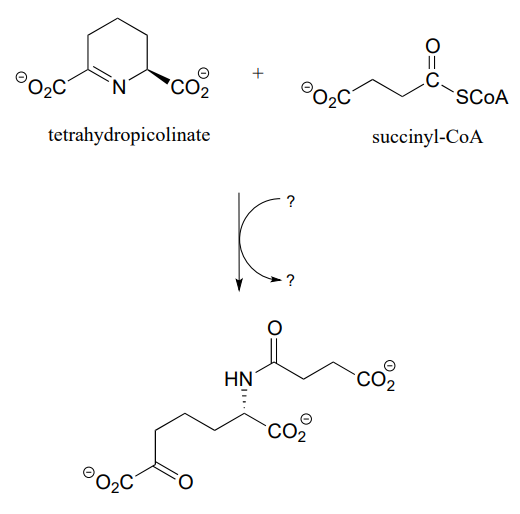
P11.16: Proponer un mecanismo razonable para la reacción siguiente (a partir de la biosíntesis de lisina), y rellenar las especies faltantes indicadas por signos de interrogación.
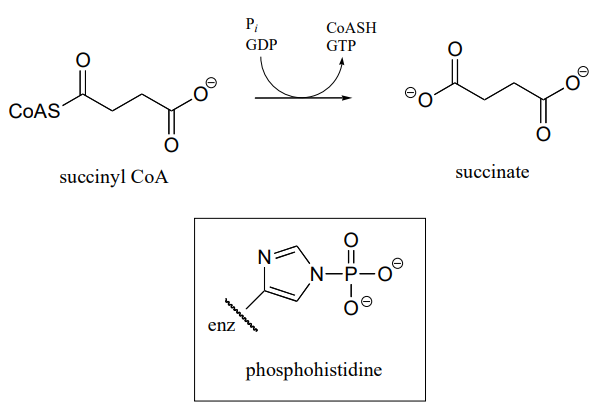
P11.17: En un paso en el ciclo del ácido cítrico, la hidrólisis de succinyl-\(CoA\) se acopla a la fosforilación del PIB. El mecanismo implica la fosforilación transitoria de una histidina de sitio activo. Sugerir un mecanismo (multipaso) para este proceso (EC 6.2.1.4).
P11.18: Se utilizó un compuesto de diazocetona\(^{14}C\) marcado (estructura abajo) para inactivar irreversiblemente una enzima llamada glutaminasa A. Se demostró que la inactivación se producía con el\(^{14}C\) marcaje de una cisteína de sitio activo.
a) Proponer un mecanismo de inactivación y marcaje de cisteína.
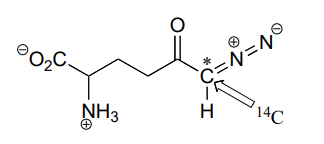
b) En menor medida, se encontró que la inactivación de la enzima y el marcaje de la cisteína ocurrieron con la liberación de un compuesto radiactivo del sitio activo. Proponer un mecanismo para el modo de inactivación.
P11.19: Las enzimas dehelogenasas catalizan la escisión de los enlaces carbono-halógeno, y son de interés para los científicos que buscan nuevas formas de desintoxicar los contaminantes organohalógenos que se abren paso en el medio ambiente. Una de tales deshalogenasas cataliza la siguiente reacción:
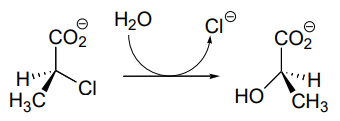
Se piensa que un aspartato de sitio activo lleva a cabo el ataque nucleofílico inicial que expulsa el cloruro.
- Dibuje un mecanismo probable para la reacción completa que se muestra arriba. ¡Mira cuidadosamente el progreso estereoquímico!
- Cuando el aspartato del sitio activo se mutó a asparagina, la enzima aún mantuvo actividad. El análisis por espectrometría de masas indicó que, en un punto del ciclo catalítico de la enzima mutante, la asparagina existe como cianoalanina. Dibujar un mecanismo probable para la reacción catalizada por la enzima mutante, incluyendo la formación del residuo transitorio de cianoalanina y la posterior regeneración de la asparagina.


