11.10: Reacciones de Sustitución Nucleofílica de Acilo en Laboratorio
- Page ID
- 72111
Todas las reacciones biológicas de sustitución de acilo nucleofílico que hemos visto hasta ahora tienen contrapartes en síntesis orgánica de laboratorio. Mecanísticamente, una de las mayores diferencias entre la versión biológica y la de laboratorio es que las reacciones de laboratorio generalmente se ejecutan con un ácido o base fuerte como catalizador, mientras que las reacciones biológicas, por supuesto, se están produciendo en fisiológicas\(pH.\) Al proponer mecanismos, entonces, se debe tener cuidado para extraer intermedios en sus estados de protonación razonables: por ejemplo, un intermedio de ion hidronio (\(H_3O^+\)) es razonable proponer en una reacción ácida, pero un intermedio de hidróxido (\(OH^-\)) no lo es.
Reacciones de éster - plátanos, jabón y biodiesel
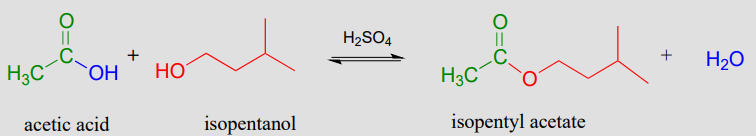
La síntesis catalizada por ácidos de compuestos saborizantes como el acetato de isopentilo (un éster con sabor a plátano) es simple de llevar a cabo en el laboratorio. En esta reacción de esterificación, el ácido acético se combina con alcohol isopentilico junto con una cantidad catalítica de ácido sulfúrico.
Esterificación catalizada por ácido (reacción de laboratorio):
Mecanismo:
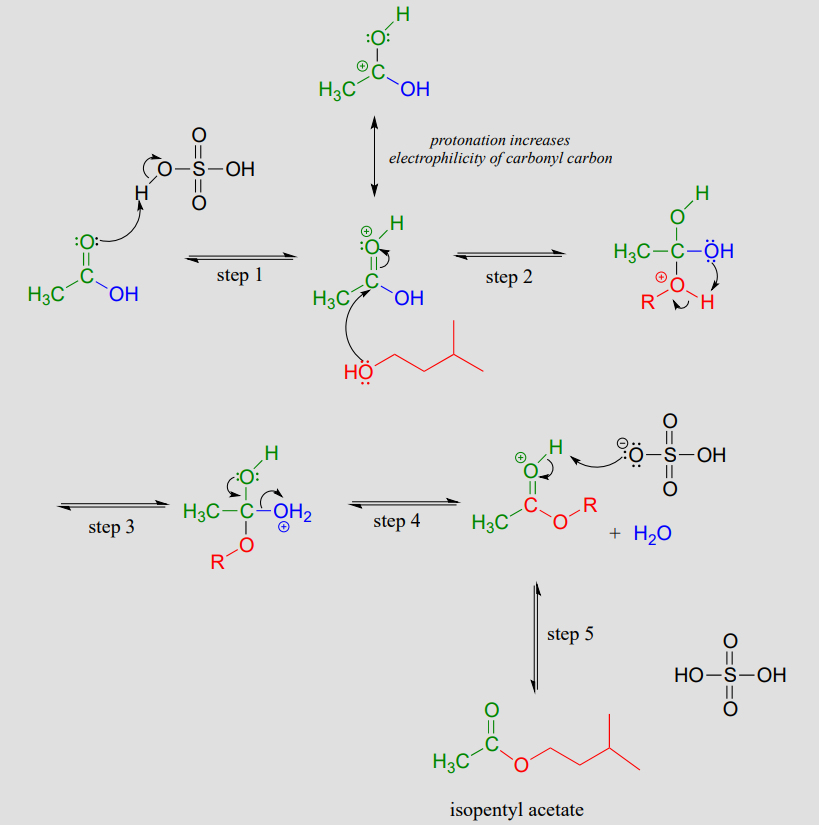
El oxígeno carbonílico del ácido acético se protonó primero (paso 1), lo que aleja la densidad electrónica del carbono y aumenta su electrofilicidad. En el paso 2, el nucleófilo alcohólico ataca: observe que en condiciones ácidas, el nucleófilo no es desprotonado simultáneamente ya que ataca (como demostraríamos en un mecanismo bioquímico), y el intermedio tetraédrico es un catión más que un anión. En la etapa 3, se transfiere un protón de un átomo de oxígeno a otro, creando un buen grupo de salida (agua) el cual es expulsado en la etapa 4. Finalmente (etapa 5), se desprotonó el oxígeno carbonílico en el éster, regenerando el ácido catalítico.
Esta reacción es altamente reversible, debido a que los ácidos carboxílicos son aproximadamente tan reactivos como los ésteres. Para obtener buenos rendimientos del éster, se puede utilizar un exceso de ácido acético, que por principio de Le Chatelier (consulte su libro de texto de Química General para una revisión) desplaza el equilibrio hacia el producto éster.
La saponificación es un término común para la hidrólisis inducida por bases de un éster. Por ejemplo, el benzoato de metilo se hidrolizará a benzoato y metanol cuando se agregue al agua con una cantidad catalítica de hidróxido de sodio.
Mecanismo de hidrólisis de éster catalizada por base (saponificación):
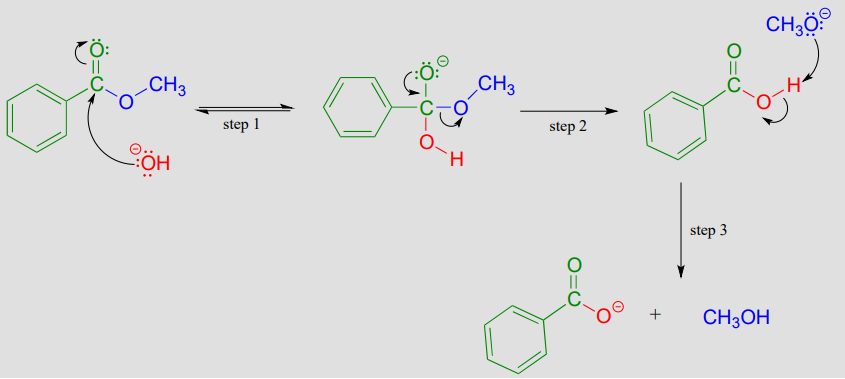
La adición de la base proporciona iones hidróxido para actuar como nucleófilo (el hidróxido es por supuesto un mejor nucleófilo que el agua) en la etapa 1. El intermedio tetraédrico (aniónico en este caso, debido a que las condiciones de reacción son básicas) luego se colapsa en la etapa 2, y el alcóxido (\(CH_3O^-\)) se va. No estamos acostumbrados a ver alcóxidos o hidróxidos como grupos salientes en reacciones bioquímicas, porque son bases fuertes -pero en una solución básica, este es un paso químico razonable. La etapa 3 es simplemente una reacción ácido-base entre el ácido carboxílico y el alcóxido. Tenga en cuenta que esto se conoce como inducido por bases en lugar de catalizado por base porque el hidróxido no se regenera, y por lo tanto se debe usar un equivalente molar completo de base.
El proceso de saponificación deriva su nombre del antiguo oficio de elaboración de jabón, en el que los grupos éster de los triacilgliceroles en las grasas animales se hidrolizan en condiciones básicas a glicerol y aniones acilo grasos (ver sección 2.5A para un recordatorio de cómo funcionan los aniones acilo grasos como jabón).
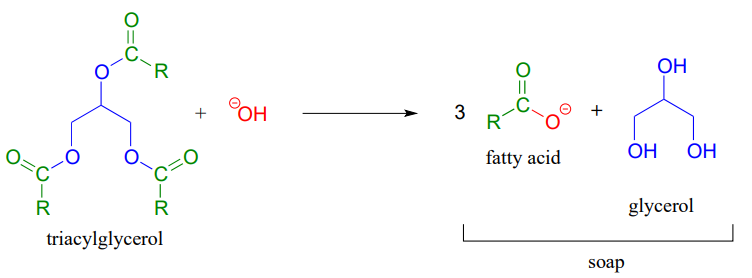
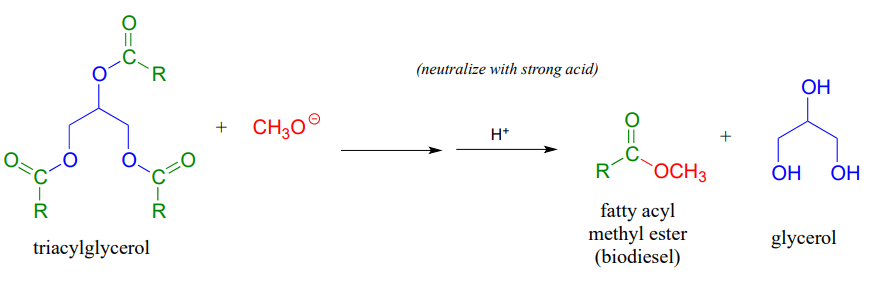
Aprendimos anteriormente sobre las reacciones de transesterificación en el contexto del mecanismo químico de la aspirina. La transesterificación también juega un papel clave en una tecnología que ya es un componente importante en el esfuerzo general por desarrollar fuentes de energía renovables y respetuosas con el medio ambiente: el biodeisel. Es posible que hayas escuchado historias sobre personas manejando sus autos en biodeisel a partir de aceite usado de fritura francesa. Para elaborar biodeisel, los triacilgliceroles en grasas y aceites pueden ser transesterificados con metanol o etanol en condiciones básicas. Los productos de éster metílico y etílico de acilo graso son combustibles viables para motores.
Dibujar estructuras de los materiales de partida de ácido carboxílico y alcohol que podrían usarse para sintetizar los ésteres de frutas fragantes que se muestran en la sección 11.1.
¿Qué pasaría si intentaras sintetizar acetato de isopentilo (aceite de plátano) con condiciones básicas en lugar de ácidas? ¿Funcionaría esto?
Considere la dirección inversa de la reacción de esterificación catalizada por ácido. ¿Cómo llamarías a esta reacción en términos de química orgánica?
Una forma alternativa de sintetizar ésteres es comenzar con un carboxilato y un haluro de alquilo. Dibujar un mecanismo para tal síntesis de benzoato de metilo - ¿qué tipo de mecanismo de reacción es este?
Cloruros de ácido y anhidridos de ácido
En la célula, los acil fosfatos y tioésteres son los más reactivos de los derivados de ácido carboxílico. En el laboratorio de síntesis orgánica, sus homólogos son cloruros de ácido y anhidridos de ácido, respectivamente. De los dos, los cloruros de ácido son los más reactivos, debido a que el ion cloruro es una base más débil y un mejor grupo lábil que el ion carboxilato (el\(pK_a\) of \(HCl\) is -7, while that of carboxylic acids is about 4.5: remember, a stronger conjugate acid means a weaker conjugate base).
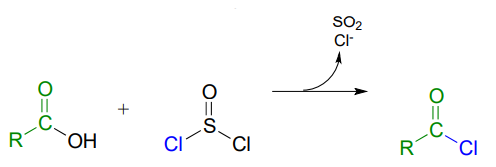
Acid chlorides can be prepared from carboxylic acids using \(SOCl_2\):
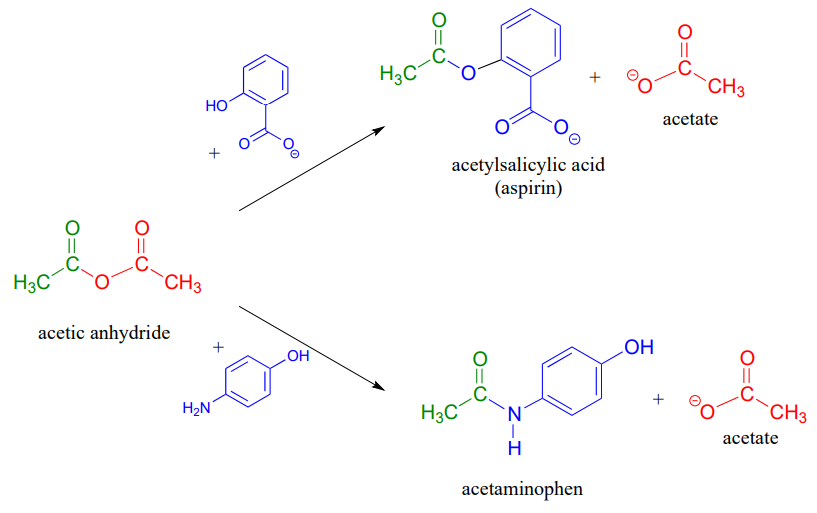
Acid anhydrides can be prepared from carboxylic acids and an acid chloride under basic conditions:

Acetic anhydride is often used to prepare acetate esters and amides from alcohols and amines, respectively. The synthesis of aspirin and acetaminophen are examples:
Un ácido carboxílico no se puede convertir directamente en una amida porque el nucleófilo de amina simplemente actuaría como base y desprotonaría el ácido carboxílico:
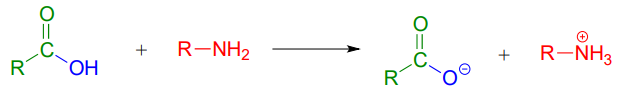
En cambio, el ácido carboxílico se convierte primero en un cloruro de ácido (en otras palabras, el ácido carboxílico se activa), luego el cloruro de ácido se combina con una amina para hacer la amida.
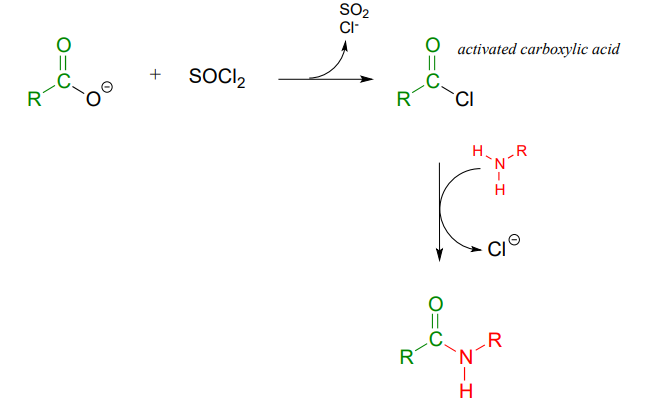
Esta secuencia de reacciones es un paralelo directo a las reacciones bioquímicas de glutamina y asparagina sintasa que vimos anteriormente en el capítulo (sección 11.5), excepto que la forma activada del ácido carboxílico es un cloruro de ácido en lugar de un acil fosfato o acil-AMP.
Para la preparación de la amida a continuación, sh ow un carboxilato de partida y amina y las especies de cloruro de ácido intermedio.
Poliésteres y poliamidas
Si alguna vez ha tenido la desgracia de someterse a una cirugía o tener que ser cosido después de un mal corte, es probable que se haya beneficiado de nuestra creciente comprensión de los polímeros y la química de los ésteres carboxílicos. El ácido poliglicólico es un material comúnmente utilizado para hacer suturas de disolución. Es un poliéster -un polímero unido entre sí por grupos éster- y se forma a partir de sucesivas reacciones de sustitución de acilo entre el grupo alcohol en un extremo de un monómero de ácido glicólico y el grupo ácido carboxílico en un segundo:
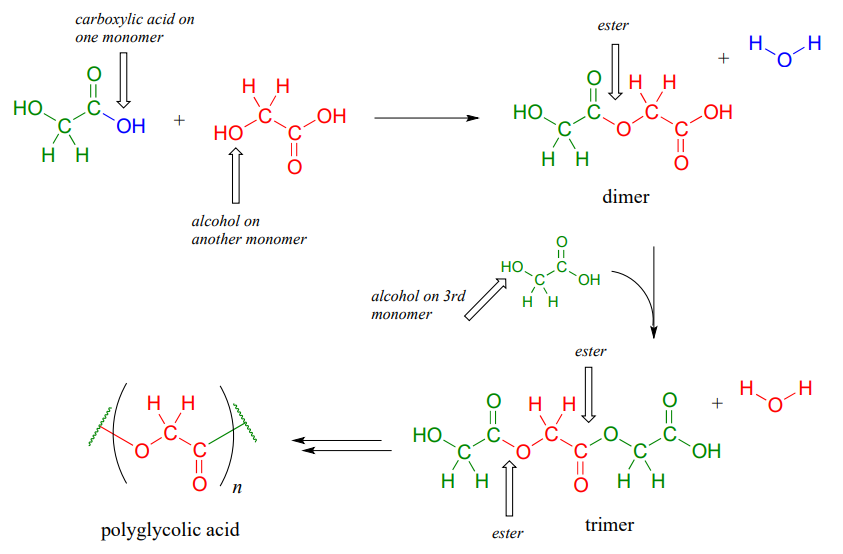
El polímero resultante -en el que cada hebra tiene generalmente varios cientos a unos pocos miles de monómeros de largo- es fuerte, flexible y no irritante para los tejidos corporales. No es, sin embargo, permanente: los grupos éster son reactivos a la hidrólisis gradual y espontánea a nivel fisiológico\(pH\), lo que significa que los hilos se disolverán de forma natural a lo largo de varias semanas, eliminando la necesidad de que sean cortados por un médico.
El dacron, un poliéster utilizado en la fibra de la ropa, está hecho de monómeros alternantes de tereftalato de dimetilo y etilenglicol.
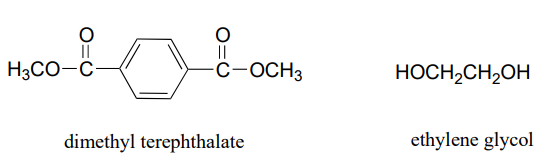
- Dibujar la estructura de un tetrámero de Dacrón (es decir, cuatro monómeros unidos entre sí).
- El agua es un producto secundario de la polimerización del ácido glicólico. ¿Cuál es el producto secundario equivalente en la producción de Dacron?
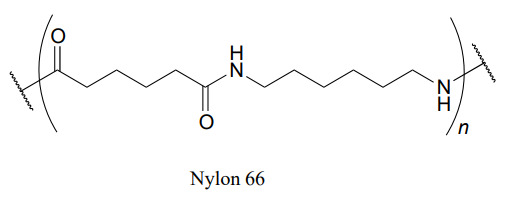
El Nylon 6,6 es una poliamida ampliamente utilizada compuesta por monómeros alternos. El Nylon 6,6 tiene la estructura que se muestra a continuación -la región dentro de los paréntesis es la unidad repetitiva, con 'n' indicando un gran número de repeticiones. Identificar los dos compuestos monoméricos utilizados para elaborar el polímero.
La síntesis de Gabriel de aminas primarias
La síntesis de Gabriel, que lleva el nombre del químico alemán Siegmund Gabriel del siglo XIX, es una forma útil de convertir haluros de alquilo en aminas y otro ejemplo de\(S_N2\) etapas de sustitución de acilo en el laboratorio. El nitrógeno en el grupo amina recién introducido proviene de la ftalimida. En el primer paso de la reacción, la ftalimida es desprotonada por hidróxido, luego en la etapa 2 actúa como nucleófilo para desplazar un haluro en una\(S_N2\) reacción (la ftalimida no es un nucleófilo muy potente, por lo que esta reacción sólo funciona con haluros primarios o de metilo sin impedimentos).
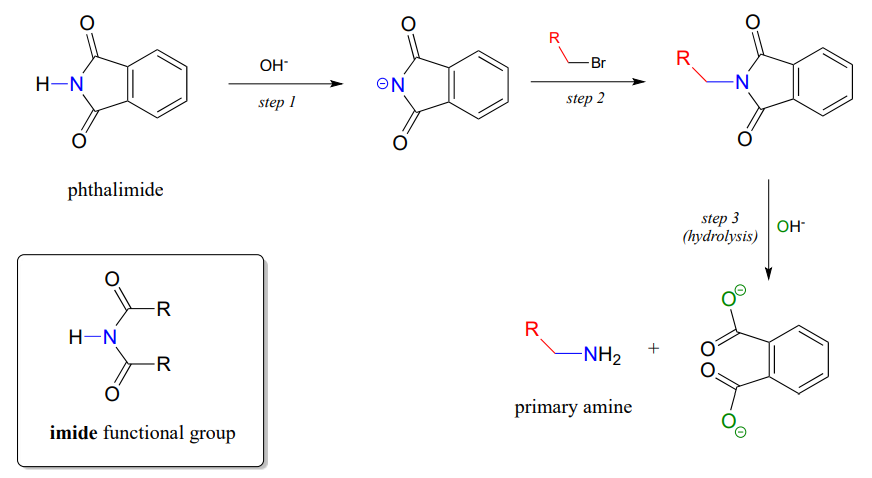
La etapa 3 es simplemente un par de etapas de sustitución de acilo hidrolítico para liberar la amina primaria, con un subproducto de dicarboxilato aromático.
La ftalimida contiene un grupo funcional 'imida', y tiene un\(pK_a\) de aproximadamente 10. ¿Qué hace que el grupo imida sea mucho más ácido que una amida, que tiene una\(pK_a\) de aproximadamente 17?
Como procedimiento alternativo, la liberación de la amina en la etapa 3 se puede llevar a cabo con hidrazina (\(H_2NNH_2\)) en lugar de hidróxido. Nuevamente, esto ocurre a través de dos reacciones de sustitución de acilo nucleofílico.
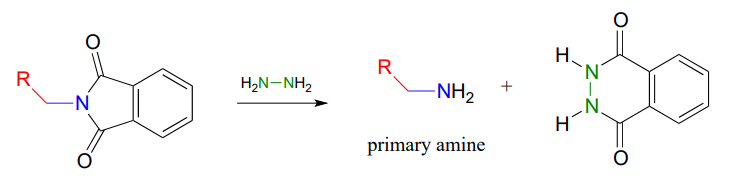
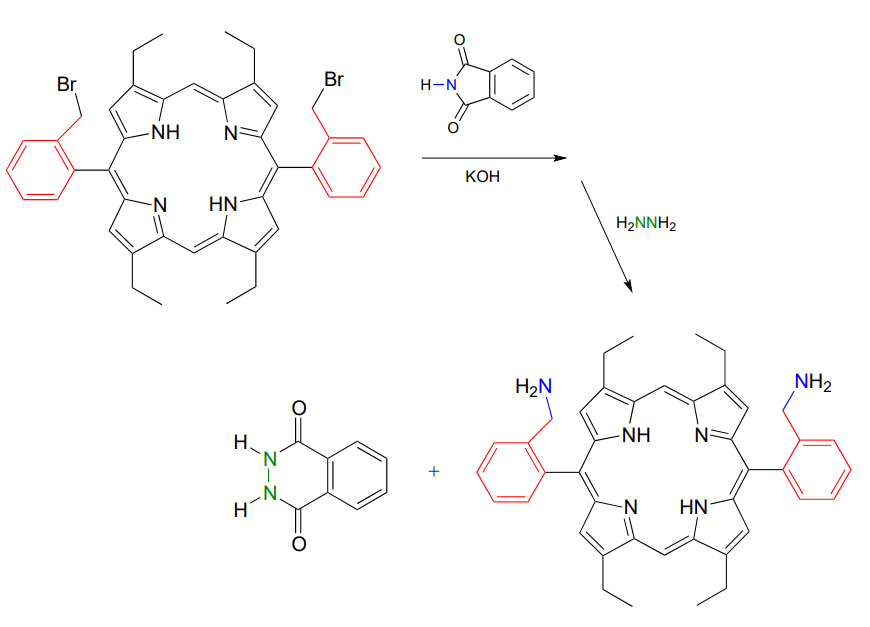
En 2000, los químicos del MIT sintetizando una molécula que contenía porfirina introdujeron dos grupos amina usando la síntesis de Gabriel con hidrazina. Las porfirinas, que incluyen el 'hemo' en nuestros glóbulos rojos, son una familia importante de biomoléculas con una variedad de funciones bioquímicas (J. Org. Chem. 2000, 65, 5298).