15.7: Reacciones redox de tioles y disulfuros
- Page ID
- 72202
Un enlace disulfuro es un enlace azufr-azufre, generalmente formado a partir de dos grupos tiol libres.
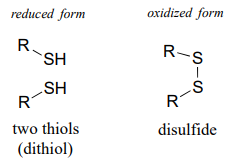
La interconversión entre los grupos ditiol y disulfuro es una reacción redox: la forma de ditiol libre está en estado reducido y la forma disulfuro está en estado oxidado. Observe que en el estado oxidado (disulfuro), cada átomo de azufre ha perdido un enlace con el hidrógeno y ganado un enlace con el azufre.
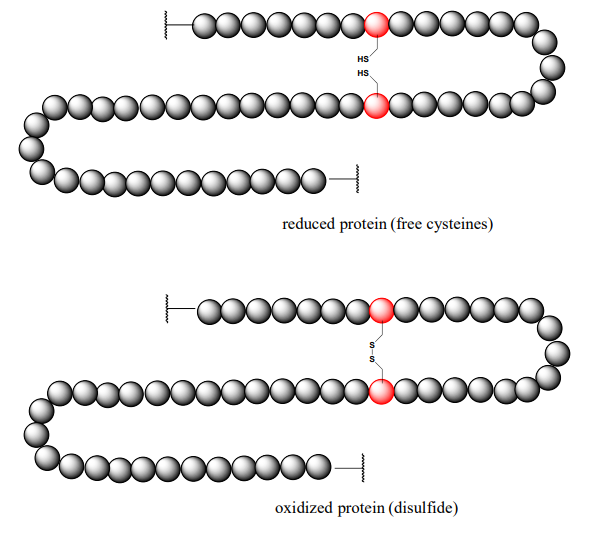
Como debes recordar de tus cursos de Biología, los enlaces disulfuro entre los residuos de cisteína son un componente integral de la estructura tridimensional de muchas proteínas extracelulares y péptidos de señalización.
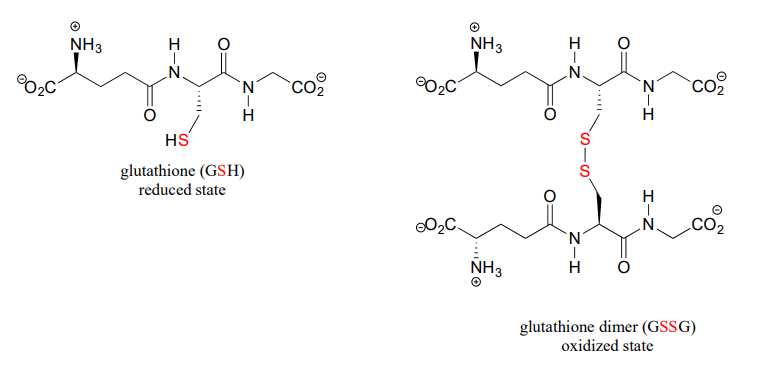
Una coenzima que contiene tiol llamada glutatión está involucrada integralmente en muchos procesos redox de tiol-disulfuro (recordemos que el glutatión fue un jugador principal en la historia introductoria de este capítulo sobre la investigación de conmociones cerebrales). En su forma reducida (tiol), el glutatión se abrevia 'GSH'. En su forma oxidada, el glutatión existe como un dímero de dos moléculas unidas por un grupo disulfuro, y se abrevia 'GSSG'.
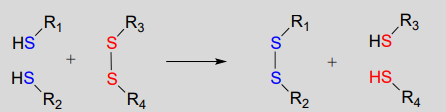
Los enlaces disulfuro y los grupos tiol libres tanto en proteínas como en moléculas orgánicas más pequeñas como el glutatión pueden “intercambiar lugares” a través de una reacción de intercambio de disulfuro. Este proceso es esencialmente una combinación de dos desplazamientos directos (\(S_N2\)-like) events, with sulfur atoms acting as nucleophile, electrophile and leaving group.
Disulfide exchange reaction
Mechanism:
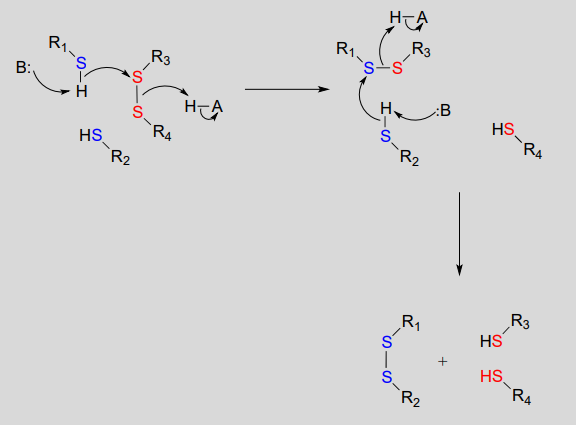
In eukaryotes, the cysteine side chains of intracellular (inside the cell) proteins are almost always in the free thiol (reduced) state due to the high concentration of reduced glutathione (GSH) in the intracellular environment. A disulfide bond in an intracellular protein will be rapidly reduced in a disulfide exchange reaction with excess glutathione.
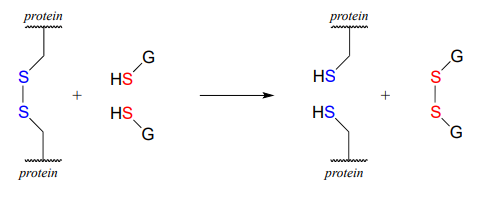
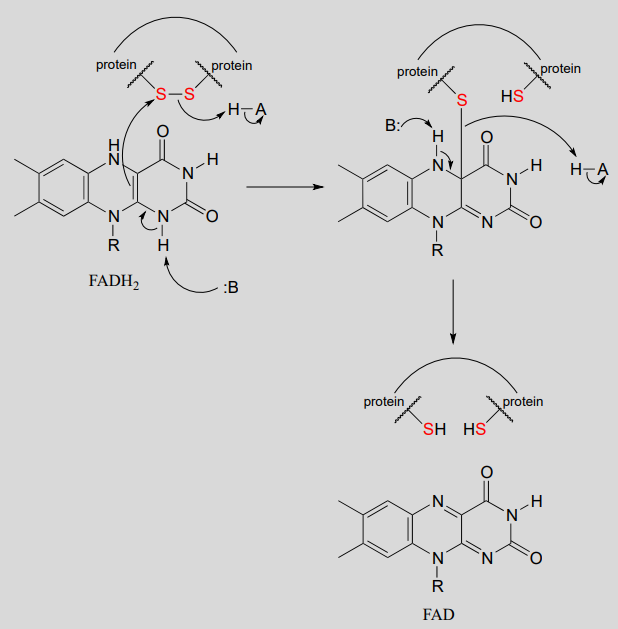
La interconversión de tioles y disulfuros libres también está mediada por flavina en algunas enzimas.
Reducción mediada por flavina de un enlace disulfuro proteico
Oxidación mediada por flavina de un enlace disulfuro proteico
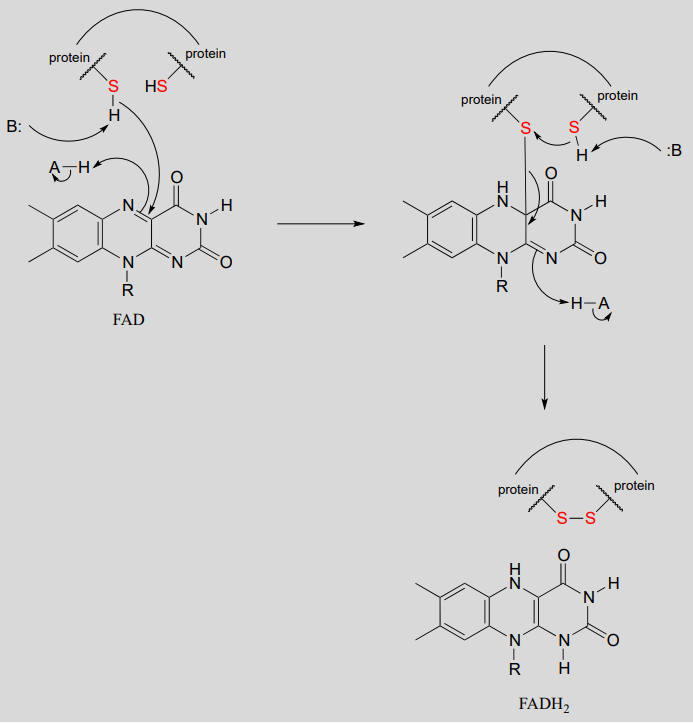
Como se indicó anteriormente, una alta concentración intracelular de glutatión reducido (GSH) sirve para mantener las proteínas en el estado tiol libre (reducido). Una enzima llamada glutatión reductasa cataliza la reducción de GSSG en un proceso mediado por flavina,\(NADH\) actuando como el último donante de hidruro.
Reacción de glutiona reductasa:
Esta figura muestra glutatión oxidado convertido en glutatión reducido por NADPH.
El mecanismo de esta y otras reacciones similares aún no se entiende completamente, pero la evidencia apunta a una reacción inicial de intercambio tiol-disulfuro con un par de cisteínas de la enzima, (fase 1 a continuación) seguida de una reducción dependiente de flavina del disulfuro cisteína-cisteína (fase 2). Finalmente, (fase 3)\(FAD\) se reduce de nuevo a\(FADH_2\) por\(NADH\). Frey y Hegeman, Mecanismos de reacción enzimática, p. 699
Fase 1: intercambio tiol-disulfuro (ver figura anterior para el mecanismo):
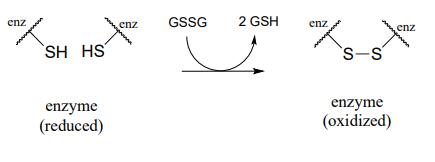
Fase 2: Reducción de disulfuro proteico por\(FADH_2\) (see earlier figure for mechanism)
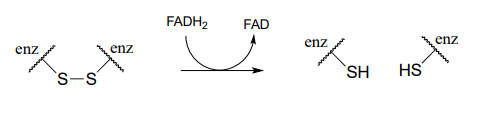
Fase 3: regeneración de\(FADH_2\) by\(NADH\) (ver sección 15.4B para el mecanismo)
En el laboratorio de bioquímica, las proteínas a menudo se mantienen en su estado reducido (tiol libre) por incubación en tampón que contiene una concentración en exceso de\(\beta\) -mercaptoetanol (BME) o ditiotreitol (DTT). Estos agentes reductores funcionan de manera similar a la de GSH, excepto que la DTT, debido a que tiene dos grupos tiol, puede formar un disulfuro intramolecular en su forma oxidada.
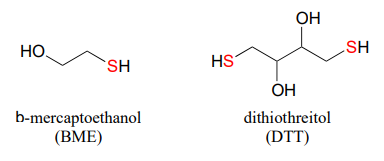
Dibujar estructuras de las formas oxidadas (disulfuro) de BME y DTT.


