15.8: Reacciones de Monooxigenasa Dependientes de Flavina - Hidroxilación, Epoxidación y Oxidación de Baeyer-Villiger
- Page ID
- 72164
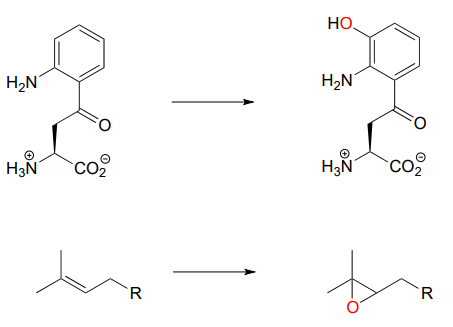
Hasta ahora, los ejemplos de reacción redox que hemos visto han sido transformaciones de hidrogenación/deshidrogenación o interconversiones entre tioles y disulfuros libres. Sin embargo, hay muchas reacciones redox importantes en la química biológica que no caen bajo ninguna de estas descripciones. Las enzimas oxigenasas catalizan la inserción de uno o dos átomos de oxígeno del oxígeno molecular (\(O_2\)) en una molécula de sustrato orgánico. Las enzimas que insertan un solo átomo de oxígeno se denominan monooxigenasas. A continuación se presentan dos ejemplos de transformaciones bioquímicas catalizadas por enzimas monooxigenasas: uno es una hidroxilación, el otro es una epoxidación (un grupo funcional epóxido está compuesto por un anillo carbono-carbono-oxígeno de tres miembros - los epóxidos son algo raros en química orgánica biológica pero son muy comunes y intermedios útiles en síntesis orgánica de laboratorio).
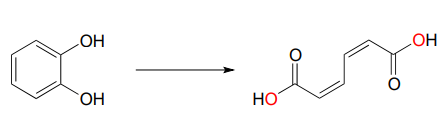
Las enzimas dioxigenasas insertan ambos átomos de oxígeno de\(O_2\) into the substrate, and usually involve cleavage of an aromatic ring. Below is an example of a dioxygenase reaction, catalyzed by catechol dioxygenase:
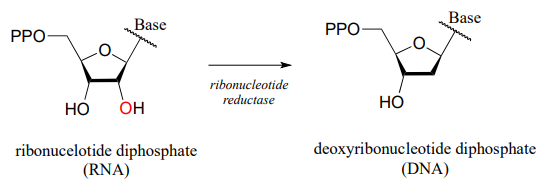
In the reduction direction, reductases remove oxygen atoms, or sometimes other electronegative heteratoms such as nitrogen or halides. For example, DNA deoxyribonucleosides are converted from their corresponding RNA ribonucleosides by the action of reductase enzymes:
Muchas reacciones de oxigenasa y reductasa implican la participación de metales de transición unidos a enzimas, como el hierro o el cobre, y los detalles mecanicistas de estas reacciones están fuera del alcance de nuestra discusión. Una variedad de reacciones bioquímicas monooxigenasas, sin embargo, involucran a la flavina como cofactor redox, y tenemos suficiente conocimiento de fondo en este punto para comprender estos mecanismos. En las reacciones monooxigenasas dependientes de flavina, la especie intermedia clave es el hidroperóxido de flavina.
El término 'peróxido' se refiere a un grupo funcional caracterizado por un enlace sencillo oxígeno-oxígeno. El peróxido más simple es el peróxido de hidrógeno (\(HOOH\)) sobre el cual tendremos más que decir a continuación. En el hidroperóxido de flavina, el grupo peróxido está unido a uno de los carbonos del sistema reactivo de triple anillo de la coenzima. A continuación se muestra un posible mecanismo para la formación de peróxido de flavina\(FADH_2\) y oxígeno molecular.
Silverman, R.B. La química orgánica de las reacciones catalizadas por enzimas, p. 121-122, Esquema 3.33. 2000, Academic Press, San Diego.
Mecanismo para la formación de hidroperóxido de flavina:
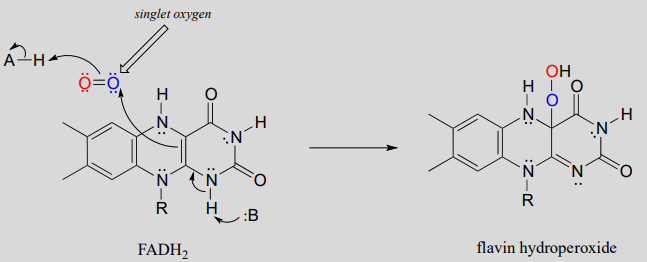
(Nota: Implícito en este mecanismo es que el oxígeno molecular primero experimenta inversión de espín desde el estado triplete al estado 'singlete' de mayor energía. Tal vez recuerde de su curso de química general que el oxígeno molecular existe en dos estados: el oxígeno 'singlete' tiene un doble enlace y no hay electrones desapareados, mientras que el oxígeno 'triplete' tiene un\(O-O\) enlace sencillo y dos electrones desapareados, una especie de 'doble radical'. La teoría orbital molecular -y la evidencia experimental- muestran que el estado triplete es menor en energía.
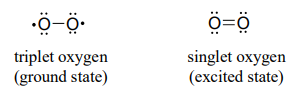
El mecanismo mostrado anteriormente es un mecanismo propuesto, otra propuesta implica que el oxígeno triplete reaccione con flavina en una serie de pasos radicales-intermedios, de un solo electrón).
El hidroperóxido de flavina se puede considerar como una forma activada de oxígeno molecular. Los peróxidos en general son potentes agentes oxidantes, porque el enlace sencillo oxígeno-oxígeno es bastante débil: solo 138 kJ/mol, en comparación con 339 kJ/mol para un enlace carbono-carbono, y 351 kJ/mol para un enlace carbono-oxígeno. Cuando el oxígeno 'externo' del hidroperóxido de flavina (rojo en nuestra figura anterior) se acerca a los electrones unidos por p de un alqueno o grupo aromático, el\(O-O\) bond will break, leaving an empty orbital on the outer oxygen to be filled by the p electrons - thus, a new carbon-oxygen bond is formed. This is what is happening in step 1 of a reaction in the tryptophan degradation pathway catalyzed by kynurenine 3-monooxygenase. Step 2 completes what is, mechanistically speaking, an electrophilic aromatic substitution reaction (section 14.4) with an peroxide oxygen electrophile.
Mechanism for the flavin hydroperoxide-dependent hydroxylation of kynurenine:
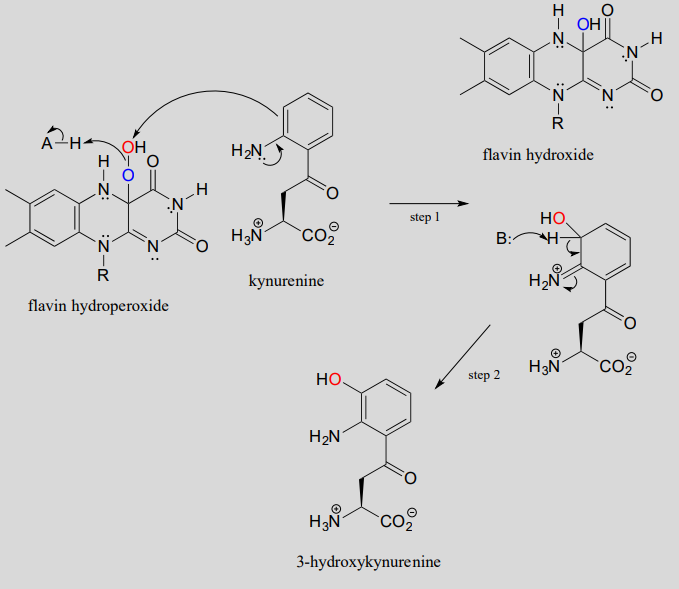
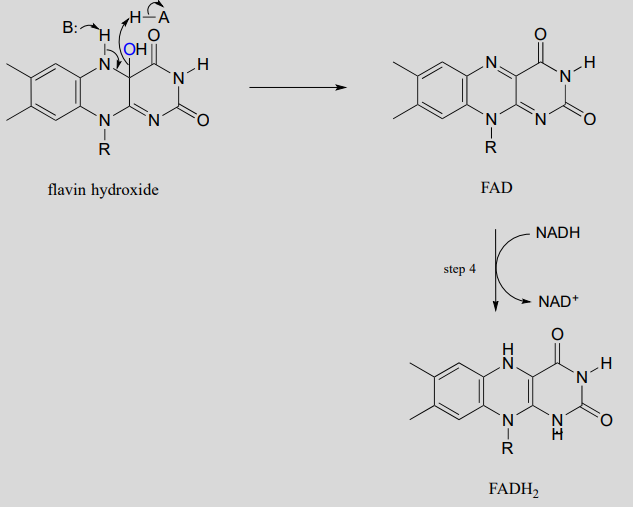
La eliminación del agua del intermedio de hidroxiflavina conduce entonces a la formación de\(FAD\) (etapa 3), que posteriormente se reduce de nuevo a\(FADH_2\) por\(NADH\) (etapa 4).
La reacción de\(N\) -hidroxilación a continuación, que forma parte de la vía biosintética de una molécula de unión a hierro en la bacteria patógena Pseudomonas aeruginosa, es mecanísticamente similar a la reacción de\(C\) -hidroxilación que acabamos de ver, excepto que el nucleófilo es un nitrógeno amínico. Obsérvese que\(FADH_2\) se muestra entre paréntesis debajo de la flecha de reacción, lo que indica que la flavina reducida participa en la reacción pero no se agota, sino que se regenera en el sitio activo al final del ciclo de reacción.
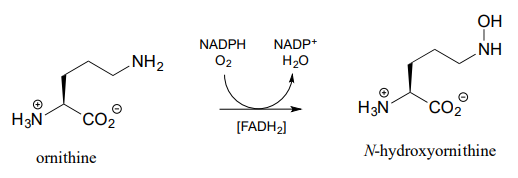
Dibuje flechas para la reacción de hidroxilación de\(N-O\) bond-forming step in the ornitina anterior.
Los epóxidos, caracterizados por un anillo de tres miembros compuesto por dos carbonos y un oxígeno, son un grupo funcional muy común y útil empleado en la química orgánica sintética. Aunque raras, existen algunas reacciones formadoras de epóxidos interesantes en vías bioquímicas, catalizadas por enzimas monooxigenasas dependientes de flavina.
En un paso clave en la biosíntesis del colesterol y otros compuestos esteroides, un alqueno se convierte en un epóxido en una molécula precursora llamada escualeno. El hidroperóxido de flavina también sirve como agente oxidante directo en esta etapa:
Mecanismo para la epoxidación de escualeno dependiente de hidroperóxido de flavina:
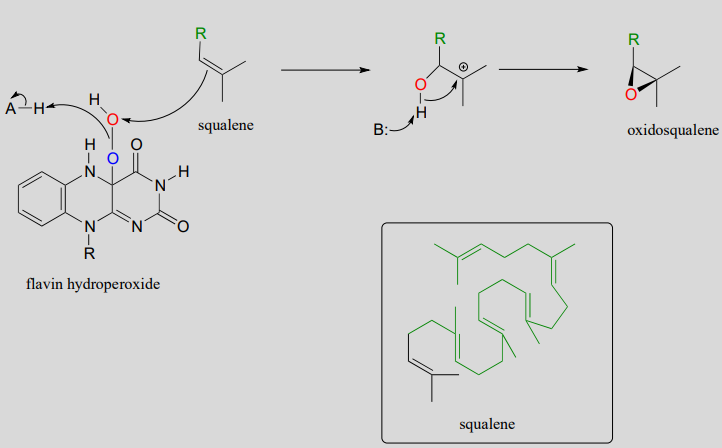
El oxidoescualeno pasa a ciclarse a lanosterol en una compleja y fascinante reacción electrófila que discutimos en la sección 14.5.
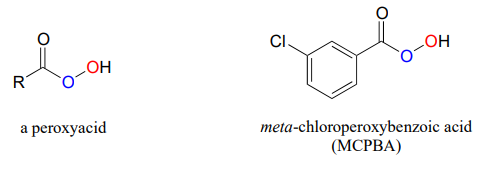
Las reacciones de epoxidación tienen un paralelo en el laboratorio orgánico sintético, y de hecho son herramientas muy importantes en la síntesis orgánica. En las epoxidaciones de laboratorio, los peroxiácidos son la contraparte del hidroperóxido de flavina en las epoxidaciones bioquímicas. El ácido metacloroperoxibencóico (MCPBA) es un peroxiácido de uso común.
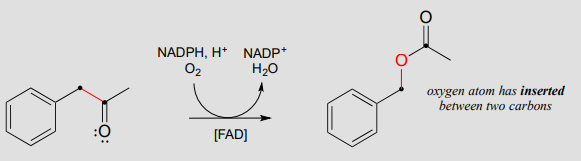
La oxidación de Baeyer-Villiger, en la que una cetona se convierte en un éster a través del tratamiento con un reactivo peróxido, es una reacción de síntesis orgánica de laboratorio extremadamente útil descubierta a finales del siglo XIX. Recientemente, se han descubierto muchos ejemplos bioquímicos de oxidaciones de Baeyer-Villiger: la reacción a continuación, por ejemplo, es catalizada por una monooxigenasa en una bacteria termófila:
(Proc. Natl. Acad. Sci. U.S.A. 2004, 101, 13157)
Una oxidación de Baeyer-Villiger:
Mecanismo:
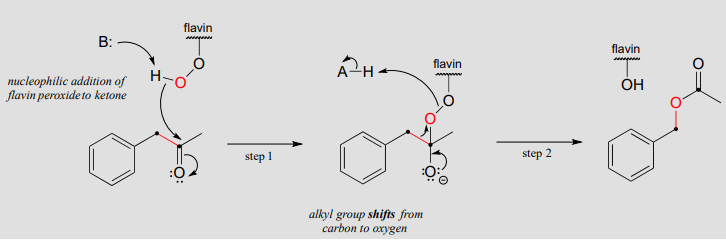
El mecanismo de Baeyer-Villiger difiere significativamente de las reacciones de hidroxilación que vimos anteriormente, aunque el hidroperóxido de flavina (abreviado en la figura anterior) todavía juega un papel clave. Aquí, el oxígeno peróxido es un nucleófilo, más que un electrófilo, atacando a la cetona carbonilo en la etapa 1. El paso 2 es un reordenamiento, similar en muchos aspectos a los desplazamientos de hidruro y alquilo que aprendimos en la sección 14.5. Los electrones en el enlace rojo en la figura se desplazan sobre un átomo: del carbono carbonilo al oxígeno peróxido externo. El resultado final es que un átomo de oxígeno, de\(O_2\) vía hidroperóxido de flavina, se ha insertado entre el carbono carbonilo y un metileno (\(CH_2\)) carbono vecino, formando un éster.
Obsérvese que en el mecanismo de reacción anterior, el sustrato de cetona es asimétrico: en un lado del carbonilo hay un grupo bencilo (\(CH_2\)-fenilo), y en el otro lado un grupo metilo. Obsérvese también que es el grupo bencilo, no el metilo, el que se desplaza en la etapa 2 del mecanismo. Por razones que aún no se conocen bien, en las reacciones de Baeyer-Villiger el grupo alquilo con mayor estabilidad carbocatiónica tiene una mayor aptitud migratoria: en otras palabras, tiene una barrera energética menor para el paso de desplazamiento.
Dibujar el producto de una hipotética reacción de Baeyer-Villiger que involucra el mismo sustrato que la figura anterior, en la que se desplaza el grupo metilo en lugar del bencilo.
Dibujar el probable producto principal de una hipotética reacción de Baeyer Villiger comenzando con 2-metilciclopentanona como sustrato. Tomar en cuenta la idea de aptitud migratoria.
A continuación se muestra otro ejemplo de una reacción de Baeyer-Villiger en la que una cetona cíclica se oxida a una lactona (éster cíclico). Observe que la inserción de oxígeno expande el anillo de 6 a 7 átomos. Este es el último paso en la biosíntesis del agente anticancerígeno mitromicina en algunas especies bacterianas (ACS Chem. Biol. 2013, 8, 2466).
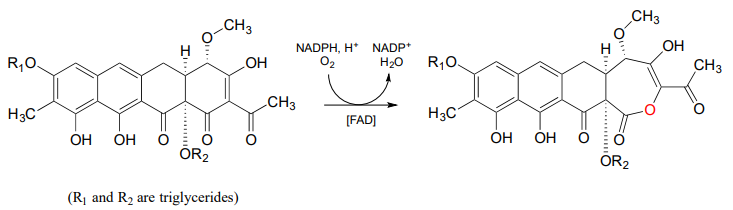
Otra variedad más de monooxigenasa dependiente de flavina, que tiene cierta similitud mecanicista con la oxidación de Baeyer-Villiger, es la reacción descarboxilativa a continuación de la biosíntesis de la hormona vegetal auxina: (J. Biol. Chem. 2013, 288, 1448)
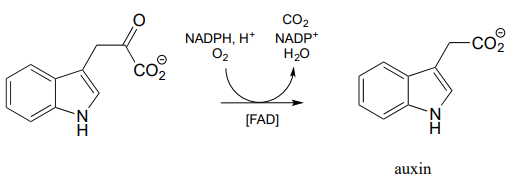
Proponer un mecanismo para la reacción anterior, comenzando con hidroperóxido de flavina.


