II: Radicales generados por metales de transición
- Page ID
- 79461
Las reacciones de los radicales generados a partir de complejos de metales de transición se pueden dividir en dos tipos en función de la dirección del flujo de electrones. En algunas de estas reacciones el metal de transición acepta un electrón durante la formación de radicales (transferencia oxidativa de electrones) y en otras dona un electrón durante este proceso (transferencia reductiva de electrones). Los compuestos que más a menudo participan en la transferencia oxidativa de electrones son el acetato de manganeso (III) [Mn (OAc) 3] y el nitrato de amonio cerio (IV) [(NH 4) 2 Ce (NO 3) 6], mientras que los frecuentemente involucrados en la transferencia reductora de electrones son bis (ciclo cloruro de pentadienil) titanio (III) (Cp 2 TiCl) y yoduro de samario (II) (SMi 2). Los carbohidratos que están unidos a un complejo que contiene cobalto por un enlace C—Co forman radicales por transferencia oxidativa de electrones y luego con frecuencia reforman un enlace C—Co mediante transferencia reductora de electrones.
La coenzima B 12 (5, Figura 1) es una de un grupo de moléculas biológicamente activas que tienen estructuras similares. 7 Cada miembro de este grupo tiene un átomo de cobalto rodeado por un ligando macrocíclico (un anillo de corrina) que lleva varios sustituyentes. Además del anillo de corrina, el átomo de cobalto en cada uno de estos compuestos también se coordina con un ligando que contiene un grupo fosfato, un resto de azúcar y una base nitrogenada. Los compuestos relacionados con 5 difieren entre sí en la estructura del grupo R unido al cobalto. R representa el grupo 5'-desoxiadenosil en la coenzima B 12 (5), pero para compuestos relacionados R puede ser estructuralmente tan simple como un grupo metilo o hidroxilo. 7
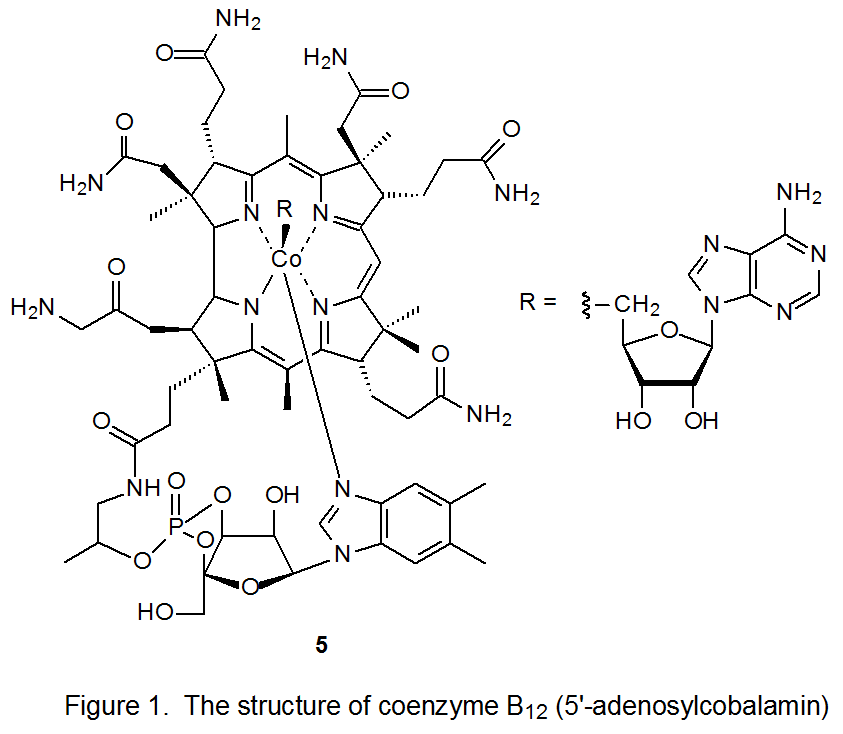
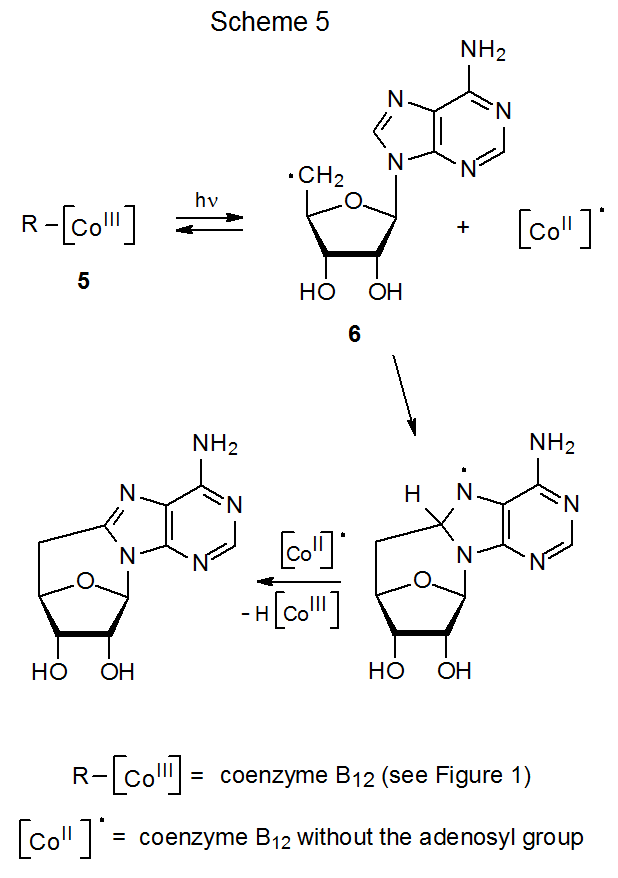
El estímulo original para el estudio de la homólisis del enlace carbono-cobalto como vía de formación de radicales centrados en carbono provino de la investigación de las reacciones de la coenzima B 12 (5). 8—10 En sistemas biológicos, la homólisis inducida por enzimas del enlace carbono-cobalto en 5 produce el radical 5'-desoxiadenosil 6 y el radical centrado en cobalto 7 (B 12r, eq 1). 8—10 En experimentos fuera de entornos biológicos, el radical 5'-desoxiadenosil (6) se produce a partir de la coenzima B 12 (5) por fotólisis con luz visible. 11 Cuando la fotólisis se realiza en ausencia de un donante efectivo de átomos de hidrógeno u otra trampa de radicales, la ciclación sigue a la homólisis del enlace carbono-cobalto (Esquema 5). 8-10,12
.png)
b. Complejos de Cobaloxima
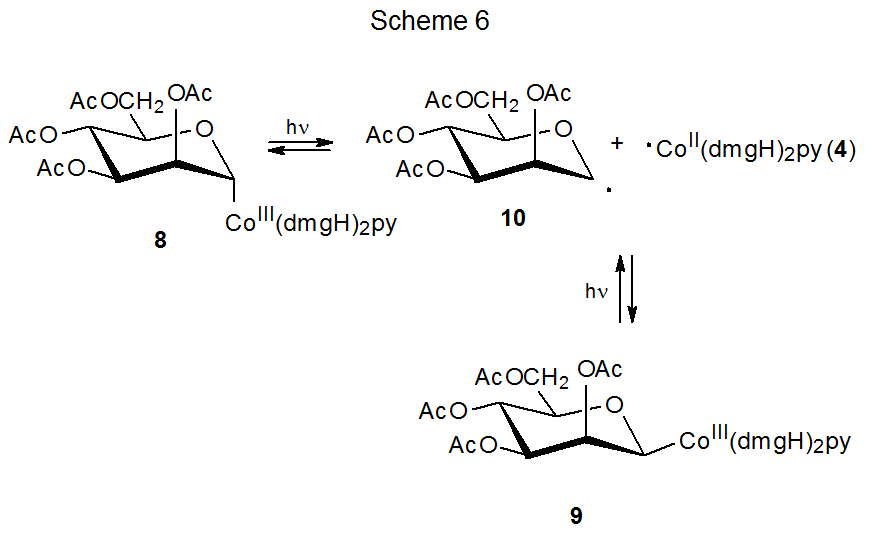
El descubrimiento de que la homólisis del enlace carbono-cobalto en la coenzima B 12 (5) produjo el radical 6 centrado en carbono (eq 1), condujo a la investigación de moléculas más simples que podrían modelar este comportamiento. Las cobaloximas son uno de varios tipos de compuestos encontrados para ser opciones efectivas para este papel. 13—16 Cobaloximas de carbohidratos 8 y 9 producen radicales 10 y 4, los cuales se recombinan en ausencia de trampas de radicales (Esquema 6). 13 En presencia de compuestos que reaccionan con radicales, 10 y 4 experimentan reacciones radicales características; así, el radical D-manopiranos-1-ilo 10 se añade al acrilonitrilo (11) para dar el radical aducto 12, que luego se combina con ·Co (dMGH) 2 py (4) para formar el producto de adición 13 (Esquema 7). 13
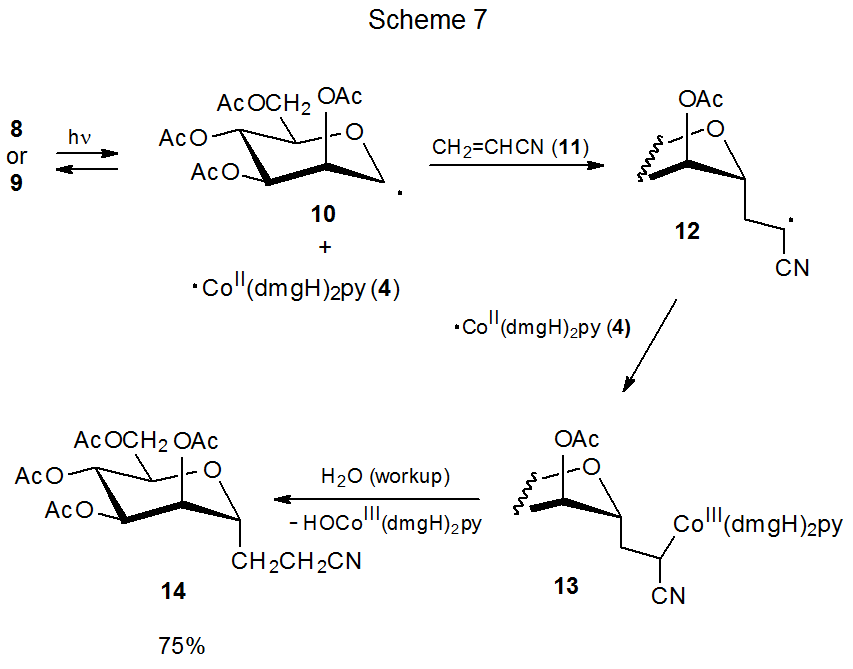
Una condición necesaria para la reacción mostrada en el Esquema 7 es que 4 [Co (dmGH) 2 py] sean lo suficientemente estables como para permanecer inalterados mientras se realiza la adición de 10 a 11. La estabilidad necesaria de 4 deriva de la protección de su centro radical por los ligandos unidos; así, 4 puede verse como un radical persistente.
c. El Efecto Persistente-Radical
Los radicales persistentes, como ·Co (dmGH) 2 py (4), son responsables de un tipo de reactividad conocido como efecto radical persistente. 17—19 Este efecto provoca una reacción que genera un radical persistente (R1 ·) y un radical transitorio (R2 ·) en cantidades iguales para dar un mayor rendimiento del producto de acoplamiento cruzado (R1 R2) de lo que se esperaría del acoplamiento radical aleatorio. La explicación para una mayor formación de producto de acoplamiento cruzado comienza con el reconocimiento de que aunque los radicales persistentes y transitorios se forman en cantidades iguales, esta igualdad es de corta duración. Debido a la naturaleza reactiva de los radicales transitorios, su concentración disminuye más rápidamente en las primeras etapas de una reacción que la concentración de radicales persistentes. (Los radicales transitorios se combinan, son desproporcionados y experimentan otras reacciones mucho más rápidamente que los radicales persistentes). La concentración más alta y rápidamente desarrollada de radicales persistentes en las primeras etapas de reacción significa que cualquier radical transitorio recién formado es más probable que encuentre y se combine con un radical persistente que con otro transitorio; en otras palabras, el producto de acoplamiento cruzado R 1 R 2 se convierte en el principal producto de acoplamiento.
Un ejemplo del efecto radical persistente se muestra en la reacción dada en el Esquema 4, donde la homólisis del enlace carbono-cobalto en 1 o 2 produce el radical persistente 4 y el radical transitorio 3. Incluso con el calentamiento prolongado o la fotólisis necesarios para alcanzar el equilibrio, no hubo evidencia de formación de un producto de acoplamiento distinto de los productos de acoplamiento cruzado 1 y 2. El efecto radical persistente también es operativo en la reacción de adición mostrada en el Esquema 7. En este caso el radical transitorio 12, producido por adición de 10 al acrilonitrilo (11), y el radical persistente 4 se combinan para formar el único producto de acoplamiento radical aislado.
2. Homólisis de enlace carbono-mercurio
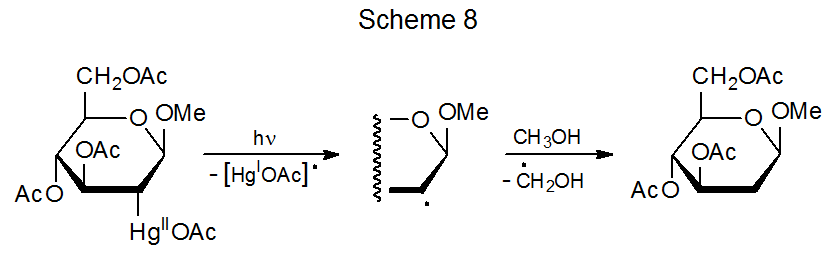
Hay similitudes en la reactividad entre los compuestos con enlaces C—Co y C—Hg. Ambos enlaces son lo suficientemente fuertes como para existir en estructuras estables a temperatura ambiente, pero ambos se escinden fácilmente tras la fotólisis. El resultado en cada caso es la formación de un radical centrado en metal y uno centrado en carbono. Los radicales centrados en carbono producidos por la homólisis de enlaces carbono-mercurio experimentan reacciones radicales típicas, como la abstracción de átomos de hidrógeno que se muestra en el Esquema 8. 20
3. Acetato de Manganeso (III) [Mn (OAc) 3] Reacciones
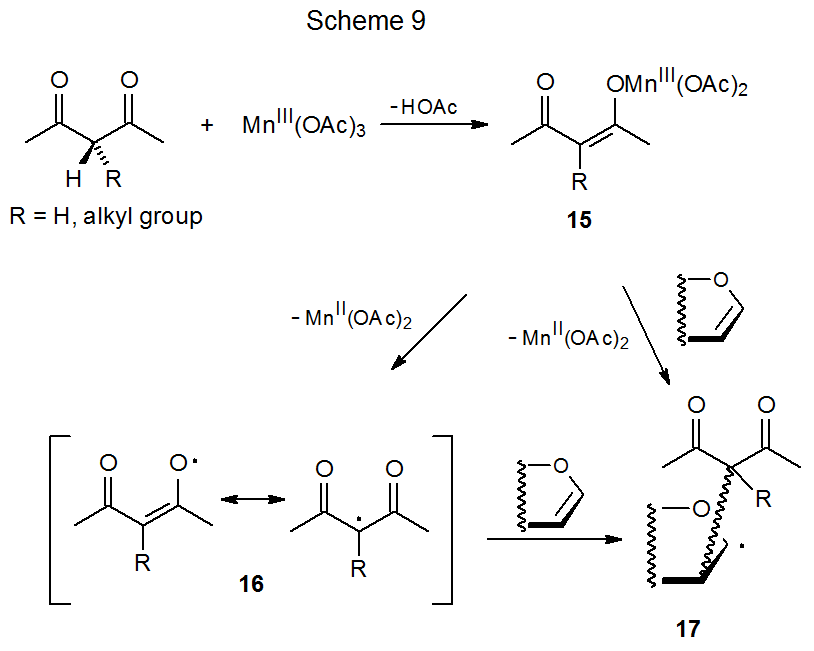
Los radicales centrados en carbono pueden generarse por reacción del acetato de manganeso (III) con compuestos ácidos de Ch como la β-dicetona que se muestra en el Esquema 9. 21—24 El primer paso en este proceso es la formación del enolado 15. 23 En presencia de un compuesto insaturado se consideran posibles dos mecanismos de reacción de 15. En la primera de estas formas de transferencia de electrones acetato de manganeso (II) y el radical estabilizado por resonancia 16, que luego se suma a un compuesto insaturado. Una segunda vía posible de adición es un proceso concertado en el que el enolato 15 reacciona directamente con el compuesto insaturado para producir el radical aducto 17 (Esquema 9). 23 Se cree que la reacción por cualquiera de estas vías tiene lugar por transferencia de electrones de la esfera interna.
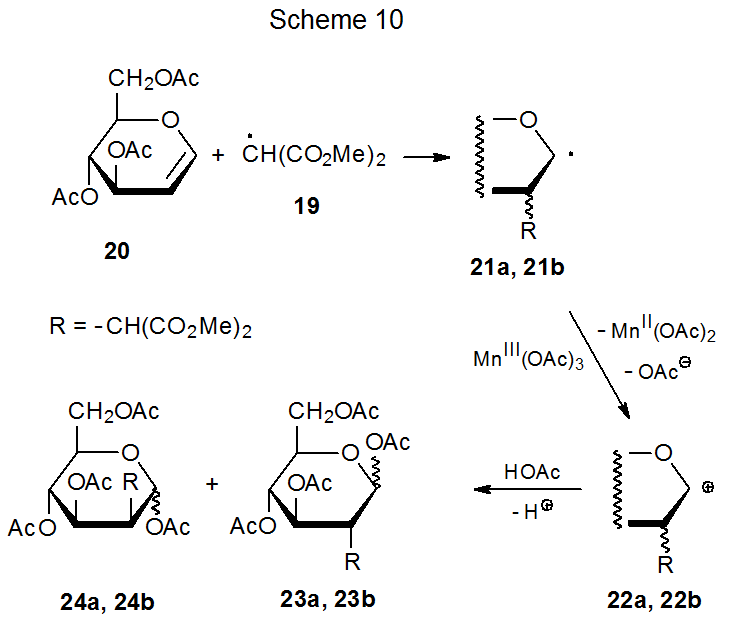
Dado que los centros radicales con dos grupos carbonilo unidos son electrófilos, radicales como 16 (Esquema 9) se agregan más fácilmente a compuestos insaturados con múltiples enlaces ricos en electrones. 22 Este es el punto en el que los carbohidratos típicamente se involucran en reacciones iniciadas por el acetato de manganeso (III) debido a que los glicales tienen sistemas π ricos en electrones que son dianas atractivas para la adición de radicales electrófilos; por ejemplo, el radical 19, formado por reacción de dimetilmalonato (18) con acetato de manganeso (III) (eq 2), se suma al tri- O-acetil - D-glucal 20 para producir los radicales estereoisoméricos 21a y 21b (Esquema 10). 25,26 Esta adición, que ocurre regioselectivamente en C-2, es seguida por la oxidación de los radicales resultantes con una segunda molécula de acetato de manganeso (III) para dar los cationes 22a y 22b correspondientes. Estos cationes reaccionan con el disolvente (ácido acético) para producir los productos finales (23a, 23b, 24a y 24b). El acetato de manganeso (III), por lo tanto, está involucrado tanto en la formación como en la desaparición de los radicales en esta reacción. (Los radicales electrófilos y otros aspectos de la filicidad radical se discuten en el Capítulo 7.)
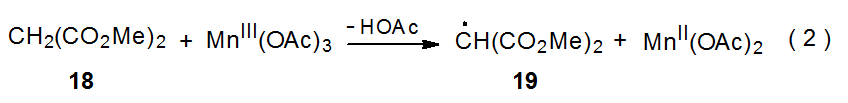.png)
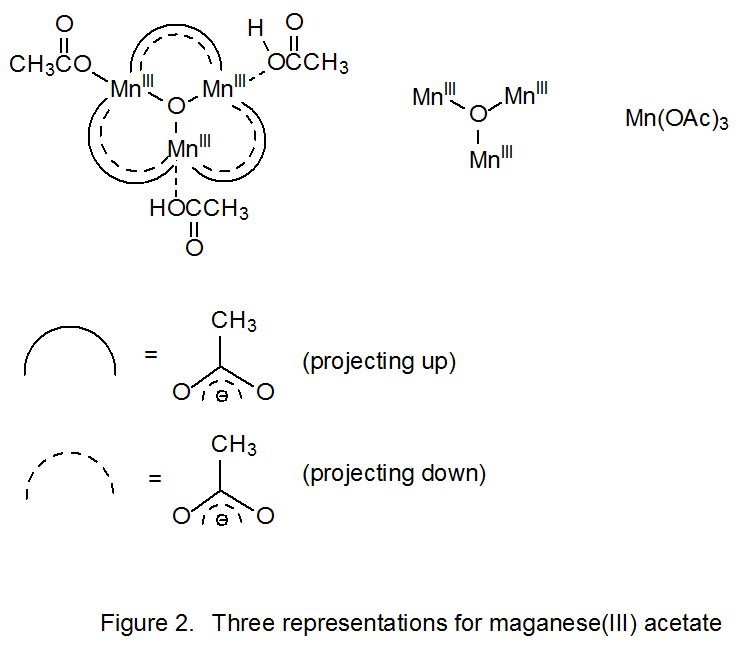
El acetato de manganeso (III) tiene una estructura más complicada de lo que indica la fórmula Mn (OAc) 3. Es un trímero oxocentrado de tres iones manganeso unidos por seis acetatos puente. 27—29 Tres representaciones para esta estructura se muestran en la Figura 2. A menudo es conveniente para discutir las reacciones de este compuesto usar la fórmula abreviada Mn (OAc) 3.
4. Amonio Cerio (IV) Nitrato [(NH 4) 2 Ce (NO 3) 6] Reacciones
La reacción de compuestos CH-ácidos con nitrato de amonio cerio (IV) genera radicales electrofílicos estabilizados por resonancia de manera similar a la reacción con acetato de manganeso (III). 30,31 Como se mencionó en la sección anterior, estos radicales se agregan fácilmente a los dobles enlaces ricos en electrones tales como los que se encuentran en los glicales (eq 3). 30 La oxidación de compuestos CH-ácidos con nitrato de amonio cerio (IV) para producir radicales electrófilos tiene la ventaja, en comparación con las reacciones con acetato de manganeso (III), de poder realizarse a temperatura ambiente o por debajo de ella. [Las reacciones del acetato de manganeso (III) y el nitrato de amonio cerio (IV) se discuten más a fondo en el Capítulo 21 del Volumen II.]
.png)

